藤茶中二氢杨梅素对乳酸菌生长及活性的影响
2021-06-04樊庆涛孙湘沛刘华英
樊庆涛,孙湘沛,刘 梁,赵 玲,刘华英,陈 新*
(1.武汉轻工大学 生命科学与技术学院,湖北 武汉 430023;2.湖北来凤腾升香料化工公司,湖北 恩施 445700)
藤茶(Ampelopsis grossedentata),又称茅岩青霜茶、青霜古藤茶、土家莓茶、龙须茶等,中国最早的《诗经总集》称为古茶勾藤,是指由藤本植物制作出来的茶。二氢杨梅素(dihydromyricetin,DMY)作为藤茶中主要的黄酮类化合物,占藤茶总黄酮的70%以上,近年来其生理活性受到广泛关注[1-4]。既往研究证实二氢杨梅素具有抗氧化、调节血脂、改善肠道菌群丰度[5-7]等多方面活性。此外,二氢杨梅素还具有解除酒精中毒,预防酒精肝、脂肪肝等作用[8-10]。
乳酸菌是重要的食品酿造微生物及益生菌来源[11],同时它也是人体中胃和小肠内的主要益生菌。在许多酸奶及益生菌制剂中常用到混合乳酸菌作为益生元添加在食品中[12-13]。乳酸菌可以通过释放乳酸、乙酸和一些对有害菌起作用的抗菌素,抑制肠道不良微生物的增殖,调节肠道菌群平衡,同时它还兼具抗癌、增强机体免疫力与抗衰老等作用[14-15]。
将DMY加入到酸奶等乳酸菌发酵食品中,开发一种既能调节血脂、保肝护肝又可以解酒醒酒的功能性食品。但目前关于藤茶中的二氢杨梅素对乳酸菌生长及活性的影响鲜见报道。因此,本试验以藤茶二氢杨梅素为对象,选取嗜酸乳杆菌(Lactobacillus acidophilus)、德氏乳杆菌保加利亚亚种(Lactobacillus delbrueckiisubsp.bulgaria)、嗜热乳酸链球菌(Streptococcus thermophilus)三种酸奶中常见的乳酸菌,采用流式细胞术等方法研究二氢杨梅素对其生长及活性的影响,旨在为藤茶酸奶的研究开发提供技术和理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
嗜酸乳杆菌(Lactobacillus acidophilus,LA)AS1.2686、德氏乳杆菌保加利亚亚种(Lactobacillus bulgaricussubsp.bulgaria,LB)CICC6045、嗜热乳酸链球菌(Streptococcus thermophilus,ST)CICC6038:上海保藏生物技术中心(Shanghai Conservation Biotechnology Center,SHBCC)。
1.1.2 化学试剂
二氢杨梅素(纯度>98%):本实验室从来凤藤茶中提取,经红外光谱及核磁共振谱鉴定;二甲基亚砜(dimethyl sulfoxide,DMSO)(分析纯):上海翊圣生物科技有限公司;碘化丙啶(propidium iodide,PI)(分析纯):德国Biofroxx生物试剂公司;甲醇(色谱纯):美国TEDIA天地试剂公司;其他试剂均为国产分析纯;实验用水为超纯水。
1.1.3 培养基和缓冲液
MRS培养基[16]:10 g/L 蛋白胨,10 g/L 牛肉膏,5 g/L 酵母提取物,2 g/LK2HPO4,2 g/L柠檬酸二铵,5 g/L乙酸钠,1 mL/L吐温80,0.58 g/L MgSO4·7H2O,0.25 g/L MnSO4·4H2O,20 g/L葡萄糖,pH 6.3。121 ℃灭菌20 min。
磷酸盐缓冲液(phosphate buffer solution,PBS)[17]:9 g/L NaCl,795mg/LNa2HPO4·7H2O,144 mg/LKH2P4溶于1 000 mL超纯水中,调节pH值至7.4。121 ℃灭菌20 min。
1.2 仪器与设备
CJ-1F型超净工作台:苏州市金燕净化设备有限公司;TL-205台式高速冷冻离心机:长沙平凡仪器仪表有限公司;CytoFLEXS流式细胞仪:贝克曼库尔特商贸有限公司;Agilent-1260高效液相色谱(high performance liquid chromatography,HPLC)仪:美国安捷伦公司;细菌滤膜(0.22 μm):上海兴亚净化材料厂。
1.3 实验方法
1.3.1 菌种活化及种子液制备
将保存于-10~-20 ℃的3种菌种冻干管分别取出,用无菌吸管吸取适宜的无菌水,滴入冻干管内,充分混匀,使冻干菌体溶解成悬浮状液体。接种到MRS 培养基中37 ℃静置培养72 h。将培养液于MRS琼脂上划线,挑取单菌落,一份用于MRS斜面划线,37 ℃培养,有菌落成形后,挑取单菌落转接于装有100 mL MRS培养基的锥形瓶中,同条件下培养48 h,制成种子液;另一份挑取1~2环菌落于菌种保藏管内,与甘油混合均匀后于-80 ℃冰箱长期保存[18]。
1.3.2 无菌二氢杨梅素标准溶液配制
准确称取DMY 100 mg,用3 mL DMSO溶解,缓慢加入超纯水,待冷却至室温时,于10 mL容量瓶中定容,配制成10 mg/mL的DMY标准溶液。将容量瓶外壁用体积分数75%酒精消毒液擦拭,转入超净工作台中,取无菌注射器吸取溶液,过0.22 μm细菌滤膜置于无菌EP管中备用。
1.3.3 实验设计及菌种培养
三种乳酸菌分别单独培养,每种培养实验设置1个空白对照组(空白对照组加入同等浓度的DMSO水溶液)及5个实验组(D1~D5)见表1,每组3个平行样,每组MRS培养基均为50 mL,种子液接种量均为6%。实验组分别加入100 μL、300 μL、500 μL、1 000 μL、2 000 μL无菌DMY标准溶液,于37 ℃下厌氧静置培养48 h。
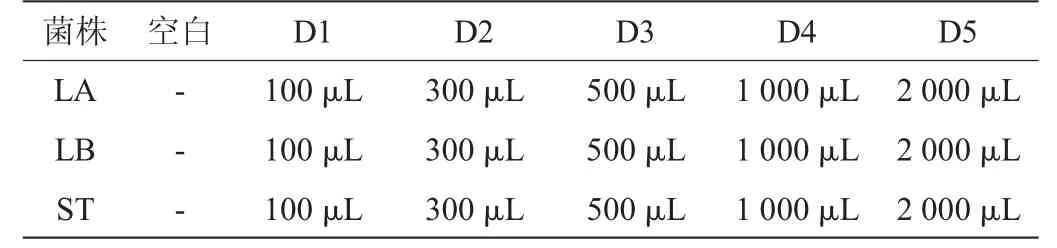
表1 二氢杨梅素添加量实验设计方案Table 1 Experimental design of dihydromyricetin addition
1.3.4 DMY浓度对菌株生长影响
取培养菌液分别充分摇匀,于超净工作台中取5 mL,在波长600 nm处测量空白对照组吸光度值(OD600nm值),然后分别测量各菌液吸光度值(OD600nm值),每个样品测定3次,取平均值。
1.3.5 乳酸菌数量及活性检测
取培养菌液分别充分摇匀,分别以无菌操作20倍稀释,吸取100 μL的稀释菌液,加入10 μL质量浓度为1 mg/mL 的PI染液(PI浓度应控制在0.002%的潜在毒性以下),再加入1 mL灭菌PBS缓冲液,后置于37 ℃恒温培养箱中孵育15 min后上流式,以30 μL/min的上样流速分别检测乳酸菌颗粒数及活性[19-23]。
1.3.6 三种菌液中发酵后DMY测定
称取DMY标准品10 mg,用无水乙醇溶解并定容至50 mL容量瓶中,制成质量浓度为0.2 mg/mL的标准品母液,分别用移液枪吸取1 mL、2 mL、4 mL、6 mL、8 mL、10 mL标准品母液,用无水乙醇定容至10 mL容量瓶中,共配成6个浓度梯度的标准品溶液,分别进HPLC仪中检测并绘制DMY标准曲线。
将空白组和实验组菌液充分混匀后分别取30 mL,分别加入15 mL无水乙醇,静置15 min后,于6 000 r/min、-2 ℃条件下离心15 min,取上清液,过0.22 μm有机滤膜,用HPLC分别进行DMY含量测定。
HPLC条件[24-25]:Agilent C18色谱柱(4.6 mm×250 mm,5 μm);流动相:甲醇-0.03%磷酸,梯度洗脱(0 min,甲醇-0.03%磷酸比例为12∶88;25 min,甲醇-0.03%磷酸比例为65∶35;35~40 min,甲醇-0.03%磷酸比例为12∶88);检测波长290 nm;流速0.7 mL/min;柱温35 ℃,进样量5 μL。
2 结果与分析
2.1 不同DMY浓度对三种乳酸菌生长的影响
不同DMY浓度对菌株LA、LB、ST生长的影响见图1,结果显著性分析结果见表2。由图1可知,10 mg/mL DMY添加量在1 000 μL以下时,对菌株LA和ST的生长有促进作用,而对于菌株LB 而言,DMY的添加量在500 μL以下时其促进生长作用不明显。而当DMY添加量>1 000 μL时,三种菌生长均受到抑制。由表2可知,在菌株LA中除D5组与空白组无显著性差异外,其余各组均具有显著性差异(P<0.05);在菌株LB中各组均无显著性差异(P>0.05);在菌株ST中各组均与空白组具有显著性差异(P<0.05)。
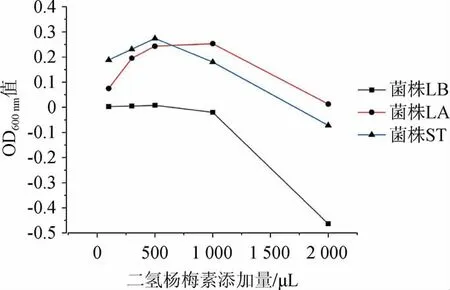
图1 不同二氢杨梅素浓度对三种乳酸菌生长的影响Fig.1 Effects of different dihydromyricetin concentration on the growth of three lactic acid bacteria
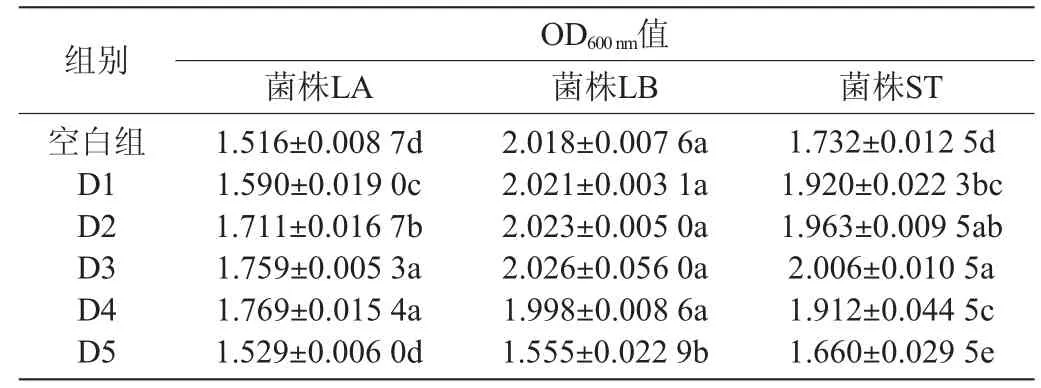
表2 不同二氢杨梅素浓度的三种乳酸菌OD600nm值显著性差异分析Table 2 Significant difference analysis of OD600nm value of three kinds of lactic acid bacteria with different dihydromyricetin concentrations
2.2 不同DMY浓度对三种乳酸菌活性的影响
在流式检测中,根据各细菌群光散射信号和PI荧光信号对细胞群落进行划分,选取目标群落,数据显著性分析结果见表3。由表3可知,LA实验组中空白组与D4组无显著性差异(P>0.05),其余各组均存在显著性差异(P<0.05)。LB实验组中D1组与D2组无显著性差异(P>0.05),其余各组均存在显著性差异(P<0.05)。ST实验组中空白组与D1组无显著性差异(P>0.05),其余各组均存在显著性差异(P<0.05)。
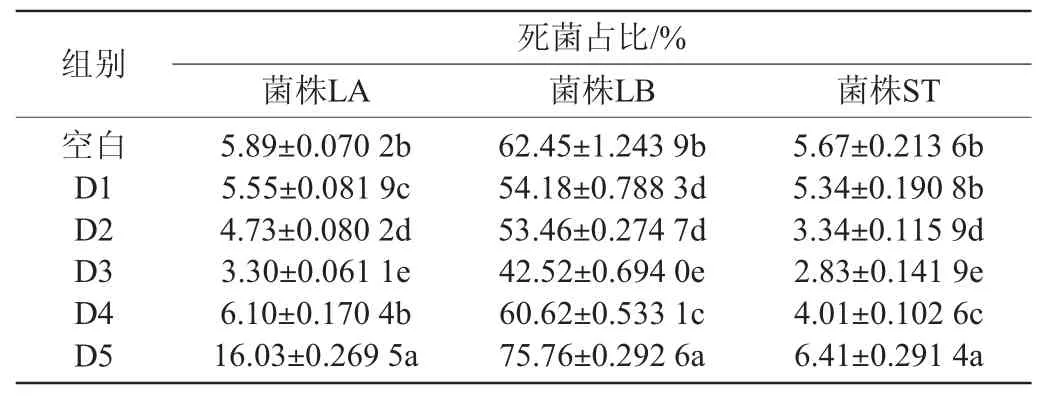
表3 流式细胞术检测不同实验组死菌占比显著性差异分析Table 3 Analysis of the significant difference of the proportion of dead bacteria in different experimental groups detected by flow cytometry
通过对不同DMY添加量的菌株LA实验组进行流式分析见图2。由图2可知,其中LA-D1组至LA-D3组高荧光强度颗粒从5.55%逐渐减少到3.30%,在LA-D4组至LA-D5组中又逐渐升高至16.03%。通过与空白组对照,在D1~D3组实验中,菌株LA中被荧光标记的死菌数量随着DMY浓度的增高而降低,在D4~D5组实验中,菌株LA死菌数量随着DMY浓度增高而增高。
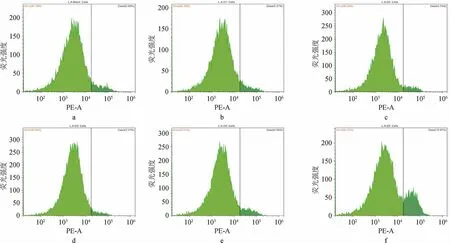
图2 嗜酸乳杆菌在不同二氢杨梅素浓度下的流式荧光直方图Fig.2 Flow cytometric fluorescence histograms of Lactobacillus acidophilus at different dihydromyricetin concentrations
通过对不同DMY添加量的菌株LB实验组进行流式分析见图3。由图3可知,其中LB-D1至LB-D3组高荧光颗粒从54.18%逐渐减少到42.52%,LB-D4至LB-D5中又逐渐升高至75.76%。通过与空白组对照,在D1~D3组实验中,菌株LB中被荧光标记的死菌数量随着DMY浓度增高而降低,在D4~D5组实验中,菌株LB活菌数量随着DMY浓度增高而增高。与菌株LA相比,菌株LB对DMY的添加所表现出来的抑制作用更为敏感。
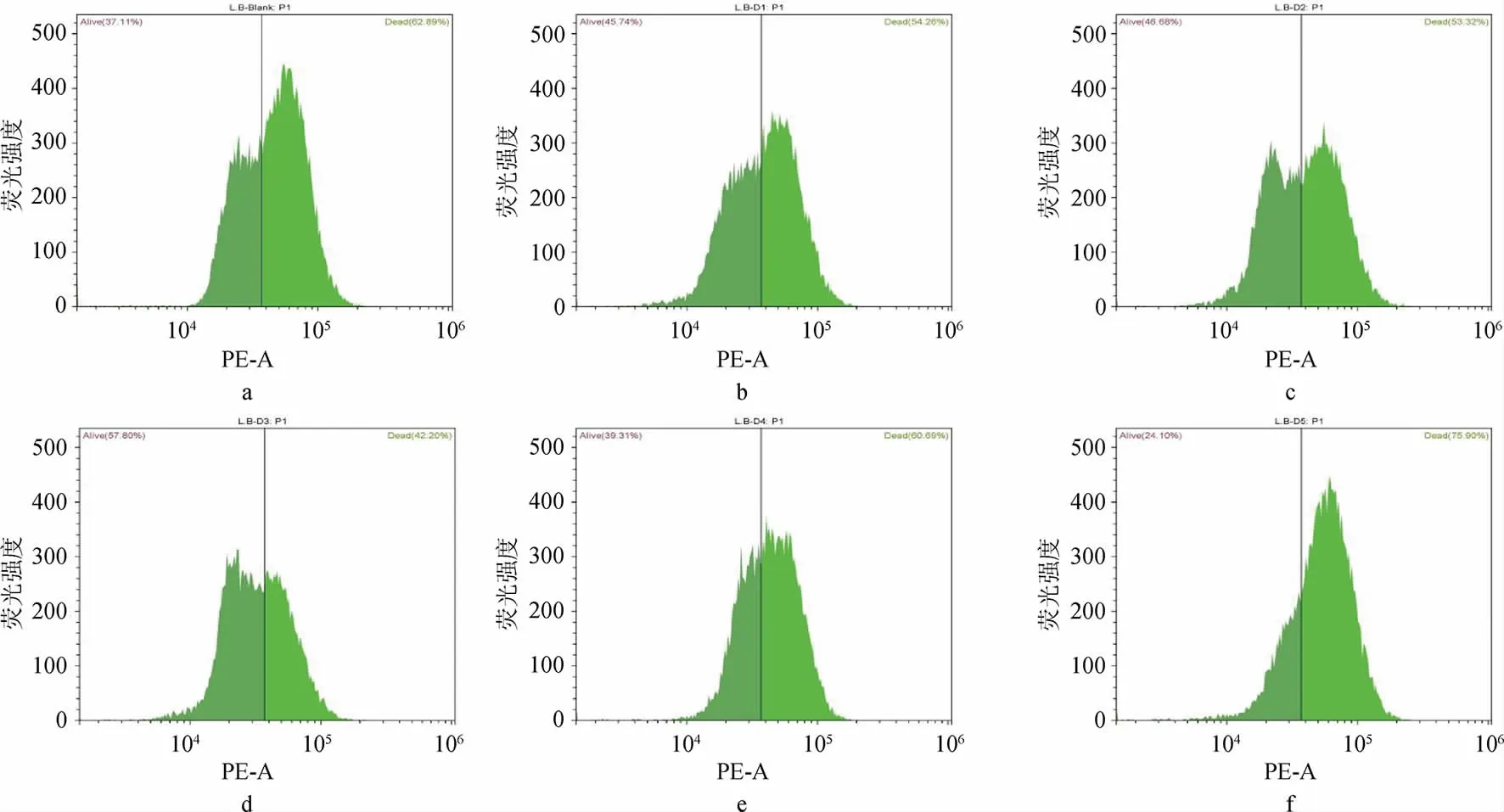
图3 德氏乳杆菌保加利亚亚种在不同二氢杨梅素浓度下的流式荧光直方图Fig.3 Flow cytometric fluorescence histograms of Lactobacillus delbrueckii subsp. bulgaria at different dihydromyricetin concentrations
通过对不同DMY添加量的菌株ST实验组进行流式分析见图4。由图4可知,其中ST-D1至ST-D3组高荧光颗粒从5.34%逐渐减少到2.83%,ST-D4至ST-D5中又逐渐升高至6.41%。通过与空白组对照,在D1~D3组实验中,菌株ST被荧光标记的死菌数量随着DMY浓度增高而降低,在D4~D5组实验中,ST死菌数量随着DMY浓度增高而升高。
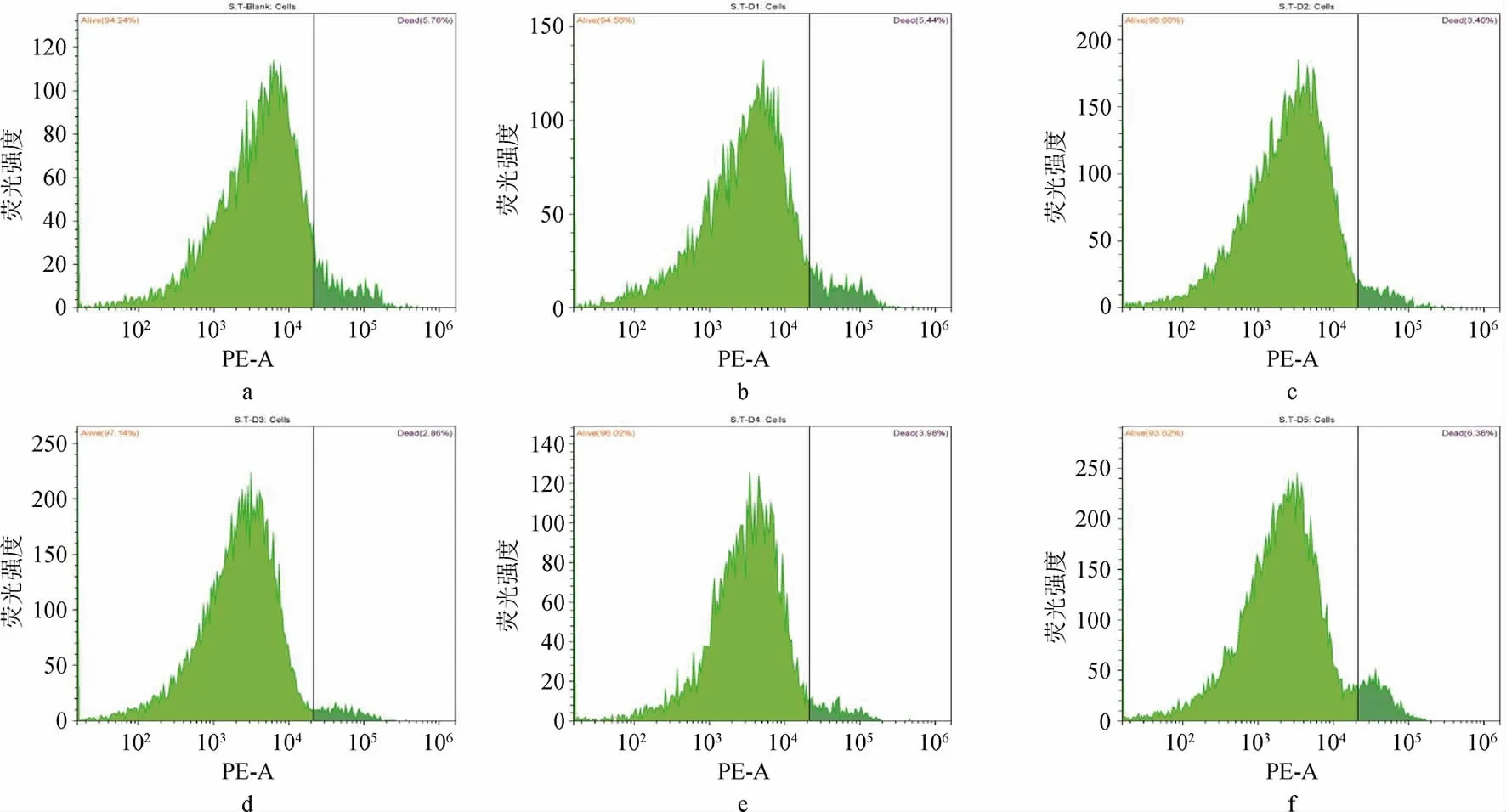
图4 嗜热链球菌在不同二氢杨梅素浓度下的流式荧光直方图Fig.4 Flow cytometric fluorescence histograms of Streptococcus thermophilus at different dihydromyricetin concentrations
通过分析流式实验结果,三种乳酸菌在DMY添加质量浓度为在100~1 000 mg/L时,均表现出了菌液中死菌数量显著减少的趋势,而当DMY质量浓度>1 000 mg/L时菌液中死菌数量显著增加。
2.3 三种乳酸菌发酵后发酵液DMY含量测定
以DMY标准溶液(x)为横坐标,峰面积(y)为纵坐标绘制DMY标准曲线,DMY标准曲线回归方程为y=34 036x+20.292,相关系数为R2=0.999 7,表明二者线性关系良好。
三种不同的乳酸菌菌液DMY含量HPLC分析结果见图5~图7。依据标准曲线回归方程计算DMY含量结果见表4。由表4可知,3菌株菌液中DMY含量未发生明显变化,说明乳酸菌并未或极少代谢DMY。

图5 嗜酸乳杆菌发酵液二氢杨梅素含量测定高效液相色谱图Fig.5 HPLC chromatogram of dihydromyricetin contents of Lactobacillus acidophilus fermentation broth by HPLC
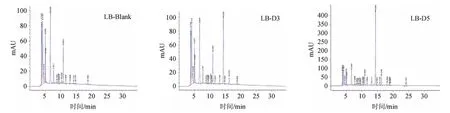
图6 德氏乳杆菌保加利亚亚种菌发酵液二氢杨梅素含量测定高效液相色谱图Fig.6 HPLC chromatogram of dihydromyricetin contents of Lactobacillus delbrueckii subsp. bulgaricus fermentation broth
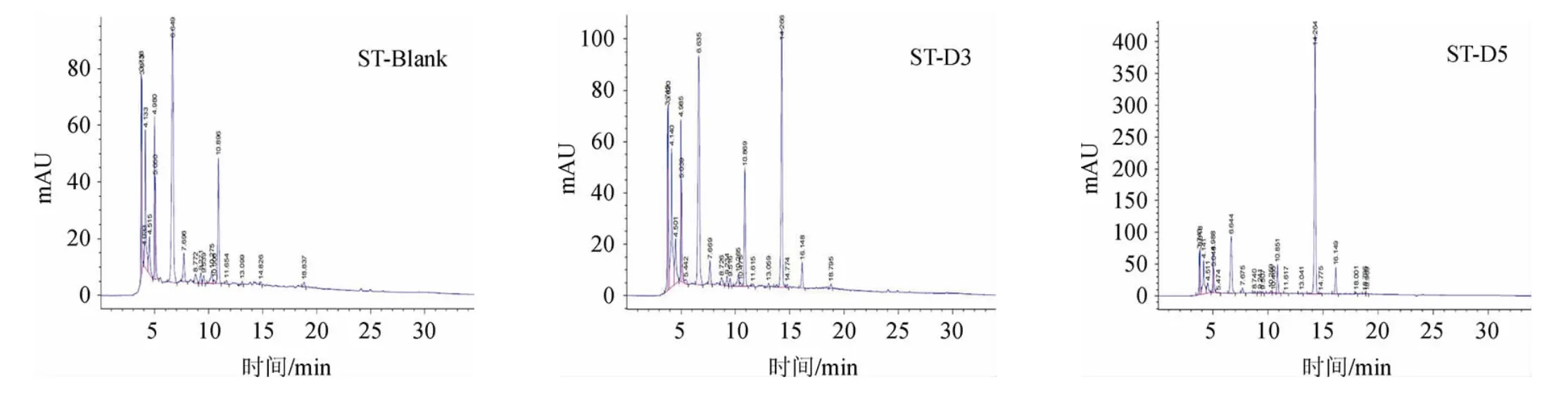
图7 嗜热链球菌发酵液二氢杨梅素含量测定高效液相色谱图Fig.7 HPLC chromatogram of dihydromyricetin contents of Streptococcus thermophilus fermentation broth
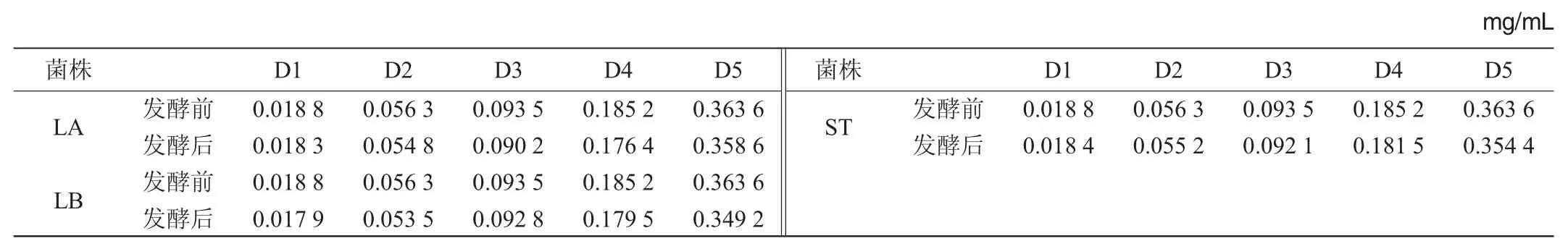
表4 发酵前后菌液中二氢杨梅素含量Table 4 Content of dihydromyricetin in the solution before and after fermentation
3 结论
不同DMY添加量对三种乳酸菌的生长和活性均有影响,表现出双向调节的作用。其中DMY添加量在100~1000mg/L时,LA、ST的生长和活性促进作用呈显著增长趋势,LB的生长促进作用不显著,活性促进作用显著。当DMY添加量在1 000~2 000 μg/mL时,三种菌的生长和活性均被显著抑制。DMY往往表现为低渗透性和低生物利用度,所以在菌液发酵前后含量并无明显变化。由于DMY拥有较强的抑制有害菌能力,故可以在低浓度时影响菌液环境从而增强乳酸菌生长和活性。所以,在应用上述三种乳酸菌发酵时可适量添加DMY使其促进发酵,并为发酵产物添加新的活性成分。
