植物乳杆菌ZJ316高密度发酵条件优化
2021-06-04杨江华韦宇拓
李 娜,杨江华,韦宇拓
(广西大学生命科学与技术学院 亚热带农业生物资源保护与利用国家重点实验室,广西 南宁 530004)
乳酸菌是指发酵糖类后主要产物为乳酸的一类没有芽孢的革兰氏阳性细菌[1-2],因其具有耐胆盐、耐酸、抑制有害微生物生长等益生功能,被广泛应用于发酵食品和饮料的生产中[2-3]。
植物乳杆菌(Lactobacillus plantarum)是目前常用的益生菌之一,常见于奶油、肉类及许多蔬菜发酵制品中,而且在人体胃肠道也常发现它的存在[4-5],其具有抗衰老[6]、减轻肠道生态失调[7]、提高青贮有氧稳定性[8]等功能。近几年,国内外研究学者陆续发现了植物乳杆菌的其他功能,如植物乳杆菌CCFM436可以减少锰离子在组织中的积累[9];植物乳杆菌H6可显著降低高胆固醇血症饮食小鼠的血清胆固醇水平[10];植物乳杆菌发酵显著降低了水稻中镉的水平,并且被认为是开发无镉大米食品的一种策略[11]。
高细胞密度发酵(high cell density fermentation,HCDF)是指在一定的培养条件和体系内,在不影响胞内产物积累的基础上,尽可能多的积累生物量[12-14]。工业化生产,需要用低成本的培养基发酵生产出更高的产物。高密度培养核心在于为菌体提供合适的营养成分和生长条件[15-16]。随着食品、饲料等需规模化生产的产品对发酵工艺的要求逐步提高,摸索发酵剂的高活力的保存便显得更加重要[17-18]。本研究的主要目的是以植物乳杆菌ZJ316为研究对象,在MRS液体培养基的基础上,采用单因素试验及响应面试验对其高密度发酵的培养基组成及发酵条件进行优化,为今后植物乳杆菌的保藏以及作为发酵剂奠定基础。
1 材料与方法
1.1 菌种和试剂
1.1.1 菌种
植物乳杆菌(Lactobacillus plantarum)ZJ316:由广西大学生命科学与技术学院国家重点实验室筛选并保藏。
1.1.2 试剂
蔗糖、牛肉膏、酵母粉、磷酸氢二钾、七水硫酸镁、四水硫酸锰、柠檬酸铵、三水合乙酸钠、柠檬酸(均为分析纯或生化试剂):上海生物工程有限公司;吐温80(分析纯):国药集团试剂有限公司;玉米浆干粉:北京鸿润宝顺有限公司。
1.1.3 培养基
MRS液体培养基[19]:葡萄糖20.00 g,蛋白胨10.00 g,牛肉膏5.00 g,酵母粉4.00 g,吐温80 1.00 mL,七水磷酸氢二钾2.00 g,七水硫酸镁0.20 g,四水硫酸锰0.05 g,柠檬酸三铵2.00 g,三水合乙酸钠5.00 g,加蒸馏水至1 000 mL,调节pH值为6.2。115 ℃高压蒸汽灭菌15 min。固体培养基中添加15 g琼脂粉。
1.2 仪器与设备
GNP-9160隔水式恒温培养箱:上海精宏实验设备有限公司;雷磁E-201-C pH计:上海仪电科学仪器股份有限公司;U Quamt TM酶标仪:美国Biotek公司;Eppendorf Centrifuge 5415D台式离心机:德国Eppendorf公司;BIOTECH-5BG-4 5L多联发酵罐:上海保兴生物设备工程有限公司。
1.3 实验方法
1.3.1 菌体密度的测定
将发酵后的菌液稀释至合适的倍数,用紫外分光光度计测定菌液在波长600 nm处的吸光度值(OD600nm值)。
1.3.2 活菌数的测定
乳酸菌活菌数的测定方法按照国标GB 4789.35—2016《食品安全国家标准食品微生物学检验乳酸菌检验》[20]执行。
1.3.3 pH值的测定
采用pH计在室温条件下测定发酵后菌液的pH值。
1.3.4 种子液的制备
将在-80 ℃冰箱中甘油保存的菌种,在MRS固体培养基上划线,挑取单菌落至MRS液体培养基中,放置37 ℃恒温培养箱中培养10 h,作为种子液。
1.3.5 植物乳杆菌ZJ316高密度发酵培养基优化单因素试验
碳源种类及其添加量的确定:用20 g/L的麦芽糖、蔗糖、α-乳糖、淀粉依次代替MRS液体培养基的葡萄糖。按2%(V/V)的接种量接种于含有50 mL不同碳源培养基的250 mL的锥形瓶中,初始pH值为6.2,在37 ℃恒温培养箱中静置发酵24 h,然后测定菌液的菌体密度。筛选出最适碳源后,考察碳源添加量(10 g/L、30 g/L、50 g/L、70 g/L、90 g/L)对菌体密度的影响。
氮源种类及其添加量的确定:在优化碳源的基础上,用19 g/L的玉米浆干粉、酵母粉、蛋白胨、大豆蛋白胨、牛肉膏依次代替MRS液体培养基中的主要氮源(蛋白胨、牛肉膏、酵母粉),以优化碳源后的MRS培养基作为对照。测定菌液的菌体密度,筛选出最适氮源。在此基础上,考察氮源添加量(0、20 g/L、60 g/L、100 g/L、140 g/L)对菌体密度的影响。
缓冲盐种类及浓度的确定:在碳氮源优化的基础上,用NaH2PO4-Na2HPO4、KH2PO4-Na2HPO4、Na2HPO4-柠檬酸缓冲盐体系依次代替MRS液体培养基中的缓冲盐(乙酸钠、磷酸氢二钾、柠檬酸三铵),三种缓冲盐体系的浓度分别选择0、0.05 mol/L、0.10 mol/L、0.15 mol/L、0.20 mol/L。测定菌液的菌体密度,筛选出最适缓冲盐。
微量元素添加量的确定:在最适碳、氮源、缓冲盐的基础上,依次考察硫酸镁添加量(0、0.2 g/L、0.4 g/L、0.8 g/L、1.2 g/L)、硫酸锰添加量(0.05 g/L、0.1 g/L、0.2 g/L、0.3 g/L、0.4g/L)、吐温80添加量(0.5mL/L、1.0mL/L、2.0mL/L、3.0mL/L、4.0 mL/L)对菌体密度的影响。
1.3.6 植物乳杆菌ZJ316高密度发酵培养基优化响应面试验
根据单因素试验结果,选取对菌体密度影响显著的3个因素蔗糖添加量(A)、玉米浆干粉添加量(B)、Na2HPO4-柠檬酸浓度(C)为考察因素,以OD600nm值为响应值,利用Design-Expert 12.0软件的Box-Behnken试验设计进行3因素3水平的响应面试验,试验因素与水平见表1。
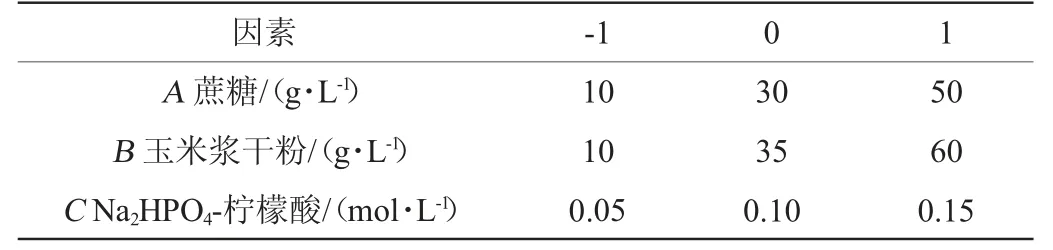
表1 植物乳杆菌ZJ316高密度发酵培养基优化Box-Behnken试验因素与水平Table 1 Factors and levels of Box-Behnken tests for Lactobacillus plantarum ZJ316 high-density fermentation medium optimization
1.3.7 植物乳杆菌ZJ316高密度发酵培养条件的优化
采用优化后的培养基,将初始pH值调为6.2,依次考察接种量(1%、2%、3%、4%和5%)、发酵温度(20 ℃、25 ℃、30 ℃、35 ℃、40 ℃)、初始pH值(5.0、5.5、6.0、6.5、7.0)对菌体密度的影响。
1.3.8 植物乳杆菌ZJ316生长曲线的测定
将活化之后的植物乳杆菌ZJ316的种子液接种于3 L优化培养基(5 L发酵罐),在优化条件进行发酵,每隔3 h取样检测其活菌数、OD600nm值,每个时间点做三个平行,以MRS液体培养基为对照,绘制出菌株在优化培养基和MRS液体培养基的生长曲线。
2 结果与分析
2.1 植物乳杆菌ZJ316高密度发酵培养基优化试验
2.1.1 碳源的选择
碳源种类及其添加量对植物乳杆菌ZJ316生长的影响见图1。
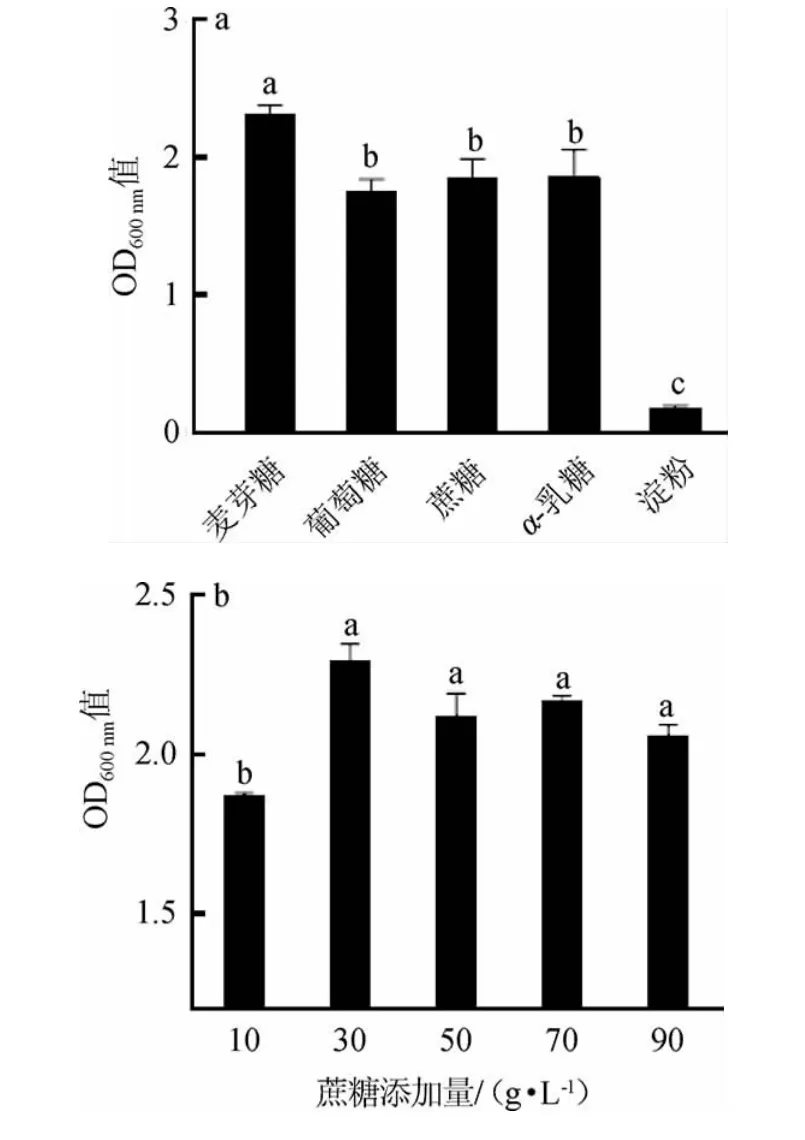
图1 不同碳源种类(a)及蔗糖添加量(b)对植物乳杆菌ZJ316生长的影响Fig.1 Effect of different carbon source types(a)and sucrose additions(b)on the growth of Lactobacillus plantarum ZJ316
由图1a可知,当20 g/L的麦芽糖作为碳源时,OD600nm值最高为2.31,蔗糖、α-乳糖次之,淀粉最低,说明植物乳杆菌ZJ316对麦芽糖的利用效率最好,这与DONG Z等[21]的研究结果一致。虽然植物乳杆菌ZJ316对麦芽糖利用效率最好,但是价格昂贵,根据节约成本原则,后续将选择蔗糖作为培养基的最适碳源。
由图1b可知,当蔗糖添加量为30 g/L时,植物乳杆菌ZJ316的OD600nm值最高达到2.30,继续增加蔗糖添加量至90 g/L,OD600nm值下降至2.06。这可能是由于碳源浓度过高,抑制了植物乳杆菌ZJ316的生长代谢。因此,确定蔗糖的最适添加量为30 g/L。
2.1.2 氮源的选择
氮源种类及其添加量对植物乳杆菌ZJ316生长的影响见图2。
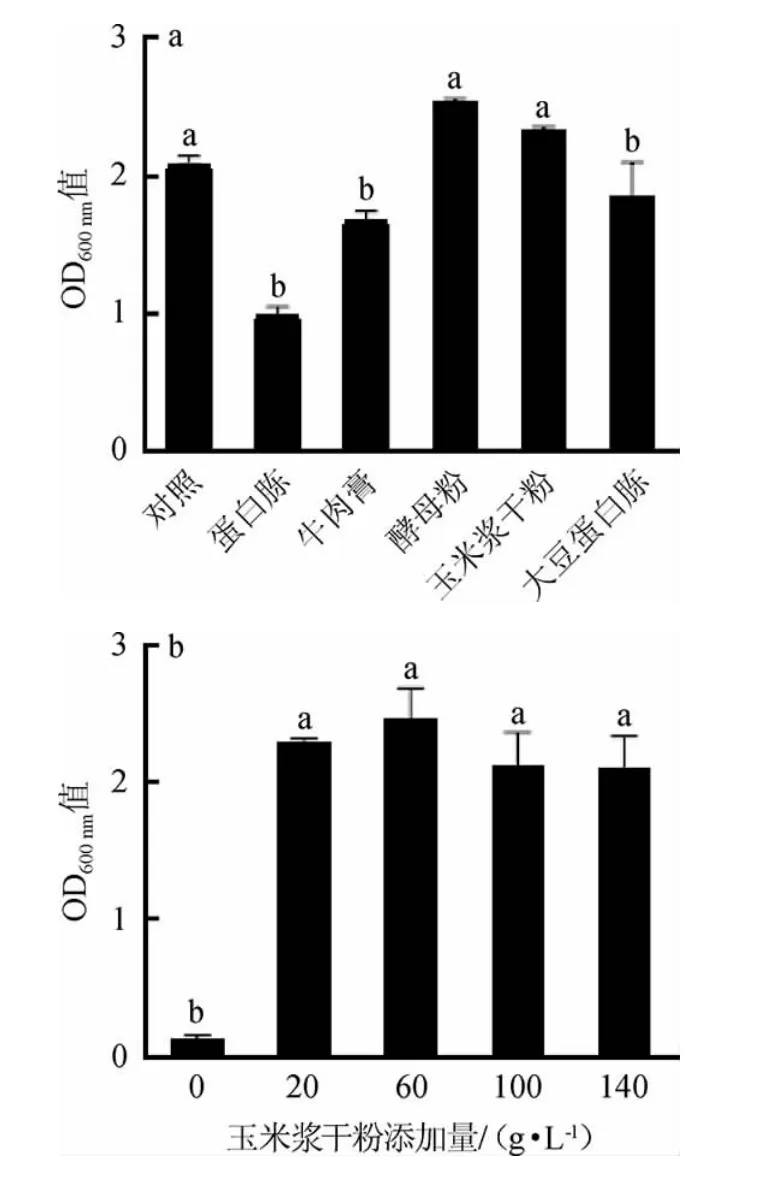
图2 不同氮源种类(a)及玉米浆干粉添加量(b)对植物乳杆菌ZJ316生长的影响Fig.2 Effect of different nitrogen source types(a)and corn syrup powder additions(b)on the growth of Lactobacillus plantarum ZJ316
由图2a可知,当酵母粉作为氮源时,植物乳杆菌ZJ316的OD600nm值最高为2.55,其次是玉米浆干粉。NORO N等[22]研究表明,玉米浆干粉可在发酵过程中维持培养基的pH值在4.6~4.8之间,减小发酵时所产乳酸对发酵体系pH值的影响,减缓培养基pH值降低对菌体生长的抑制,为植物乳杆菌提供更好的生存环境,从而更有助于菌体的生长[23]。由于玉米浆干粉与酵母粉的结果不存在显著性差异(P>0.05),考虑到经济因素,后续将选择玉米浆干粉作为最适氮源。
由图2b可知,随着玉米浆干粉添加量的增加,植物乳杆菌ZJ316的OD600nm值呈先升高后降低的趋势。当玉米浆干粉添加量为60 g/L时,植物乳杆菌ZJ316的OD600nm值最高为2.47,由于添加量20 g/L和60 g/L对结果的影响没有显著性差异(P>0.05),考虑到经济因素,确定玉米浆干粉的最适添加量为20 g/L。
2.1.3 缓冲盐的选择
由图3可知,在Na2HPO4-柠檬酸缓冲盐体系中,植物乳杆菌ZJ316的菌体密度明显高于其余两组缓冲盐,当其浓度为0.1 mol/L时,菌体密度最高,OD600nm能达到3.58。这可能与柠檬酸有很强的氧化能力有关,它属于有机酸,有机酸在发酵过程中被利用,会使发酵体系的pH值上升,尤其是有机酸盐氧化会伴随着碱性物质的产生,使pH值进一步上升,从而缓解了发酵过程中乳酸的产生对发酵液体系pH值的影响,更有利于菌体的生长[24]。因此,后续将选择Na2HPO4-柠檬酸缓冲盐作为最适缓冲盐体系。
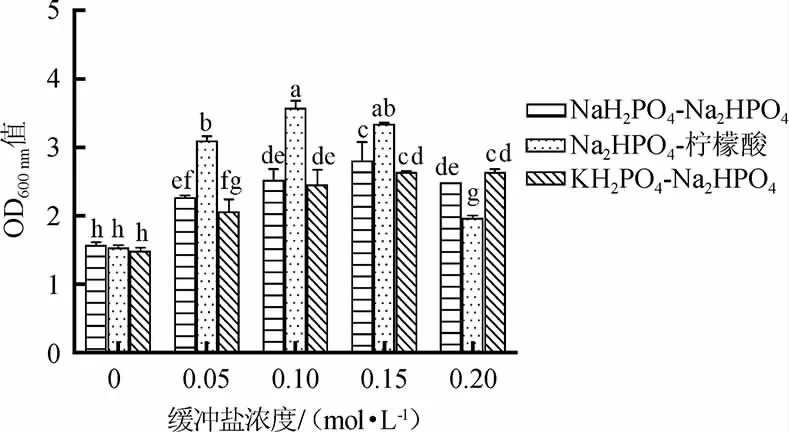
图3 不同缓冲盐体系及浓度对植物乳杆菌ZJ316生长的影响Fig.3 Effect of different buffer salt systems and concentrations on the growth of Lactobacillus plantarum ZJ316
2.1.4 微量元素添加量的选择
由图4a可知,随着硫酸镁添加量的升高,植物乳杆菌ZJ316的菌体密度呈先升高后下降的趋势。当硫酸镁添加量为0.2 g/L时,植物乳杆菌ZJ316的菌体密度最高,为3.59。因此,确定硫酸镁的最适添加量为0.2 g/L。
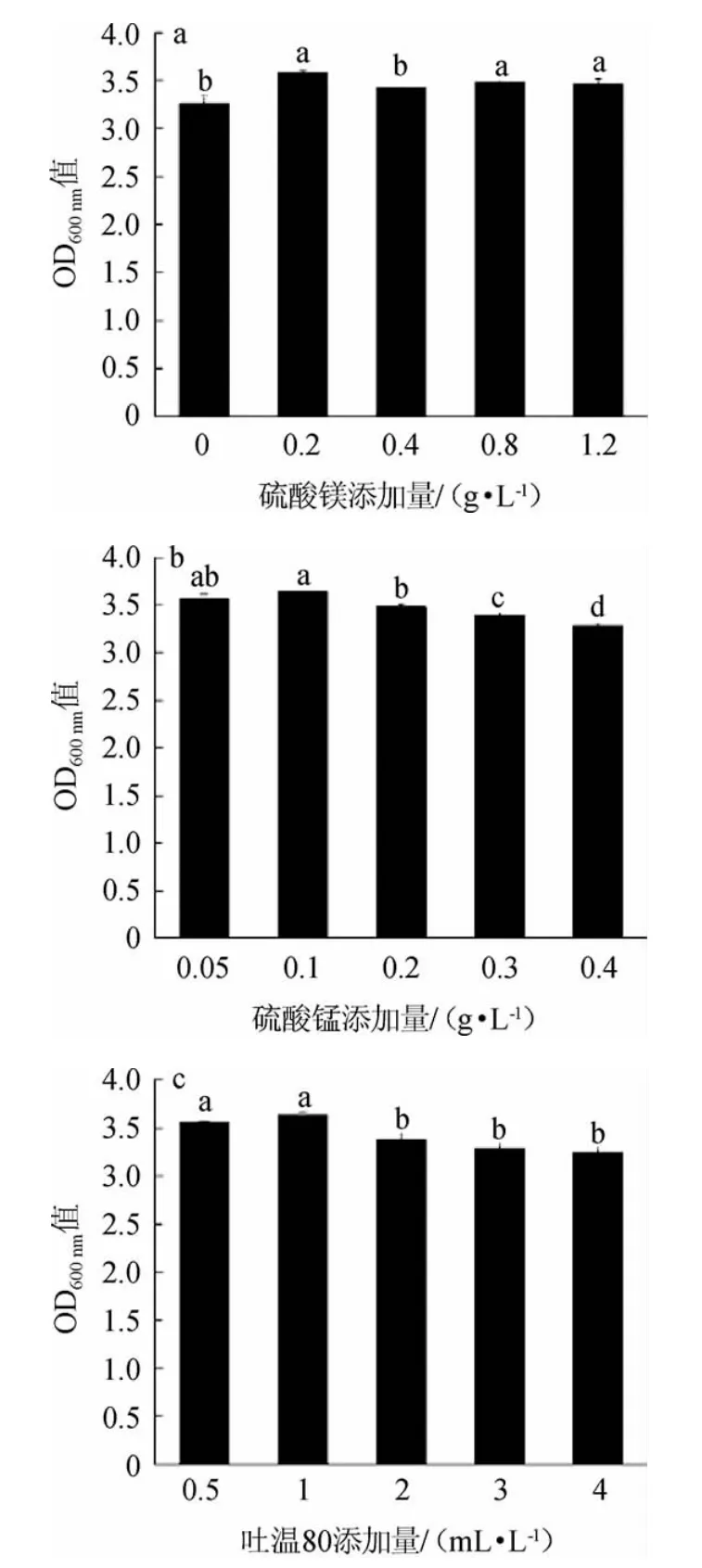
图4 不同MgSO4(a)、MnSO4(b)及吐温80(c)添加量对植物乳杆菌ZJ316生长的影响Fig.4 Effect of different MgSO4(a),MnSO4(b) and Tween 80 (c)additions on the growth of Lactobacillus plantarum ZJ316
由图4b可知,当培养基中硫酸锰的添加量为0.1 g/L时,植物乳杆菌ZJ316的菌体密度最高,为3.61。当硫酸锰添加量>0.1 g/L之后,菌密度有略微下降。可能是因为培养基中过高的金属离子锰,抑制了植物乳杆菌ZJ316的生长,从而导致菌体密度下降。因此,确定硫酸锰的最适添加量为0.1 g/L。
由图4c可知,当吐温80添加量为1 mL/L时,植物乳杆菌ZJ316的菌密度最高,为3.64。当吐温80添加量>1mL/L之后,菌体密度下降。因此,确定吐温80的最适添加量为1 mL/L。
2.1.5 响应面优化试验结果
利用Design Expert 12.0软件对影响植物乳杆菌ZJ316生长的3个主要因素进行3因素3水平的Box-Behnken试验,试验设计及结果见表2,方差分析结果见表3。
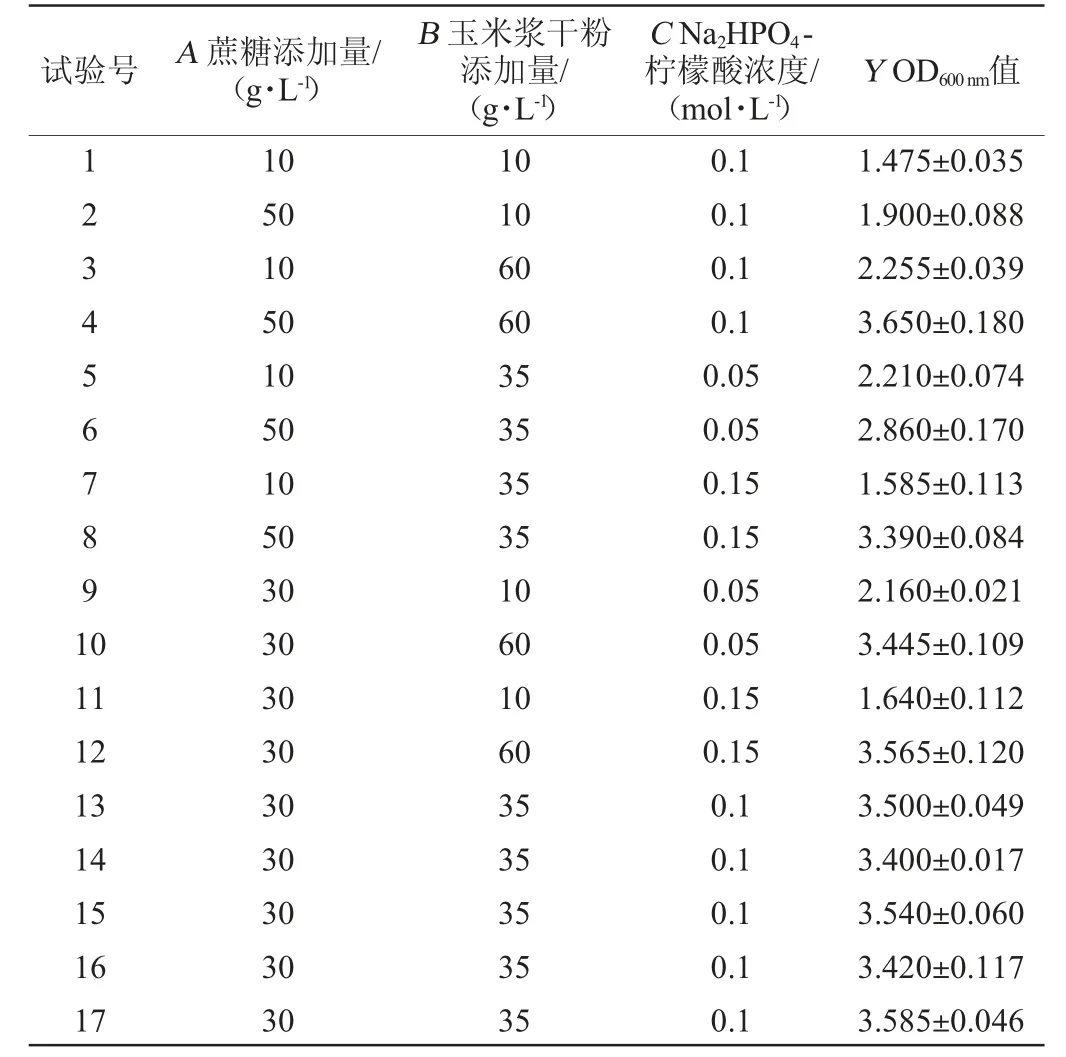
表2 Box-Behnken试验设计及结果Table 2 Design and results of Box-Behnken tests
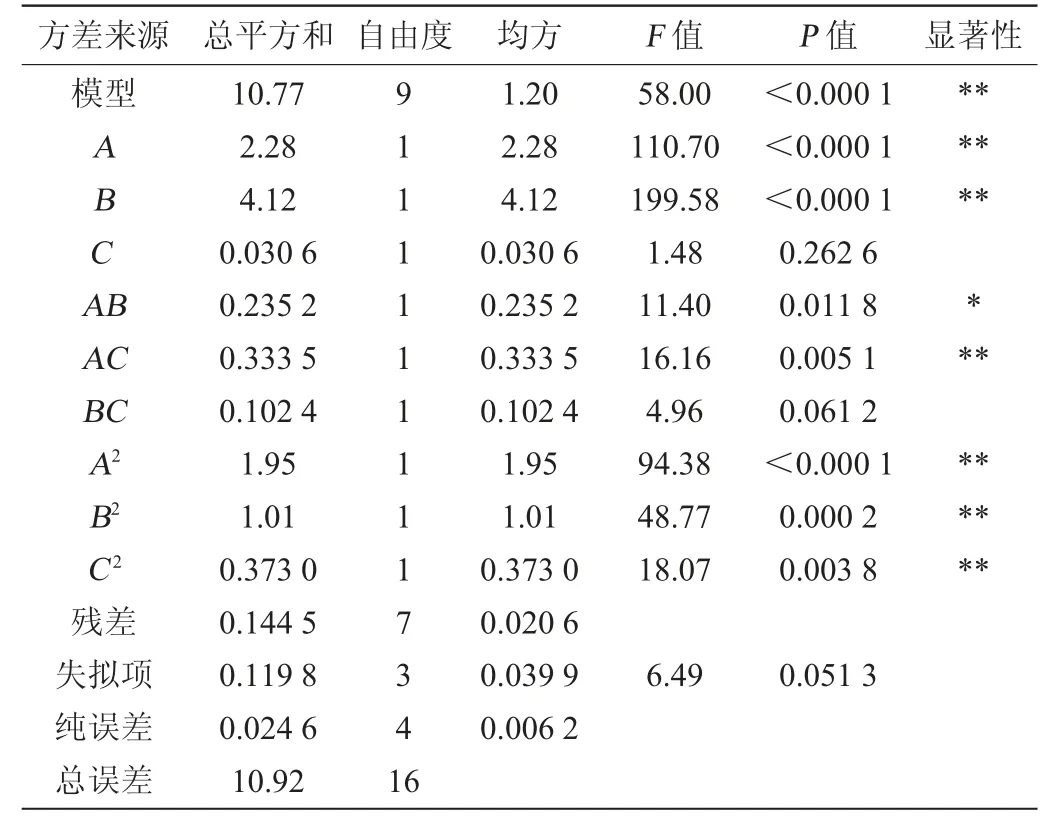
表3 回归模型方差分析Table 3 Variance analysis of regression model
通过Design Expert 12.0软件对表2的试验数据进行多元回归拟合,得到响应值OD600nm值(Y)与蔗糖添加量(A)、玉米浆干粉添加量(B)、Na2HPO4/柠檬酸缓冲盐浓度(C)的关系的多元二次回归方程:
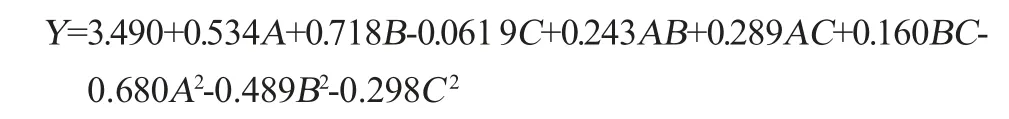
由表3可知,模型的P值<0.000 1,极显著;失拟项的P值=0.051 3>0.05,不显著;并且模型的决定系数R2=0.986 8,调整决定系数R2adj=0.969 8,说明该模型可以很好的拟合实际情况,具有较高的可靠性。由表3亦可知,一次项A、B、交互项AC及二次项A2、B2、C2对结果影响极显著(P<0.01),交互项AB对结果影响显著(P<0.05),其他项对结果影响不显著(P>0.05)。
蔗糖、玉米浆干粉、Na2HPO4-柠檬酸三者的交互作用形成的响应曲面和等高线图见图5。由图5可知,AB、AC的等高线图呈椭圆形,说明AB、AC交互作用明显,该结果与方差分析结果一致。

图5 蔗糖、玉米浆干粉、Na2HPO4-柠檬酸交互作用对植物乳杆菌ZJ316生长影响的响应面及等高线图Fig.5 Response surface plots and contour lines of effects of interaction between sucrose,dried corn steep liquor powder and Na2HPO4-citric acid on the growth of Lactobacillus plantarum ZJ316
2.1.6 响应面试验结果的验证
根据模型可以得出,当蔗糖添加量为43.41 g/L,玉米浆干粉添加量为59.46 g/L,Na2HPO4-柠檬酸缓冲盐浓度为0.12 mol/L时,植物乳杆菌ZJ316的OD600nm值最大理论预测值为4.004,在此条件下做验证试验,重复3次试验,得到植物乳杆菌ZJ316的OD600nm值为4.065±0.020,与预测值相近,说明模型可靠,因此,该模型可用于预测植物乳杆菌ZJ316培养基菌体密度的变化。
2.2 植物乳杆菌ZJ316高密度发酵培养条件的优化
由图6a可知,随着接种量的增大,植物乳杆菌ZJ316的OD600nm值呈先升高后下降的趋势。当接种量为4%时,植物乳杆菌ZJ316的OD600nm值可达4.31;当接种量>4%之后,OD600nm值下降,可能是因为初始接种量太大,导致菌体大量生长,而培养基中的营养物质不能满足大量菌体同时生长,致使菌体密度发生下降。因此,确定最适接种量为4%,该结果与陈百莹等[25]的研究结果一致。
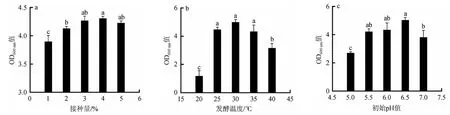
图6 接种量(a)、发酵温度(b)及初始pH值(c)对植物乳杆菌ZJ316生长的影响Fig.6 Effect of inoculum (a),fermentation temperature (b) and initial pH value (c) on the growth of Lactobacillus plantarum ZJ316
由图6B可知,随着发酵温度的升高,植物乳杆菌ZJ316的OD600nm值呈先升高后下降的趋势。当发酵温度为30 ℃时,植物乳杆菌ZJ316的菌体密度最高达5.00,随着培养温度的升高,OD600nm值急剧下降,可能是因为高温会使植物乳杆菌ZJ316的胞内酶失活,从而影响菌体生长。因此,确定最适发酵温度为30 ℃。
由图6c可知,当初始pH值在5.0~6.5的范围内时,随着pH值的升高,植物乳杆菌ZJ316的菌体密度不断提高;当初始pH值为6.5时,菌体密度到达峰值为5.17;当初始pH值增加到7.0时,菌体密度明显下降,可能是过碱的环境不利于菌体的生长。因此,确定最佳初始pH值为6.5。
2.3 植物乳杆菌ZJ316的生长曲线
为了探索植物乳杆菌的工业化生产工艺路线,选择了5 L发酵罐的小试发酵体系进行放大实验。在优化培养基以及培养条件的基础上,对植物乳杆菌ZJ316进行高密度发酵,同时以MRS培养基作为对照,测得的生长曲线见图7。
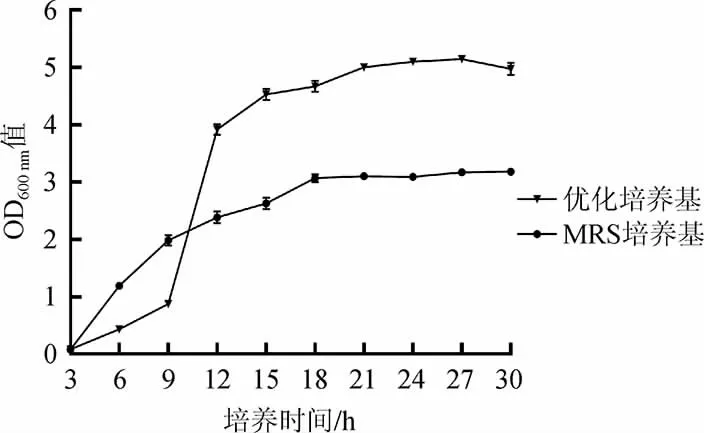
图7 植物乳杆菌ZJ316的生长曲线Fig.7 Growth curve of Lactobacillus plantarum ZJ316
由图7可知,植物乳杆菌ZJ316在优化培养基中的菌体密度远远高于MRS液体培养基。在优化培养基中,培养24 h后进入稳定期,OD600nm值达到5.13,对数生长期延长,更加有利于菌体的生长和产物的积累。
3 结论
在MRS液体培养基的基础上,通过单因素及响应面试验优化得到植物乳杆菌ZJ316高密度培养的最优培养基组分为蔗糖43.41 g/L、玉米浆干粉59.46 g/L、Na2HPO4-柠檬酸0.12 mol/L、MgSO4·7 H2O 0.20 g/L、MnSO4·H2O 0.10 g/L、吐温80 1 ml/L;最优培养条件为接种量4%、培养温度30 ℃、初始pH值6.5。在此优化条件下,经发酵罐培养24 h,植物乳杆菌ZJ316的OD600nm值达到5.13,活菌数最高可达8.01×109CFU/mL,相比于MRS液体培养基分别提高1.65、3.44倍。优化后的培养基采用蔗糖作为主要碳源,并且采用廉价的玉米浆干粉作为氮源,减少了经济成本,简化了培养基的制备步骤。
