头颅CTA血管分析软件(VA)在颅内小及微小动脉中的应用价值
2021-06-04胡荣胜孙剑波詹青霞
沈 君 胡荣胜 孙剑波 武 刚 詹青霞
近年来,自发性蛛网膜下腔出血(spontaneous subarachnoid hemorrhage)患者有增加趋势,脑动脉瘤破裂是引起自发性蛛网膜下腔出血最常见和最主要的原因,死亡率高达25%~60%[1],存活者约50%因致残而生活不能自理[1]。脑动脉瘤通常发生于Willis环,以前交通动脉瘤最多,约占44.23%[2];其次为颈内动脉(internal carotid artery,ICA)、后交通动脉、大脑中动脉(middle cerebral artery,MCA)及大脑前动脉(anterior cerebral artery,ACA);大脑后动脉(posterior cerebral artery,PCA)、基底动脉(basilar artery,BA)发病率较低。因此,尽早发现和准确诊断对于动脉瘤破裂引起的蛛网膜下腔出血患者的治疗而言,是挽救其生命、提高其生活质量的关键。
数字减影血管造影 (digital subtraction ngiography,DSA)在以往被视为诊断动脉瘤的“金标准”[3],近年来,随着医学影像技术的发展,头颅CT血管成像(computed tomography angiography,CTA)因其无创、快捷、费用相对低廉及图像后处理功能强大等优点而逐渐成为临床颅内血管病变诊断的首选[4]。然而,由于颅骨的遮挡及颅内血管走行扭曲,颅骨附近的动脉瘤CTA常规三维重建容易漏诊[5]。CTA血管分析软件(vessel analysis software,VA)是随着多层螺旋CT心脏冠状动脉CTA血管分析的需求而发展出的一种血管分析手段[6],能将迂曲的血管展开在同一个平面上,并以血管腔中央为中心360°旋转血管腔及血管壁而构成2D图像,对显示血管壁斑块大小、性质及血管腔狭窄或测量扩张程度等效果良好[7]。本文拟将VA应用于颅内小及微小脑动脉瘤的诊断,结合常规三维重建技术以更清楚地显示动脉瘤位置、形态、数目、动脉瘤体、瘤颈及载瘤动脉的关系及动脉瘤颈的宽窄等细微结构的情况,为临床治疗过程中支架或者球囊等辅助手段的使用与否及其栓塞治疗效果的评估提供参考,探讨其对颅内小及微小动脉瘤诊断的临床意义。
方 法
1. 临床资料
收集2018年1月—2019年1月因蛛网膜下腔出血在我院接受DSA检查和治疗并明确诊断为小动脉瘤(直径均小于5 mm)破裂出血患者的临床资料,对其常规头颅CTA图像进行回顾性分析。共纳入37例患者,其中男20例,女17例,年龄20~86岁,平均(55.3±16.3)岁。DSA共发现并确诊44个小动脉瘤(3例多发,1例DSA术后),其中直径1~3 mm微小动脉瘤23例,3~5 mm小动脉瘤21例;11例位于大脑前动脉,11例位于大脑中动脉,4例位于大脑后动脉,8例位于Willis环,8例位于颈内动脉颅内段,1例位于基底动脉。小动脉瘤分布情况详见表1。
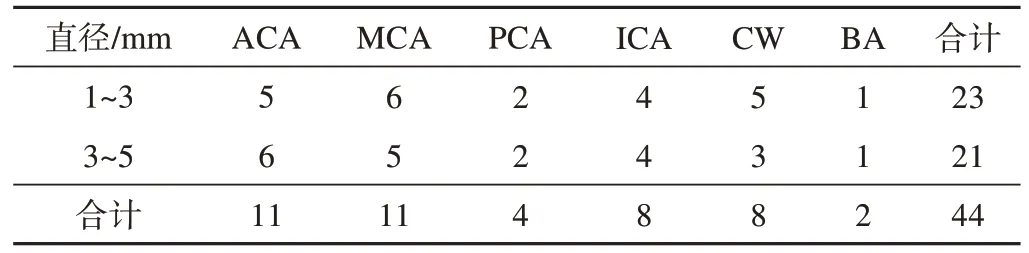
表1 小及微小血管瘤分布情况(DSA检查结果)
2.DSA检查方法
应用美国GE数字平板C型臂Innova 3100-IQ心血管成像系统,局麻下对股动脉进行穿刺、插管,予以常规正侧位椎动脉和颈内动脉2D-DSA,注射370 mgI/ml非离子型对比剂碘帕醇,椎动脉注射总量为7 ml,速率为4 ml/s,颈总动脉注射总量为8 ml,速率为l5 ml/s。
3.CTA检查方法
使用GE Lightspeed 64层螺旋CT扫描仪,连续容积扫描。主要扫描参数:探测器宽度20 mm,管电压120 kV,管电流250 mA,螺距0.5,层厚0.625 mm,球管环周时间0.4 s/r,矩阵512×512;增强扫描使用Ulrich Medical(XD2001)高压注射器,BDIntimaⅡ20G-22G密闭式静脉留置针,经前臂静脉团注碘普罗胺(优维显,370 mgI/ml,60 ml,4~5 ml/s),以主动脉弓为监测层面,并根据经验法设置扫描延迟时间(10~16 s)及启动阈值(120 HU);扫描范围从Cl椎体至颅顶,获取常规CTA原始图像,所有检查数据进行重建处理。
4. 图像处理及诊断
所有CTA原始图像传至ADW4.5工作站,使用volume模式对图像进行后处理,对照组采用包括容积再现(volume rendering,VR)、最大密度投影(maximum intensity projection,MIP)及多平面重建(multiplanar reconstruction,MPR)等常规后处理,试验组采用常规后处理技术+VA,采用盲法,每组分别由2名高年资的影像科医生进行独立图像后处理及阅片,并记录(包括定位、定性诊断和病变大小测量)。
5. 统计学分析
所有数据以DSA结果为“金标准”,确定诊断性试验结果(阳性、阴性)。采用SPSS20.0软件进行统计分析。用百分比表示计数资料(采用χ2检验),P<0.05为组间比较差异有统计学意义。
结 果
1.头颅CTA图像经不同后处理的影像特点
CTA常规后处理VR能根据表面成像显示流体形态,MIP显示壁内钙化情况,VA将扭曲血管以2D形式展开,并可根据需求360°充分显示壁内结构及邻近结构关系(图1)。

图1 蛛网膜下腔出血病例(男,38岁)头颅CTA经不同后处理及DSA影像
2.常规后处理与常规后处理+VA诊断的结果比较
对照组采用VR、MIP及MPR等常规后处理技术,试验组采用常规后处理技术+VA,其诊断结果如表2所示。
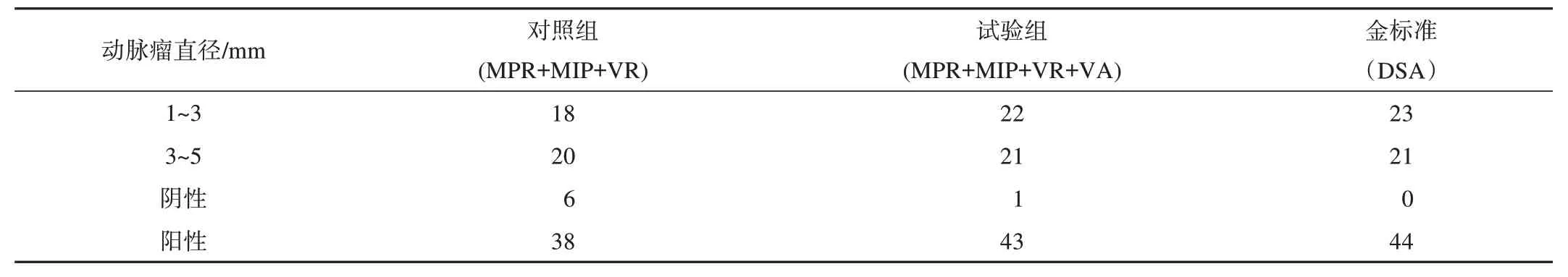
表2 不同后处理技术诊断结果
44个小及微小动脉瘤(直径5 mm以下瘤体),对照组经CTA常规后处理技术诊断出38个,其检出率为86.36%,特异度为100%,与DSA诊断结果比较,差异有统计学意义(P<0.05,表3);试验组经CTA常规后处理+VA技术诊断出43个,其检出率为97.73%,特异度为100%,与DSA诊断结果比较,差异无统计意义(P>0.05,表3)。对照组与试验组诊断结果比较,差异有统计学意义(P<0.05,表3)。
讨 论
颅内动脉瘤是指脑动脉壁的异常膨出部分,动脉瘤大部分为先天性动脉瘤,高发年龄为30~60岁[8],其中约有80%的颅内动脉瘤发生于颅底动脉环前半部。一般直径<5 mm者为小动脉瘤,而<3 mm者为微小动脉瘤。颅内动动脉瘤破裂是引起自发性蛛网膜下腔出血的首要因素之一[9],且起病急,可出现脑膜刺激征、精神失常、意识障碍、剧烈头痛和恶心呕吐。迅速诊断对于动脉瘤的早期治疗、风险预测评估及挽救患者生命安全至关重要。目前,CTA已成为颅内动脉瘤破裂的首选检查方式,其具有无创、经济快捷、诊断准确等优越性,对于大血管瘤诊断的准确度、灵敏度及特异度都很高。其对于直径5 mm以下的小血管瘤的灵敏度略逊,颅内血管的极度扭曲、破裂出血的血管痉挛等均使得小血管瘤的诊断假阳性率、假阴性率较高[10]。本研究发现,常规后处理VR对显示血管外表面形态较敏感,但是假阳性率也较高,特别是遇到扭曲的血管,容易误认为是凸起的血管壁。MIP对血管壁钙化情况显示较好,三维MPR有助于其鉴别,显示腔内情况及周围空间结构,但是对于扭曲血管显示有局限性。本组研究中,对照组阳性检出率为86.36%,其中直径小于3 mm的微小血管瘤漏诊约21.74%,直径3~5 mm的小血管瘤漏诊约4.76%。漏诊的原因主要是瘤体太小,且与动脉瘤位于血管扭曲、分叉处等特殊部位有关。VA起初用于螺旋CT心脏冠状动脉CTA血管分析,其操作与曲面重建相似,但功能更为强大,主要表现在血管分析性能方面,VA即能智能跟踪选定节段的血管,将其展开在同一个平面上,并可以血管腔中央为中心360°旋转显示血管腔及血管壁的2D图像。近年来,有学者将VA应用于体部血管分析,如颅内动脉、颈动脉和椎动脉硬化斑块及狭窄程度的分析等,并取得良好的效果[11],VA能剔除邻近血管、骨质的干扰,分析其血管腔、血管壁的细微结构,更清楚地显示动脉瘤体大小、瘤颈宽窄、与载瘤动脉的关系以及了解支架术后等腔内细微结构,特别是对于细小迂曲脑动脉,其诊断及鉴别诊断效果明显优于其他常规后处理技术。本组研究中,试验组直径3~5 mm的小血管瘤检出率100%,与金标准媲美,直径小于3 mm的微小血管瘤检出率也明显较对照组提高,约95.65%,试验组与对照组检出率差异有统计学意义(P=0.0489<0.05)。VA将迂曲的血管展开在同一个平面上作分析,一个重大的缺点就是图像变形,并不能反映其真实的形态,因此也会出现假阳性和假阴性的情况[10]。但图像变形并不能否定VA的临床价值,VA结合常规后处理技术在发现血管壁和血管病灶方面有绝对的优势,明显提高CTA的诊断和鉴别诊断能力。在血管CTA分析方面,我们的经验是先用VR和MIP显示血管的形态结构和有无钙化,再根据三维MPR和VA技术对局部细节进一步展示鉴别,在血管后处理及诊断过程中,对于血管扭曲、分叉、闭塞及血管壁有软硬斑块处,要综合运用多种技术,这有助于提高血管CTA的诊断准确度和效率,使其可与DSA媲美,甚至诊断方面优于DSA。
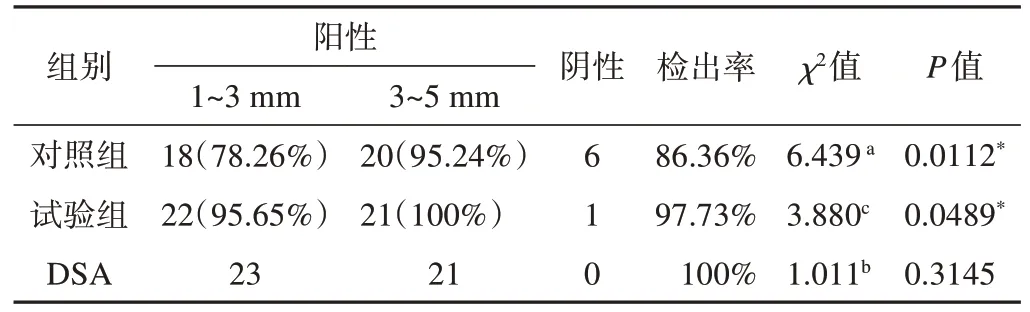
表3 对照组、试验组与金标准DSA检出率比较
