年龄和OCT特征与抗VEGF治疗视网膜中央静脉阻塞性黄斑水肿效果的相关性
2021-06-04邓玉梦宋艳萍黄晓莉
邓玉梦,宋艳萍,黄 珍,叶 娅,闫 明,黄晓莉
0引言
视网膜中央静脉阻塞(CRVO)是常见的导致视力丧失的视网膜血管性疾病之一,发病率约为0.08%[1]。发病年龄一般超过40岁,多在60岁以上[2],10%~15%的CRVO患者发病年龄<40岁[3-4]。其发病原因复杂,老年CRVO患者常与系统性血管疾病(如高血压、糖尿病、高脂血症)有关,年轻患者多存在非传统性危险因素[5]。老年患者与中青年患者虽然在病因、临床特点和治疗预后方面有所不同,但目前在治疗方面均将抗血管内皮生长因子(VEGF)治疗作为一线疗法[2]。
光学相干断层扫描(OCT)是视网膜静脉阻塞(RVO)诊疗中最常用的眼底成像方式,其相关指标可以评估疾病的严重程度及治疗预后[2]。其中,强反射点(HRD)近年来被多数学者认为是炎性环境下激活的小胶质细胞,其数量和位置与RVO患者基线视力及抗VEGF治疗效果相关[6-7]。中青年CRVO患者发病多认为由炎症因素参与导致[8]。对此已有一些临床研究报告,但对年龄和其他因素或检测指标的相关性分析尚不够深入,尤其是OCT影像上的HRD数量等指标在中青年与老年患者中是否存在差异尚未见报道。本研究将OCT影像中的HRD作为观察指标之一,分析两个年龄段CRVO患者抗VEGF的治疗效果及其与OCT影像特征的相关性。
1对象和方法
1.1对象采取回顾性病例对照研究方法。收集2017-07/2019-07在中国人民解放军中部战区总医院确诊的CRVO患者47例47眼,均为单眼患病。按发病年龄分组,老年组(年龄>50岁)患者27例,年龄51~79岁,中青年组(年龄≤50岁)患者20例,年龄19~50岁。纳入标准:(1)初次发病,经裂隙灯显微镜、荧光素眼底血管造影(FFA)、OCT检查确诊为CRVO,病程≤3mo;(2)未行玻璃体腔注射抗VEGF药物或视网膜激光光凝治疗;(3)中央视网膜厚度(CRT)>250μm;(4)视力(LogMAR)≤1.6;(5)无其他原因引起的黄斑水肿;(6)随访时间≥12mo。排除标准:(1)合并年龄相关性黄斑变性、糖尿病视网膜病变、葡萄膜炎、屈光间质严重混浊者;(2)既往有玻璃体视网膜手术病史;(3)随访资料不全者。本研究遵循《赫尔辛基宣言》原则,并已通过伦理审查。所有患者均对治疗方案知情同意。
1.2方法
1.2.1病史采集及眼部常规检查收集患者的基本信息,包括性别、年龄、病程、伴随疾病(高血压、糖尿病、高脂血症、青光眼)、患眼眼别、就诊时视力(采用国际标准视力表检查,结果换算为LogMAR视力进行统计分析)、眼压等。
1.2.2 OCT检查所有患者治疗前后均接受黄斑区OCT(Topcon 3D OCT-2000)检查,扫描模式512×128,扫描范围6mm×6mm。以黄斑中心凹为中心进行30°环扫,共12幅,扫描方向由鼻侧向颞侧进行。使用设备的眼球跟踪系统,确保扫描过程始终保持正确的位置。观察指标包括平均视网膜厚度(ART)、CRT、外界膜(ELM)和椭圆体带(EZ)破坏程度、HRD数量。(1)ART:以黄斑中心凹为中心,直径6mm范围视网膜厚度的平均值。(2)CRT:黄斑中心凹1mm范围内的视网膜厚度。(3)HRD:孤立的、边界清晰、信号强度等于或高于视网膜色素上皮(RPE)层的小颗粒。计数时排除直径大于40μm或在OCT上出现的其他高反射信号遮蔽(如出血点)及与眼底彩照有对应的高反射点(如脂质渗出)。当出血遮蔽视网膜各层次信号的面积超过扫描面积的1/2时,排除此病例;若遮蔽面积小于1/2时,方法同前继续计数HRD。每位患者选择HRD数量最多的B扫描层面计数,随访OCT时使用相同的扫描层面[9]。每个B扫描的HRD数量均由两名有经验的眼科医生计数,当结果有异议时,由第三位医生(主任医师)计数评定。(4)ELM及EZ完整性:在选取的B扫描层面评估ELM及EZ完整性,评估方法参考文献[10],将黄斑中心凹1mm范围内的ELM高反射条带根据连续性分为3个等级,完全连续为完整ELM(+),连续性中断为ELM(±),完全不可见为ELM(-)。EZ评估方法与ELM一致。
1.2.3玻璃体腔抗VEGF药物注射术前均行眼部相关检查,排除手术禁忌证。术前1h予以复方托吡卡胺滴眼液滴眼3次,玻璃体腔注射均在无菌层流手术室按常规操作进行。以1mL注射器抽取10mg/mL的抗VEGF药物0.05mL(康柏西普/雷珠单抗0.5mg),于颞下或鼻下方距角巩膜缘3.5~4.0mm处垂直于巩膜面穿刺注射。注射完毕后,给予妥布霉素地塞米松眼膏涂眼后覆盖。注射前及注射后30min监测患眼眼压。
1.2.4随访观察指标两组患者均连续3mo每月进行玻璃体腔注射抗VEGF药物1次,之后每月随访,按需给药,必要时行眼底激光治疗。再次注药标准为CRT>300μm、出现新的或持续的视网膜囊样水肿、视力下降>0.2LogMAR[11]。随访时间≥12mo,随访时进行视力、眼压、裂隙灯显微镜、OCT检查,检查设备均与治疗前测定时采用的设备相同。对比分析基线、抗VEGF治疗第3、6、12mo就诊数据,记录第12mo随访时玻璃体腔注射抗VEGF药物次数及ELM与EZ转归情况,ELM与EZ转归定义为其完整性好转至上一等级。末次随访时的视力与基线视力相比,视力提高≥1行为视力提高,视力下降≥1行为视力下降,视力变化<1行则认为视力稳定。
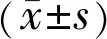
2结果
2.1两组患者基线资料比较两组患者基线资料比较,老年组患者年龄和女性患病率均高于中青年组(P<0.05),中青年组基线BCVA优于老年组(P<0.05),但两组患者患眼眼别、病程、眼压及高血压、糖尿病、高脂血症、青光眼患病率均无差异(P>0.05),见表1。

表1 两组患者基线资料比较
2.2两组患者治疗前后OCT观察指标比较两组患者治疗前后OCT各观察指标比较,基线ART、CRT均无差异(t=1.93、0.27,P=0.06、0.789),但老年组患者基线HRD低于中青年组(t=-2.295,P=0.026)。治疗后,两组患者ART、CRT均较治疗前明显下降,中青年组患者ART、CRT在治疗后第6mo有小幅度升高,但两组患者ART、CRT变化无差异且变化幅度不受时间影响,见表2、3,图1A、1B。治疗后,两组患者HRD数量均较治疗前明显下降,中青年组患者HRD数量在治疗后第6mo时有小幅度升高,两组患者HRD数量下降幅度受时间影响且中青年组下降幅度较老年组大,见表4,图1C。

图1 两组患者治疗前后OCT观察指标和BCVA趋势图 A:ART;B:CRT;C:HRD数量;D:BCVA。
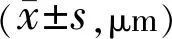
表2 两组患者治疗前后ART比较
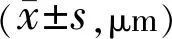
表3 两组患者治疗前后CRT比较

表4 两组患者治疗前后HRD数量比较 个)
2.3治疗前后两组患者BCVA比较两组患者治疗前后BCVA比较,中青年组患者基线BCVA优于老年组(t=2.589,P=0.013)。治疗后,两组患者BCVA均较治疗前改善,见表5,图1D。
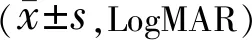
表5 两组患者治疗前后BCVA比较
2.4两组患者玻璃体腔注药次数及疗效比较治疗后第12mo随访时,老年组患者行玻璃体腔注射抗VEGF药物的次数高于中青年组(8.4±2.1次vs7.3±1.7次,t=2.039,P=0.047);老年组患者ELM、EZ转归率分别为48%(13/27)、56%(15/27),中青年组患者ELM、EZ转归率分别为30%(6/20)、30%(6/20),两组患者ELM、EZ转归率均无差异(χ2=1.571、3.036,P=0.210、0.081),见图2。两组患者BCVA提高33眼,其中老年组22眼,中青年组11眼;下降7眼,其中老年组4眼,中青年组3眼;稳定7眼,其中老年组1眼,中青年组6眼。

图2 抗VEGF治疗后OCT检查情况 患者,男,53岁,病程3mo,抗VEGF治疗第6mo复诊,视力0.4LogMAR、CRT 847μm、ART 437μm、HRD 46个、ELM(±)、EZ(±);第12mo复诊,视力0.5LogMAR、CRT 371μm、ART 348μm、HRD 29个、ELM(±)、EZ(±),抗VEGF治疗10次。A:抗VEGF治疗第6mo眼底彩照;B:抗VEGF治疗第6mo视网膜B扫描图;C:抗VEGF治疗第12mo视网膜B扫描图。黄箭头所示为硬性渗出物;红箭头所示为HRD。
2.5两组患者视力预后的相关因素分析相关性分析结果显示,治疗后第12mo随访时,老年组患者BCVA与发病年龄、HRD、ELM及EZ均具有相关性(r=0.361、-0.438、0.643、0.592,P=0.017、0.025、0.001、0.003);中青年组患者BCVA与发病年龄、ART、HRD、ELM及EZ均具有相关性(r=0.548、0.467、0.483、0.699、0.737,P=0.012、0.038、0.031、0.002、0.001),见表6。

表6 相关性分析结果
3讨论
RVO最重要的危险因素是高龄和全身血管性疾病,年龄是视力预后的独立危险因素[12]。年龄增加与动脉粥样硬化引起的动脉疾病有关,降低了CRVO患者获得良好视力的可能性[13]。本研究中,无论是老年组还是中青年组CRVO患者,年龄越大视力预后越差,进一步验证了年龄对于疾病预后的影响。此外,性别是RVO发生发展的另一个危险因素,Nalcaci等[14]认为RVO与其他血管性疾病一样,男性患者更容易受到影响,Anand等[15]研究发现男性首次出现动脉硬化性疾病的年龄比女性小10岁。分析是由于血管功能存在激素依赖性的性别差异,雌激素通过快速增加一氧化氮的产生和诱导血管舒张起到保护血管的作用[16]。本研究发现,中青年组男性患病率更高,分析是由于中青年女性未绝经,雌激素水平较高,保护了视网膜血管内皮和张力,从而降低了CRVO发病率。
本研究中,中青年组基线视力明显优于老年组,抗VEGF治疗次数少,与Rothman等[5]研究结果一致,该研究认为,年轻人抗VEGF治疗次数少,可能因为年轻人有更强的侧枝循环,对治疗有更好的反应。Eah等[17]和Sophie等[13]认为年轻患者临床病情较轻,良好的初始视力反映疾病严重程度轻,从而降低了光感受器或其他视网膜细胞不可逆损伤的可能性。彭红等[18]也发现青年患者治疗效果更好,原因是其早期未发生明显的炎性改变,通过及时治疗,视网膜功能得以较快恢复,但该研究并未进一步探究炎症因素在不同年龄组的差异。本研究分析视力预后的相关因素发现,中青年组患者ART越高视力越差。与ART指标相比,CRT为视网膜中心凹1mm范围内的视网膜厚度,与视功能关系更紧密。SCORE研究发现CRT与BCVA具有相关性[19],临床上也常将CRT用于评估疾病活动、进展以及治疗反应[2],但本研究并未发现BCVA与CRT的相关性,而与ELM、EZ的破坏程度具有相关性。Simader等[20]认为CRT和BCVA的相关性在较长的随访期间不太明显,特别是在视网膜结构受到不可逆损害之后。推测CRT只是影响视力的因素之一,不能代表视网膜的完整性,即使CRT降至正常,如果视网膜的完整性受到干扰,视力可能也很差。ELM作为视网膜内屏障,由Müller细胞和感光细胞外节段紧密连接。ELM破坏后引起脂质和蛋白质向外层视网膜渗出,导致视网膜肿胀[10],进而损伤光感受器到双极细胞的视觉信号传导、降低透射到光感受器的光强[21]。既往研究证明,ELM和EZ的完整性是视力的最佳预测因子[22],其基线情况及治疗后的完整程度均可以影响视力预后[23-25]。光感受器破坏后能否恢复尚未见报道,但是OCT上光感受器的高反射信号条带连续性好转。中心凹光感受器层的严重肿胀可导致光感受器细胞紊乱,使光感受条带无法识别[26],以及硬性渗出或出血在OCT上出现信号遮蔽均影响对ELM、EZ完整性的判断。随着病情稳定,视网膜水肿消退,OCT上光感受器完整性恢复,视力改善。本研究结果显示,不同年龄段CRVO患者,经抗VEGF治疗后光感受器在OCT上信号条带均有一定比例的好转,但并无统计学差异。
VEGF因子通过与其受体结合,促进炎症反应及破坏血-视网膜屏障,增加血管通透性[27],进而引起黄斑水肿。本研究中两组患者经抗VEGF治疗后,视力改善,ART、CRT降低。说明抗VEGF药物可有效改善视力,减少黄斑水肿,与王敏等[28]研究结论一致。本研究发现,老年组患者连续3mo病情稳定,中青年组在治疗后第6mo虽然视功能稳定,但是形态学结果变差,可能因为炎性细胞因子的表达随时间的推移而增加,导致炎症加重或出现耐药[27]。HRD被认为是炎性环境下激活的小胶质细胞,本研究中青年组患者数量较多,通过抗VEGF治疗可以有效减少,下降幅度大于老年组患者。Battaglia Parodi等[29]研究发现地塞米松植入剂可显著改善50岁以下CRVO患者视功能,进一步证实青年CRVO发病与炎性因素或相关炎性疾病因素有关[30]。本研究将CRVO患者按年龄分组,分析不同年龄组患者经抗VEGF治疗后的视力预后与HRD的相关性,结果显示,中青年组患者HRD数量越多,视力预后越差,与既往结果一致[7,31];相反老年组患者HRD数量越多,视力预后越好,主要考虑因为入组患者少,可能出现统计误差,但是老年组经治疗HRD变化幅度小,说明视网膜的炎性因素作用小。
本研究为非前瞻性研究设计,纳入的研究对象之间可能存在明显的个体差异。两组患者除发病年龄外,性别构成也有统计学差异,两组间基线资料并不完全匹配,性别差异可能在较大程度上影响基础疾病的比较结果,但是对基线视力及OCT指标的影响程度尚需进一步研究。RVO的缺血程度影响疾病的转归,本研究未针对入组患者进行缺血情况分析,可能会影响两组治疗效果的比较。虽然通过观察HRD数量变化间接分析炎性因素的方法简单、无创,但没有抽取患者玻璃体液进一步验证。尽管本研究具有上述不足之处,但研究结果证实抗VEGF药物治疗CRVO有效,中青年患者CRVO受炎性因素影响较大,其治疗预后比老年患者要好。
