“氯气制备与性质探究”实验的微型化、一体化创新设计
2021-06-04王秀艳王慧琳
□王秀艳 李 想 王慧琳
(吉林师范大学化学学院,吉林四平136000)
“氯气的制备及性质探究”实验,无论是教师演示实验还是学生实验,都存在着以下不妥之处:氯气有刺激性气味,对人体有毒害,不能在实验室大量制取;反应不易控制,用浓盐酸与二氧化锰制取氯气时加热的温度不宜超过90℃且要经常移动火焰;制取的氯气中通常含有氯化氢气体、水蒸气等杂质;操作烦琐、费时,性质探究实验要分步进行,但上课时间有限,不能保证学生及时完成实验。
为了解决实验中的系列问题,笔者对“氯气的制备和性质探究”实验进行了微型化、一体化设计,减少了重复制备氯气的过程,节约了时间,提高了课堂教学效率。微型实验能在一定程度上培养学生的创新思维,促进学生的个性化发展,保证教师能边操作边讲解,学生能边观看边操作边记忆。
一、实验原理
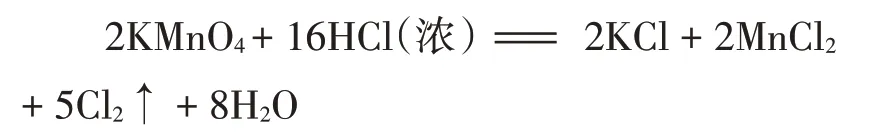
二、实验准备
(一)材料与药品
实验材料:小矿泉水瓶(容积大约150 mL)、玻璃管、注射器、橡皮泥、蓝色石蕊试纸、淀粉碘化钾试纸。
实验药品:KMnO4固体、浓HCl、淀粉KI溶液、FeCl2固体、NaOH溶液、KSCN溶液、稀HCl、NaCl溶液、Na2CO3溶液、AgNO3溶液、稀HNO3。
(二)课前准备
取4个容积150 mL的透明矿泉水瓶,分别标号1、2、3、4,用钉子在1号瓶瓶底以及2号瓶、3号瓶、4号瓶的瓶盖和瓶底分别扎一个玻璃管外径大小的孔。为了节约时间,此步骤由教师于课前完成。
(三)注意事项
(1)实验所用矿泉水瓶、注射器需干燥。(2)紧密连接装置,防止漏气;橡皮泥易风干,实验装置现用现安装。(3)待观察到2号瓶中出现黄绿色气体以及相应实验现象时推动3号瓶的注射器。(4)实验后将装置放在通风橱中,让其完全反应再进行拆卸,防止氯气泄漏到空气中。
三、实验步骤及现象分析
(一)实验步骤
1.连接装置
学生在1号瓶中装入高锰酸钾固体,在2号瓶中装入淀粉碘化钾溶液(瓶壁上方贴紧湿润的蓝色石蕊试纸),在3号瓶中装入氯化亚铁固体,在4号瓶中装入氢氧化钠溶液;将1号瓶的瓶盖拧紧,2号瓶、3号瓶、4号瓶用玻璃管按图1连接好装置,并在如图所示的4、5、6、7、8、9、10处用橡皮泥紧紧封死,以防止氯气泄漏。
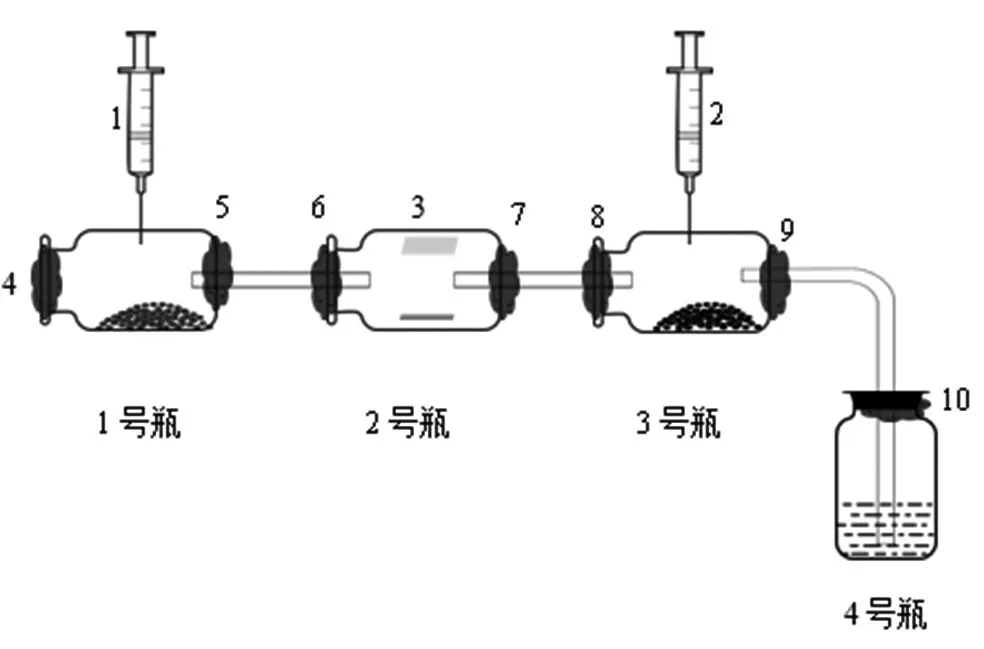
图1
2.加入药品,开始实验
连接好装置后用注射器吸入少量浓HCl,注入1号瓶中,固定好装置后将注射器中的浓盐酸缓慢推入1号矿泉水瓶中,逐步观察1号、2号两个瓶中的现象并记录,待2号瓶中观察到现象时立即推动3号瓶上的注射器,随后观察3号、4号瓶中的现象并记录。实验结束后将装置放置在通风橱中一段时间,再打开1号瓶的瓶盖,用湿润的淀粉碘化钾试纸检验,若试纸不变色,则不再产生氯气。4号瓶保留液体,拧紧瓶盖,留作“氯水使有色布条褪色”等实验用。最后在通风橱中拆卸、清洗装置。
(二)实验现象分析
(1)教师对实验现象进行讲解,让学生随堂记忆、当堂掌握,并深入了解实验原理(见表1),以提高学习效率。
(2)提问:为什么要观察到2号瓶中出现黄绿色气体以及实验现象时再推动3号瓶的注射器?(防止过早形成氯化亚铁溶液,氯化亚铁溶液在空气中极易被氧化为氯化铁溶液,当遇到硫氰化钾时溶液变为红色,影响实验效果)

表1
(3)观察、记录实验现象。学生对观察到的实验现象进行描述(如图2),教师加以讲解,培养学生观察实验现象、分析实验结果的能力。

图2
(三)Cl- 的检验实验
(1)取3支小试管,标号1、2、3,分别装入稀HCl、NaCl溶液、Na2CO3溶液,并按表2中的步骤进行Cl-的检验。

表2
第二步观察到3支试管中均有白色沉淀产生。
第三步观察到1号、2号试管中沉淀没有溶解,3号试管中沉淀溶解。
上述实验证明用银离子可验证Cl-的存在,同时验证了氯化银沉淀不溶于稀硝酸。
(2)提问:为什么检验氯离子要用稀硝酸酸化的硝酸银?(除去能与银离子形成沉淀的其他离子,避免干扰实验结果)
四、实验改进的创新点
(1)微型实验试剂量小,装置简易,适宜高中生独立操作,改进后的实验能培养学生的创新思维。
(2)实验装置连续一体化的设计,节约了药品,方便学生逐一观察实验现象、得出结论,有效避免了因反应过快无法观察现象的情况,既掌控了全局,又优化了局部装置。
(3)密闭系统避免氯气向空气中扩散,安全环保,有助于强化学生的绿色化学理念。
(4)尾气吸收的产物含有次氯酸钠,可回收重复利用,以便给学生做有色布条褪色、消毒等实验,并增加实验的趣味性,培养学生的发散性思维及综合运用能力。
(5)最后增加的氯离子检验实验,从实验操作角度帮助学生复习旧知,强化学生的实验体验。
(6)多步实验操作的整合,在学时有限、条件有限的情况下为学生创造了亲身实验的条件,充分发挥了微型实验的优势,提高了课堂教学的效率。
