腹膜后单中心型Castleman 病的CT 表现及其强化特征分析
2021-06-04孙侠张蔚赵石磊张小龙李晶英刘剑羽
孙侠 张蔚 赵石磊 张小龙 李晶英 刘剑羽
Castleman 病(Castleman’s diseases,CD)又称巨大淋巴结增生,是一种病因不明的慢性淋巴组织增生性疾病,1956 年由Castleman 等[1]首次报道。临床上将CD 分为单中心型(unicentric CD,UCD)和多中心型(multicentric CD,MCD)。UCD 发生于腹膜后间隙少见,多为个案报道[2-5],另外,腹膜后的局灶性占位病变种类繁多,70%~80%为恶性[6],因此充分认识UCD 的影像特征,分析UCD 与腹膜后其他局灶性病变的不同,对于本病的鉴别诊断以及临床决策至关重要。本文回顾性分析15 例腹膜后UCD 的CT 表现,旨在加深对其影像特征的认识,提高诊断水平。
1 资料与方法
1.1 一般资料 回顾性收集北京大学国际医院2015 年1 月—2019 年12 月经手术病理证实的15例腹膜后UCD 病人的临床及影像资料,其中男10 例,女 5 例,年龄 24~58 岁,中位年龄 29 岁。15 例病人均行 CT 检查,其中 3 例行 CT 平扫,12 例行 CT 平扫和增强扫描。15 例病灶均行手术切除,术后病理诊断分型包括透明血管型10 例,混合型5 例。
1.2 设备与方法 采用西门子Definition Flash 双源CT 扫描设备,先行腹盆部平扫,扫描前病人禁食4~6 h,病人取仰卧位,扫描范围自膈顶至耻骨联合水平。扫描参数:管电压120 kV,Dose4D 自动管电流调节,转速0.5 s/r,螺距0.6 mm,准直器宽度128×0.6 mm,视野 374 mm×374 mm,矩阵 512×512,扫描层厚0.6 mm,重建层厚1 mm,重建层间距1 mm。增强扫描采用高压双筒注射器经肘静脉注射碘海醇(含碘300 mg/mL,扬子江药业集团有限公司)80~100 mL,注射流率3.0 mL/s。采用CT 示踪软件,当腹主动脉阈值达120 HU 后自动触发动脉期扫描,在动脉期扫描完成后延迟30 s 进行静脉期扫描。
1.3 影像分析 由2 名分别具有5 年、30 年工作经验的影像诊断医师共同阅片,意见不一致时协商确定。首先观察并记录病灶的部位、大小、形态、边缘、有无钙化、强化特点、病灶周围有无异常血管及卫星灶;然后分别测量平扫、动脉期及静脉期同一部位病灶和肾皮质的CT 值。测量病灶时选取增强扫描时强化最显著部位并避开血管及钙化,ROI 面积为30~50 mm2。测量肾皮质时避开肾髓质及肾周脂肪,ROI 面积为10~20 mm2。每个扫描时相分别对病灶和肾皮质测量3 次,取其平均值,然后计算病灶与肾皮质相对强化率,即[(病灶CT 值-肾皮质CT值)/肾皮质 CT 值]×100%。
1.4 统计学方法 采用SPSS 25.0 软件进行数据分析。非正态分布的计量资料以中位数和四分位距[M(P25,P75)]表示,2 种病理类型 UCD 病灶与肾皮质相对强化率比较采用Mann-Whitney U 检验。P<0.05为差异有统计学意义。
2 结果
2.1 腹膜后UCD 的CT 征象 ①部位、形态及大小:10 例(66.7%)UCD 位于肾脏周围,2 例于胰腺上方,1 例于下腔静脉前方,2 例于盆部。9 例(60.0%)表现为肾形或肾形样轮廓,4 例为椭圆型,2 例为不规则形。病灶最大径1.4~13.9 cm,中位最大径6.2(4.8,7.1)cm。②边缘:11 例(73.3%)病灶边缘见模糊环状稍低密度影,厚度0.3~1.5 cm,4 例边缘光滑清晰。③钙化:7 例(46.7%)见钙化,表现为斑点状、分支状、斑片状及粗大钙化。④平扫密度:3 例病灶内见裂隙状、斑片状低密度区,CT 值14~32 HU。⑤强化特征:8 例强化不均匀;11 例动脉期明显强化,其中6 例静脉期强化略减低,5 例静脉期呈持续或进一步强化;1 例动脉期及静脉期仅表现为轻度强化;增强扫描7 例(58.3%)见裂隙状或斑片状低强化区,其中6 例呈轻度渐进性强化,1 例未见强化(图1)。⑥异常血管及卫星灶:11 例(91.7%)病灶内部或边缘见增粗的异常血管;8 例(66.7%)病灶周围见多发卫星灶,长径0.7~2.7 cm,其中7 例卫星灶的密度、强化方式及程度与主病灶一致(图2)。
2.2 病灶与肾皮质的相对强化率 12 例行增强扫描病例中,UCD 病灶平扫、动脉期及静脉期的CT 值分别为 39.3(37.2,43.9)、117.8(104.6,123.5)、106.0(98.8,121.8)HU;肾皮质的 CT 值分别为 30.7(28.8,32.0)、168.8(150.5,181.9)、143.5(136.8,165.3)HU。病灶与肾皮质CT 值差值动脉期为51.0 HU,静脉期为37.5 HU。病灶与肾皮质相对强化率动脉期为-0.31(-0.40,-0.21),静脉期为-0.28(-0.32,-0.20)。
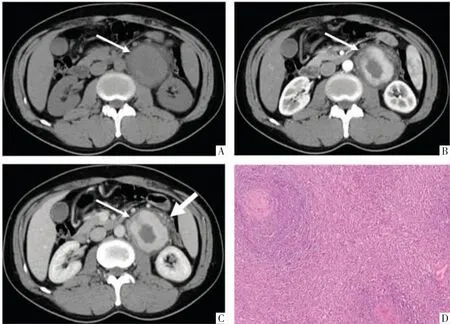
图1 混合型CD 病人,男,34 岁。A-C 图依次为横断面CT 平扫及动脉期、静脉期增强影像。左肾门区见一软组织肿块(A,细箭),密度不均匀,增强扫描动脉期明显强化(B,细箭),静脉期强化略减低(C,细箭),病灶中央未见强化,病灶边缘的环状低密度影轻度强化,内见增粗血管影(C,粗箭)。D 图,病理图,镜下可见滤泡周围淋巴细胞增生,多层环形排列呈洋葱皮样结构,滤泡生发中心及滤泡间有玻璃样变的血管及浆细胞浸润(HE,×100)。
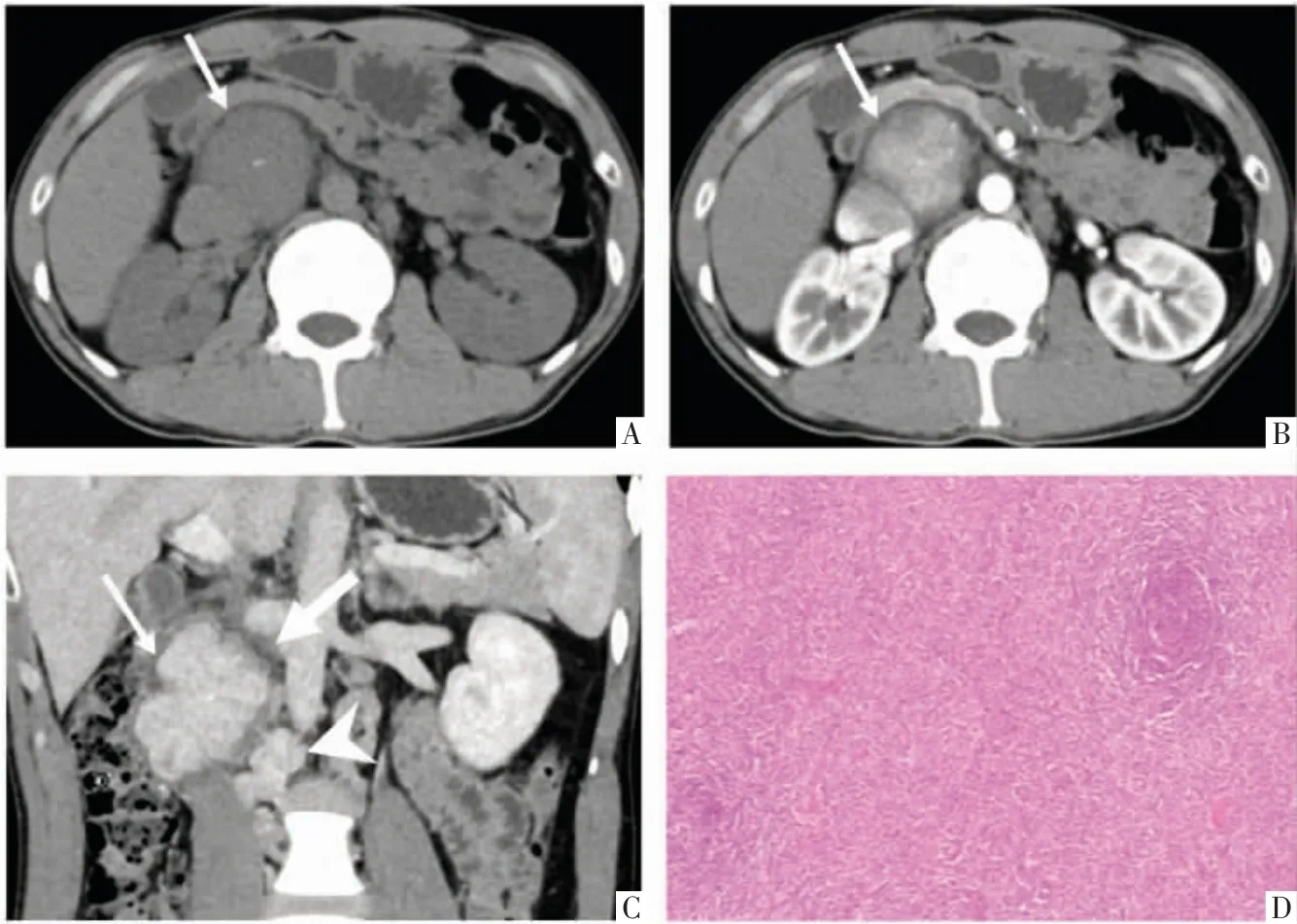
图2 透明血管型CD 病人,男,29 岁。A-C 图依次为横断面CT 平扫及动脉期、斜冠状面静脉期增强影像。右肾门水平下腔静脉前方见一软组织肿块(A,细箭),病灶内见斑点状钙化,动脉期不均匀明显强化(B,细箭),静脉期进一步强化(C,细箭),病灶边缘见环状低密度影(C,粗箭),周围多发卫星灶的强化方式与主病灶一致(C,箭头)。D 图,病理图。镜下可见滤泡生发中心及滤泡间大量血管增生,血管壁透明样变,滤泡周围淋巴细胞呈同心圆状排列(HE,×100)。
2.3 2 种病理类型的UCD 病灶与肾皮质相对强化率比较 12 例行增强扫描病例包括8 例透明血管型和4 例混合型UCD。在动脉期及静脉期2 种病理类型的UCD 病灶与肾皮质相对强化率差异均无统计学意义(均P>0.05),见表1。
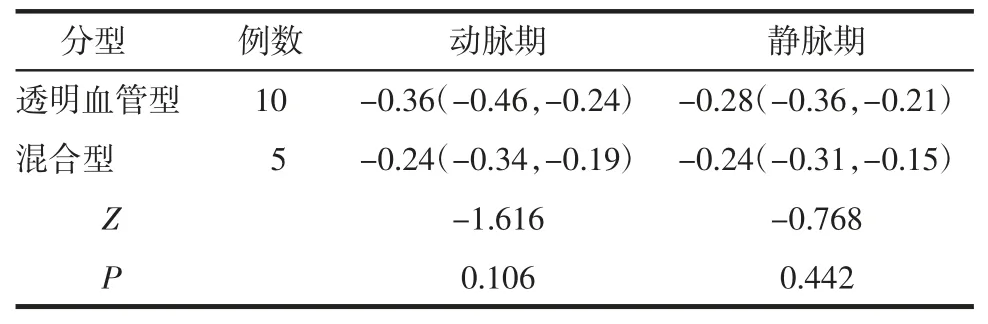
表1 UCD 病灶分型与肾皮质相对强化率比较
3 讨论
3.1 腹膜后UCD 的CT 表现及病理特征 腹膜后UCD 常表现为淋巴回流途径区域的单发软组织肿块,多见于肾脏周围尤其肾门区。CD 属于淋巴组织反应性增生,其淋巴结门和包膜存在,淋巴结基本结构完整,常表现为肾形或肾形样轮廓。UCD 多密度均匀,极少发生坏死、囊变或出血,这与病灶血供丰富、侧支循环良好以及淋巴组织特性有关。病灶内裂隙状延迟强化的低密度区被认为是UCD 的特征之一,国内研究者[7]发现其病理改变为增生的小血管壁透明样变和纤维化,而非坏死。本组1 例病灶内低密度区未见强化,可能与增强扫描的延迟时间较短有关。Zhao 等[8]纳入的74 例CD 病人中22例有腹膜后UCD 病灶,其钙化发生率为40.9%,表现为点状、分支状及粗大钙化。本组病例钙化形态与Zhao 等报道一致,但钙化发生率(46.7%)略高。分支状钙化反映了肿块内增生小血管退变及钙质沉积。UCD 周围卫星灶的病理改变与主病灶一致或者为反应性增生的淋巴结[9]。Wong 等[10]认为同一淋巴回流途径区域内的单组或相邻多组淋巴结受累均应诊断为UCD。本组仅4 例UCD 边缘清晰光滑,另11 例边缘见环状稍低密度影,周围脂肪间隙模糊,似“晕环”或“晕征”样表现,此征象既往文献鲜有报道。Zheng 等[11]发现病灶周围腹膜或筋膜增厚,可能为反应性增生改变。我们推测“晕征”为病灶包膜及周围组织的炎性反应。腹膜后其他局灶性良性及交界性病变多边界清晰,而恶性肿瘤可浸润周围组织,表现为不规则条片状、结节状软组织密度影[12],这与本组病例的“晕征”表现不同。我们认为“晕征”是腹膜后UCD 的特征性表现之一。
3.2 腹膜后UCD 的强化特征及强化率 关于腹膜后UCD 的强化方式文献报道不一,多数为动脉期明显强化,静脉期及延迟期可轻度廓清或进一步强化[3,13]。本组1 例透明血管型病灶增强扫描各期均呈轻度强化,与文献[8]报道不同,可能因病灶体积小、毛细血管增生不明显而血供不丰富。有文献[9]报道CD 强化与邻近大血管强化基本同步,而本研究中动脉期及静脉期病灶强化程度均低于肾皮质,认为这可能与病人体型、血液循环个体差异以及对比剂剂量、注射流率等因素有关。为了去除上述因素造成的CT 值差异,借助病灶与肾皮质的相对强化率这一指标做进一步分析。
3.3 2 种病理亚型腹膜后UCD 与肾皮质相对强化率比较 CD 依据病理组织学表现分为3 型:透明血管型、浆细胞型及混合型。目前采用影像学方法对分型的研究较少。本研究结果显示,透明血管型与混合型UCD 在动脉期及静脉期病灶与肾皮质相对强化率差异均无统计学意义。由于混合型CD 是由透明血管型与浆细胞型病变以不同比例混合而成,推测其强化程度及方式受2 种成分比例的影响,透明血管型和以透明血管型为主的混合型CD病灶内有丰富的增生毛细血管,增强扫描多呈明显强化,两者鉴别存在困难。本组无浆细胞型病例。包等[14]研究发现透明血管型CD 与浆细胞型CD 的强化程度存在差异,前者在动脉期及静脉期的CT 值均高于后者。
3.4 鉴别诊断 腹膜后UCD 少见,临床工作中容易误诊,需与其他富血供肿瘤鉴别:①神经鞘瘤,病灶易伸入椎间孔,易发生囊变,增强扫描多呈不均匀渐进性强化;②副神经节瘤,多位于大血管周围,易发生坏死囊变,增强扫描强化较UCD 更明显,病灶可见钙化,但分支状钙化少见,周围通常无卫星灶;③平滑肌肉瘤,病灶边界不清,易侵犯周围组织器官,尤其是大血管,坏死囊变多见,增强扫描实性部分明显强化[15]。
由于本研究为回顾性研究,病例未进行延迟期扫描,也未能对病变延迟期强化特征进行观察,并且样本量偏小,可能存在偏倚,故今后尚需增加病例数,进行更多的前瞻性研究,以弥补本研究的不足。
综上所述,腹膜后UCD 的增强CT 表现具有一定特征,表现为淋巴回流途径区域的单发软组织肿块,增强扫描明显强化,但低于同期肾皮质强化,病灶内可有裂隙状低强化区,周边可有多发增粗血管及卫星灶,当病灶边缘出现“晕征”时,高度提示CD病,确诊依赖病理检查。
专家点评(首都医科大学附属北京友谊医院 靳二虎):Castleman 病(Castleman disease,CD)是一种少见的疾病,以人体淋巴组织的过度增生为特征,在临床表现及病理改变方面具有高度异质性。临床上依据淋巴结病变的分布和器官受累的范围,将其分为单中心型CD(UCD)和多中心型CD(MCD)。UCD又称局限型CD,相对多见,病人年龄多为20~40 岁,仅累及单个淋巴结或是单一区域的淋巴结,后者表现为同一途径的淋巴引流区域内单组或相邻的多组淋巴结受累,手术切除病灶是有效的治疗方法,预后较好;MCD 相对少见,病人年龄较大(40~60 岁),表现为多个区域的淋巴结肿大,常伴有结外组织(如肺、肝、脾、肾、骨骼)受累,依据有无感染人类疱疹病毒-8(human herpes virus type 8,HHV-8),分为 HHV-8阳性和HHV-8 阴性病例,需酌情采用不同的治疗手段,预后较差。HHV-8 阳性病例多见于人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染者以及身体免疫状态受抑制的人群。病理上依据淋巴结病变的组织学特征,将CD 分为透明血管型(占80%~90%)、浆细胞型和混合型3 型,混合型CD 兼有前述两型的表现。作为一类淋巴组织异常反应性增生性疾病,CD 的病因及发病机制尚未完全明确。
CD 病不同亚型的诊断标准、治疗策略及病人预后存在较大差别,故基于影像学、病理学、实验室检查及临床表现进行准确诊断及分型,对临床医生制定个性化治疗方案具有重要作用。CT 检查具有无创、价廉、可及性好、扫描覆盖范围大的优势,是目前诊断和评估CD 病变范围的主要方法。本文描述并展示了本病的主要影像学特征,如病变沿淋巴引流分布、内部密度相对均匀(无坏死、无出血)、伴有钙化(斑点状、分支状)、边缘晕征、周围卫星灶、增粗血管影、增强CT 病变明显强化等,相信能提高读者对本病的认识并对临床诊断工作提供有益的参考。确诊本病需要活检或切除病变后进行组织病理学检查。
