trans/cis-[Co(en)2Cl2]Cl配合物的制备及其水解反应动力学常数测定
——面向大一学生的基础型综合化学实验
2021-06-03欧阳小清张春艳许振玲潘蕊吕银云阮婵姿翁玉华董志强任艳平
欧阳小清,张春艳,许振玲,潘蕊,吕银云,阮婵姿,翁玉华,董志强,任艳平
厦门大学化学化工学院,化学国家级实验教学示范中心(厦门大学),福建 厦门 361005
某些配合物由于配位体在中心离子周围的排列方式不同,而形成空间构型彼此不同的几何异构体。顺(cis-)-反(trans-)异构体是几何异构体中最简单的一种。对于平面正方形和正八面体配位化合物来说,顺-反异构现象十分常见[1]。顺-反异构体在物理、化学、生物性质上具有明显的区别,如大家熟知的最经典的顺铂和反铂,由于结构不同而导致其颜色和溶解性等不同,尤其是顺铂的抗癌活性,更引起人们对顺-反异构体的关注。顺铂与反铂的物理化学性质及生物活性差异充分体现了物质结构决定性质这一重要特性。配合物的水解反应动力学和反应机理的研究对催化反应、生物化学中的呼吸、代谢、能量转移等具有重要意义,多年来一直引起广泛关注[2]。
一年级学生在无机化学理论课中已经了解了有关配合物的顺-反异构现象。理论上来说,组成如MA2B2的平面正方形配合物以及组成为 MA4B2等八面体配合物具有顺-反异构体,但在实验中很难有效控制制备单一顺式或反式结构的配合物,所以,结构不同的顺-反异构体配合物的制备、鉴定及其在不同介质中水解反应动力学研究的经典实验在各类化学实验教材以及化学实验教学中都比较少见[3]。为了让学生直观、感性地认识到如何通过控制条件而制备某一固定的反式或顺式结构的配合物、如何区别和鉴定顺-反异构体、顺-反异构体的水解反应动力学行为是否相同等,我们综合文献[4–8]内容并在多年教学实践的基础上对其实验条件进行修正和适当优化,设计了“trans/cis-[Co(en)2Cl2]Cl配合物的制备及其水解反应动力学常数测定”的基础型综合实验项目。该实验项目涵盖了配合物顺-反异构体、晶体场分裂能、配合物的水解反应动力学有关概念及基础理论知识,以及顺-反异构体配合物制备、光谱鉴定及不同介质中水解反应动力学研究等实验方法和实验操作技能,并蕴涵着很多可引导学生深层次思考的问题,贯穿了可延伸、拓展实验内容以及自主设计的研究性实验内容。有利于培养一年级学生的文献查阅和实验设计等方面的综合能力,对丰富和扩展基础化学实验教学内容具有一定意义。
同时,为了便于学生预习和参考,在具体实验内容前列出了与本实验内容相关的、基础教学实验做过的实验项目名称,目的是让学生通过实验对照分析该实验与相关实验所包涵的不同思想与方法,以培养学生的分析辨别能力,让学生在对比中学习与提高。
1 实验目的
1) 了解顺-反异构体配合物的制备、分离原理和方法
2) 了解影响配合物晶体场分裂能的因素
3) 了解分光光度法测定化学反应动力学常数的原理和方法
4) 了解配合物顺-反异构体鉴别方法
5) 了解研究配合物化学反应动力学的实验方法以及八面体配合物的取代反应机理
相关实验[9]:K3[Fe(C2O4)3]·3H2O的合成及组成测定;[Co(NH3)6]Cl3的合成及组成测定;分光光度法测定[Ti(H2O)6]3+、[Cr(H2O)6]3+和[CrY]−的分裂能;(NH4)2S2O8氧化 I−的反应级数、速率常数及活化能的测定。
2 实验原理
2.1 trans/cis-[Co(en)2Cl2]Cl配合物的制备及其光谱鉴定
如前所述,在配位数为6的配合物中,顺-反异构现象也是常见的,其中最典型的例子就是顺式和反式八面体钴(III)的配合物,如二氯二乙二胺合钴(III)配离子([Co(en)2Cl2]+),能以图1所示的cis-[Co(en)2Cl2]+和trans-[Co(en)2Cl2]+两种异构体存在。

图1 [Co(en)2Cl2]+的结构
两种异构物中因Co(III)配位环境不同,导致两种异构体配合物的晶体场分裂能不同,在可见光区对光的选择性吸收不同,因此两种异构体的颜色不同,cis-[Co(en)2Cl2]+配离子是紫黑色的,而trans-[Co(en)2Cl2]+配离子是绿色的。结合文献[7,8]内容,通过组成和光谱分析以确定所制备的顺-反异构体。
从相关标准电极电位可以知道,在通常情况下,二价钴盐较三价钴盐稳定得多,而在它们的配合状态下却正相反,三价钴的配合物反而比二价钴的配合物稳定。因此,通常采用空气或H2O2氧化二价钴配合物的方法来制备三价钴的配合物[9]。
trans-[Co(en)2Cl2]Cl配合物制备是利用 CoCl2·6H2O 与乙二胺发生配合反应先生成[Co(en)2(H2O)2]2+,然后用 H2O2或空气中 O2进行氧化得到[Co(en)2(H2O)2]3+,再加入过量浓盐酸并加热蒸发而得到绿色的trans-[Co(en)2Cl2]Cl配合物。
绿色的trans-[Co(en)2Cl2]Cl配合物是动力学稳定产物,而cis-[Co(en)2Cl2]Cl配合物是热力学稳定产物,且其溶解度要大于trans-[Co(en)2Cl2]Cl配合物[10]。将绿色的trans-[Co(en)2Cl2]Cl配合物用适量纯H2O溶解,在水浴上蒸干,可发生异构化反应,就得到紫黑色的cis-[Co(en)2Cl2]Cl配合物[8]。
2.2 trans-[Co(en)2Cl2]Cl配合物酸水解反应速率常数及活化能测定
1) trans-[Co(en)2Cl2]Cl配合物酸水解反应速率常数测定。
文献[7]报道低浓度的trans-[Co(en)2Cl2]+配离子在酸性或中性条件下发生水解反应,形成如式(1)所示的[Co(en)2(H2O)Cl]2+配离子的顺式和反式异构体的红色混合物,即

因水是溶剂,由于反应体系中水大大过量,其浓度远远大于[Co(en)2Cl2]Cl的浓度,可近似认为整个水解反应过程中水的浓度不变,因此该水解反应可作为表观一级或准一级(pseudo-first order reaction)反应处理,一级反应的速率方程可由式(2)表示:
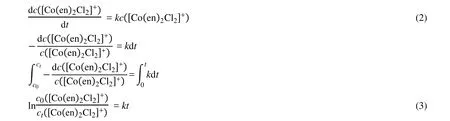
由朗伯-比尔定律 A = εbc,则

式(3)中,c0、ct分别代表反应物trans-[Co(en)2Cl2]+配离子初始浓度和水解反应进行到t时刻的浓度;
式(4)中,A0、At分别是trans-[Co(en)2Cl2]+配离子初始浓度和水解反应进行到t时刻的浓度所对应的吸光度。测定水解反应过程中不同时刻trans-[Co(en)2Cl2]+配离子的吸光度At,以ln(A0/At)为纵坐标,t为横坐标作图得一直线,直线的斜率k即水解反应的速率常数。
由式(3)水解反应动力学方程,可推出水解反应的半衰期(t1/2)计算公式:

2) trans-[Co(en)2Cl2]Cl配合物酸水解反应活化能测定。
一般化学反应速率随温度升高而加快,此因温度升高使反应速率常数随之增大。活化能与反应速率常数之间的关系可用阿仑尼乌斯方程式(Arrhenius equation)表示,即

式(6)中,k为反应速率常数,T为热力学温度,A为阿仑尼乌斯常数或指前因子;Ea为反应的活化能,R 为摩尔气体常数(8.314 J·mol−1·K−1)。
测定不同温度下的反应速率常数,以lnk对1/T作图,由所得直线的斜率−Ea/R,可计算反应的活化能Ea。
3 实验内容及要求
在本实验中,要求学生完成以下实验内容:
1) 以乙二胺、CoCl2·6H2O为原料,分别以空气和H2O2为氧化剂制备trans-[Co(en)2Cl2]Cl配合物;
2) 由trans-[Co(en)2Cl2]Cl配合物制备cis-[Co(en)2Cl2]Cl配合物;
3) 分别测定trans-[Co(en)2Cl2]Cl和cis-[Co(en)2Cl2]Cl配合物的吸收曲线;
4) 用分光光度法测定trans-[Co(en)2Cl2]Cl配合物在酸性介质中水解反应速率常数和活化能。
在完成上述实验内容的基础上,完成以下延伸及拓展的研究性实验内容:
5) 用分光光度法测定trans-[Co(en)2Cl2]Cl配合物在中性介质中水解反应速率常数和活化能;
6) 观察和分析trans-[Co(en)2Cl2]Cl配合物在碱性介质中水解反应情况;
7) 观察和分析cis-[Co(en)2Cl2]Cl配合物在中性、酸性、碱性介质中水解反应情况。
4 仪器与试剂
4.1 仪器
蒸发皿,电子水浴锅,循环水泵,抽滤瓶,布氏漏斗,烘箱,电子天平,试管,5 mL吸量管,美谱达V-1100D分光光度计(400–700 nm),岛津UV-2700紫外-可见分光光度计(300–800 nm)。
4.2 试剂
CoCl2·6H2O(s),乙二胺(H2NCH2CH2NH2, ethylenediamine, 简称 en),30% H2O2,浓盐酸,无水乙醇,1 mol·L−1H2SO4,0.1 mol·L−1NaOH,所用试剂都是市售分析纯试剂,未经纯化而直接使用。
5 实验步骤
5.1 trans-[Co(en)2Cl2]Cl配合物的制备
1) 空气中O2作氧化剂。
称1.6 g CoCl2·6H2O固体于蒸发皿中,加3.5 mL纯H2O溶解后,再加6.5 mL 10% (v/v)乙二胺溶液;室温下搅拌20 min;然后在持续搅拌下,逐滴加入5 mL浓盐酸后,将蒸发皿置于100 °C水浴上加热、搅拌至晶膜形成,冷至室温,再用冰水冷却使结晶完全。抽滤得到绿色产物,并用少量无水乙醇洗涤3次。抽干,将产物转至培养皿中,在110 °C的烘箱内烘10 min,冷却,称重,转至自封塑料袋中密封保存。
2) H2O2作氧化剂。
称1.6 g CoCl2·6H2O固体于蒸发皿中,加入6.5 mL 10% (v/v)乙二胺溶液,搅拌使固体完全溶解,逐滴加入3.5 mL 30% H2O2,并边加边搅拌;持续搅拌下,再逐滴加入5 mL浓盐酸后,将蒸发皿置于100 °C水浴上加热、搅拌至晶膜形成,冷至室温,再用冰水冷却使结晶完全。抽滤得到绿色产物,并用少量无水乙醇洗涤3次。抽干,将产物转至培养皿中,在110 °C的烘箱内烘10 min,冷却,称量,转至自封塑料袋中密封保存。
5.2 cis-[Co(en)2Cl2]Cl配合物的制备
称取0.3 gtrans-[Co(en)2Cl2]Cl配合物于蒸发皿中,加5 mL纯H2O溶解,将蒸发皿置于100 °C水浴上加热、持续搅拌至蒸干,就使绿色trans-[Co(en)2Cl2]Cl转变为紫黑色cis-[Co(en)2Cl2]Cl。冷却至室温,称重,将此紫黑色产物转至自封塑料袋中密封保存。
5.3 trans-[Co(en)2Cl2]Cl和cis-[Co(en)2Cl2]Cl配合物吸收曲线的测定
称取0.05 gtrans-[Co(en)2Cl2]Cl配合物及0.03 gcis-[Co(en)2Cl2]Cl配合物分别置于试管中,加10 mL纯H2O溶解后,并尽快(以避免发生H2O取代反应)在400–700 nm波长范围内,以纯H2O作参比,每隔10 nm测定一次吸光度值,在接近最大吸收峰处多测定几个数据。画出吸收曲线,找出最大吸收波长。
5.4 trans-[Co(en)2Cl2]Cl在酸性介质中水解反应速率常数的测定
用分析天平准确称取0.040 g (称量质量依产物的纯度及干燥程度而调整)trans-[Co(en)2Cl2]Cl配合物于干净干燥的试管中,用吸量管加5.00 mL纯H2O溶解;在最大吸收波长下,纯H2O作参比,测定溶液的吸光度。t0= 0.0 min的吸光度值记录为A0,表格样式如表1所示。

表1 trans-[Co(en)2Cl2]Cl配合物的吸光度A随时间变化值(λ ≈ 620 nm,室温)
用分析天平准确称取0.040 g (称量质量依产物的纯度及干燥程度而调整)trans-[Co(en)2Cl2]Cl于干净干燥的试管中,用吸量管加5.00 mL 1 mol·L−1H2SO4溶解,用分光光度法跟踪水解反应过程中trans-[Co(en)2Cl2]Cl反应物浓度的变化,即在最大吸收波长(~620 nm)条件下,每间隔10 min测量溶液的吸光度一次,直至ti= 100.0 min,计入表1中。以ln(A0/At)为纵坐标,t为横坐标作图得一直线,直线的斜率k即为水解反应的速率常数。
5.5 trans-[Co(en)2Cl2]Cl配合物在酸性介质水解反应活化能的测定
同上述测定室温下trans-[Co(en)2Cl2]Cl酸水解反应速率常数方法,分别测定高于室温10、20、30和40 °C时trans-[Co(en)2Cl2]Cl酸水解反应速率常数,用水浴控制温度。自行设计表格,记录实验数据。以lnk对1/T作图,由所得直线的斜率−Ea/R,计算反应的活化能Ea。
用5.4和5.5节所描述的方法,可以测定在中性介质中trans-[Co(en)2Cl2]Cl水解反应速率常数和活化能。
5.6 请学生自行设计实验方案和实验步骤
1) 观察和分析trans-[Co(en)2Cl2]Cl配合物在碱性介质中水解反应情况;
2) 观察和分析cis-[Co(en)2Cl2]Cl配合物在中性、酸性、碱性介质中水解反应情况。
6 注意事项
1) 上述制备过程需要在通风橱中进行,以免浓HCl挥发污染实验环境;
2) 制备实验用到的H2O2具有腐蚀性,请戴上乳胶手套操作;
3) 在活化能测定时,当测定温度高于30 °C,测定吸光度的时间间隔要适当缩短。
7 实验结果要求
1) 分别计算trans-[Co(en)2Cl2]Cl和cis-[Co(en)2Cl2]Cl配合物的产率;
2) 计算trans-[Co(en)2Cl2]Cl在中性、酸性介质中水解反应速率常数、半衰期及活化能;
3) 观察trans-[Co(en)2Cl2]Cl配合物在碱性介质中水解反应情况以及cis-[Co(en)2Cl2]Cl配合物在中性、酸性、碱性介质中水解反应情况。
8 思考题
1) 如何从理论上解释trans-[Co(en)2Cl2]Cl配合物在水浴加热后可以异构化为cis-[Co(en)2Cl2]Cl配合物?
2) 比较trans-[Co(en)2Cl2]Cl配合物和cis-[Co(en)2Cl2]Cl配合物的颜色及最大吸收波长,哪种异构体的分裂能(Δ0)较大?
3) 哪些实验现象或结果,直观地反映了顺-反异构体的结构不同、性质不同?
4) 根据上述实验结果,能否判断trans-[Co(en)2Cl2]Cl配合物在中性和酸性介质中的最终水解产物是相同的?如何证实?
5) 通过哪些实验方法来证实你制备得到的绿色和紫黑色产物的组成是相同的?能否仿照相关实验方法测定[Co(en)2Cl2]Cl配合物的组成?
9 结语
该实验是基于经典基础实验延伸和拓展而来的基础型综合实验,综合了配合物的顺-反异构体有关基本概念、水解反应动力学基础理论知识和基本的制备、光谱测定及化学反应动力学研究方法和实验操作技能。该实验原理、方法相对简单,不需要特殊实验仪器,一般教学实验室的实验条件都能满足该实验开设的要求,可多个学生同时进行实验;实验过程安全、环保;该实验的可延伸、拓展的空间大,可根据实际教学情况,由所列实验内容灵活组合,作为一年级学生的一个基础实验或基础的综合研究性实验。并且可以用于模块化教学,拆分成多个环节实验,适合不同学时的实验教学要求。
通过厦大“化学拔尖计划”班学生10年教学实践发现,设计这样以“trans-[Co(en)2Cl2]Cl配合物的制备其光谱鉴定和酸水解反应速率常数测定”实验为基础,拓展到“cis-[Co(en)2Cl2]Cl配合物的制备和光谱鉴定以及顺-反异构体在中性、酸性和碱性介质中水解反应动力学常数测定”的环环相扣、层层递进的实验项目,使学生具有“一步走错,满盘皆输”的感觉,格外引起学生的“好奇”与“关注”,学生的实验兴趣也油然而生。通过该实验的实施,能够消除一年级学生对于配位化学基本概念,如顺-反异构体、晶体场分裂能及水解反应动力学等生硬的认知,以及这些抽象的知识点在实验中如何具体化,再辅以“先做后教、以做定教”实验教学“翻转课堂”模式[11–16],更能有效加强学生对理论与实验的深度融合以及对学生分析、判断和批判性思维能力的培养,进而达到培养学生创新意识和创新能力的目的。
由于篇幅所限,有关该实验的实施结果及探讨等内容见后续报道。
