LC-MS/MS法分析生猪异位发酵床垫料中5大类兽用抗菌药物残留及蓄积趋势
2021-06-03郭炫君王武强罗成江沈红霞张航俊张晓丽孙冰冰
周 炜,郭炫君,2,王武强,陈 勇,罗成江,沈红霞,张航俊,侯 轩,张晓丽,王 彬,孙冰冰
(1. 浙江省动物疫病预防控制中心,杭州 311119;2. 钛和(杭州)医药技术服务有限公司,杭州 311121;3. 丽水市缙云县农业农村局,浙江丽水 321400)
长期以来,生猪养殖过程中产生的粪污因资源化利用率低,难以得到合理妥善处置而造成的环境污染事件时有发生,制约着生猪养殖业的规模化发展。近年来,生猪粪污异位发酵床处理技术,一种基于种植业桔杆粉末为载体的微生物持续发酵处理技术,正逐步被规模化生猪养殖场应用于生猪粪污处理。生猪粪污经动态的喷淋、翻刨、发酵后,臭气得到了有效控制,且熟化后的垫料可作为种植业和林业的有机肥料。在非洲猪瘟疫情防控形势依然严峻的当下,由于实现了与养殖核心区的分离,能满足生物防护要求、易于维护的异位发酵床迅速取代了直接与生猪接触的同位发酵床技术。2018年10月,全国畜牧总站为推广这一技术,举办了异位发酵床处理猪场粪污技术集成示范现场观摩活动。生猪养殖过程中使用的抗菌药物,多以原型、代谢产物等形式经粪、尿排出体外[1]。在异位发酵过程中,这些药物/代谢产物经粪污喷淋不断在垫料中蓄积。随着发酵堆积时间的延长,其量超出可接受的范围后,可能对消纳地中正常土壤菌群的生存环境、耐药基因水平传播产生不利影响[2-3]。然而,发酵堆积时间过短,垫料中蓄积的有机质过少,不能满足肥力要求。2020年6月,农业农村部办公厅、生态环境部办公厅联合印发《关于促进畜禽粪污还田利用依法加强养殖污染治理的指导意见》,鼓励畜禽粪污资源化利用先进工艺、技术和装备研发,保障生猪产品有效供给的同时保障环境安全。既要实现养殖场粪污的高效、低成本处理,又要保障消纳地环境安全以及种植业产品质量安全,异位发酵床垫料中抗菌药物残留检测技术和垫料安全性评估,就成为亟待解决的问题。目前,关于异位发酵床的研究仍主要集中于发酵、维护、除臭等方面,关于垫料中抗菌药物残留检测技术和垫料安全性评估的研究尚未见报道。本研究拟基于LC-MS/MS平台,开发垫料中抗菌药物残留检测技术,并对垫料中抗菌药物的分布和蓄积趋势进行研究,从而为异位发酵床垫料的合理、安全利用提供可靠的数据支持。
1 材料与方法
1.1 仪器 液质联用仪(安捷伦 1290 N液相系统及AB 5500 Qtrap质谱系统);MM 400球磨仪(德国Retsch公司);V20 水分测定仪和电子天平(梅特勒-托利多国际贸易(上海)有限公司);低温高速离心机(Sigma公司)。
1.2 试剂 乙腈与甲醇(色谱纯,德国默克公司);甲酸(色谱纯,ROE科学有限公司);Na2EDTA、磷酸氢二钠、柠檬酸和氢氧化钠(上海凌峰化学试剂有限公司);浓氨水和乙酸(国药集团化学试剂有限公司);PRIME HLB固相萃取柱(Waters公司)。
1.3 标准溶液 4种四环素类抗菌药混标(四环素、金霉素、土霉素和强力霉素,浓度为1 mg/mL,介质为甲醇)、22种磺胺类抗菌药混标(磺胺醋酰、磺胺甲噻二唑、磺胺二甲异噁唑、磺胺氯哒嗪、磺胺嘧啶、磺胺甲恶唑、磺胺噻唑、磺胺间甲氧嘧啶、磺胺甲基嘧啶、磺胺邻二甲氧嘧啶、磺胺吡啶、磺胺对甲氧嘧啶、磺胺甲氧哒嗪、磺胺二甲嘧啶、磺胺苯吡唑、磺胺间甲氧嘧啶、磺胺喹噁啉、磺胺异嘧啶、磺胺苯甲酰、磺胺二甲唑、酞磺胺噻唑、甲氧苄啶,浓度为1 mg/mL,介质为乙腈)、19喹诺酮类抗菌药混标(恩诺沙星、环丙沙星、沙拉沙星、氧氟沙星、诺氟沙星、培氟沙星、氟罗沙星、麻保沙星、达氟沙星、依诺沙星、吡哌酸、噁喹酸、二氟沙星、洛美沙星、氟甲喹、奥比沙星、司帕沙星、萘啶酸、西诺沙星,浓度为1 mg/mL,介质为甲醇)、3酰胺醇类抗菌药混标(氯霉素、氟苯尼考、甲砜霉素,浓度为1 mg/mL,介质为甲醇)和6大环内酯类抗菌药混标(林可霉素、泰乐菌素、替米考星、罗红霉素、克林霉素、阿奇霉素,浓度为1 mg/mL,介质为甲醇),均购自天津阿尔塔科技有限公司。
1.4 样品的采集与制备 发酵床按九宫格分区,各区中心位置点自上而下用对铲采集各层垫料,混匀。九份试样搅拌混合均匀后,四分法取1 kg垫料于密封袋中。液氮速冷后,4 ℃冷藏保存,7 d内完成检测。共对12个养殖场的异位发酵床进行了采样。试验所需阴性对照试料(新配尚未投入使用的垫料),由丽水市缙云县新建异位发酵床场提供。
取试样约5 g,均分至2个球磨罐中,放入直径1 cm的钢珠1颗。迅速置于液氮中,预冷2 min后,用球磨仪以30 Hz频率振摇0.5 min后,取出粉末,置50 mL离心管,备用。
1.5 试料水分测定 取新制试料适量,照《中华人民共和国 兽药典》附录水分测定法中第一法“费休氏法 库仑滴定法”,测定试料中水分含量。
1.6 试料前处理 称取试料2.0 g,加入10 mL Mcllvaine-Na2EDTA缓冲液(pH 4.5),涡动混匀,超声提取15 min,10000 r/min离心5 min。取全部上清液,置另一50 mL离心管中。上清液和残渣分开处理。取上清液,全部通过经甲醇和水活化好的PRIME HLB固相萃取柱,依次用水、5%甲醇水溶液淋洗,抽干。用8 mL洗脱液(取甲醇150 mL,乙酸乙酯150 mL、浓氨水6 mL,混匀)洗脱。取残渣加入10 mL乙腈重复提取1次,取上清液于50 mL离心管中。将HLB柱的洗脱液与乙腈提取液合并,40 ℃水浴氮气吹干,加入1.0 mL复溶液(取甲醇50 mL、0.1%甲酸水50 mL,混匀),涡动溶解残余物,滤膜过滤,供液相色谱-串联质谱测定。
1.7 仪器条件
1.7.1 色谱条件 色谱柱:Waters Atlantis dC18柱(3.0 mm×150 mm,3 μm),柱温:30 ℃;流动相A:0.2%甲酸水,流动相B:甲醇;梯度洗脱程序:0~1 min,5% B, 1~16 min,98% B, 16~18 min,98% B, 18.1~22 min,5% B。进样量:5 μL,流速: 0.5 min。
1.7.2 质谱条件 离子源:电喷雾离子源(ESI);扫描方式:正负离子同扫,监测方式:多反应监测(MRM);离子源温度:550 ℃,气帘气流速:40 L/h;脱溶剂流速:medium;离子源气流速:雾化气:50 L/h,辅助气:35 L/h;驻留时间:20 ms;多反应监测离子的定性、定量离子对及碰撞电压等质谱参数见表1。
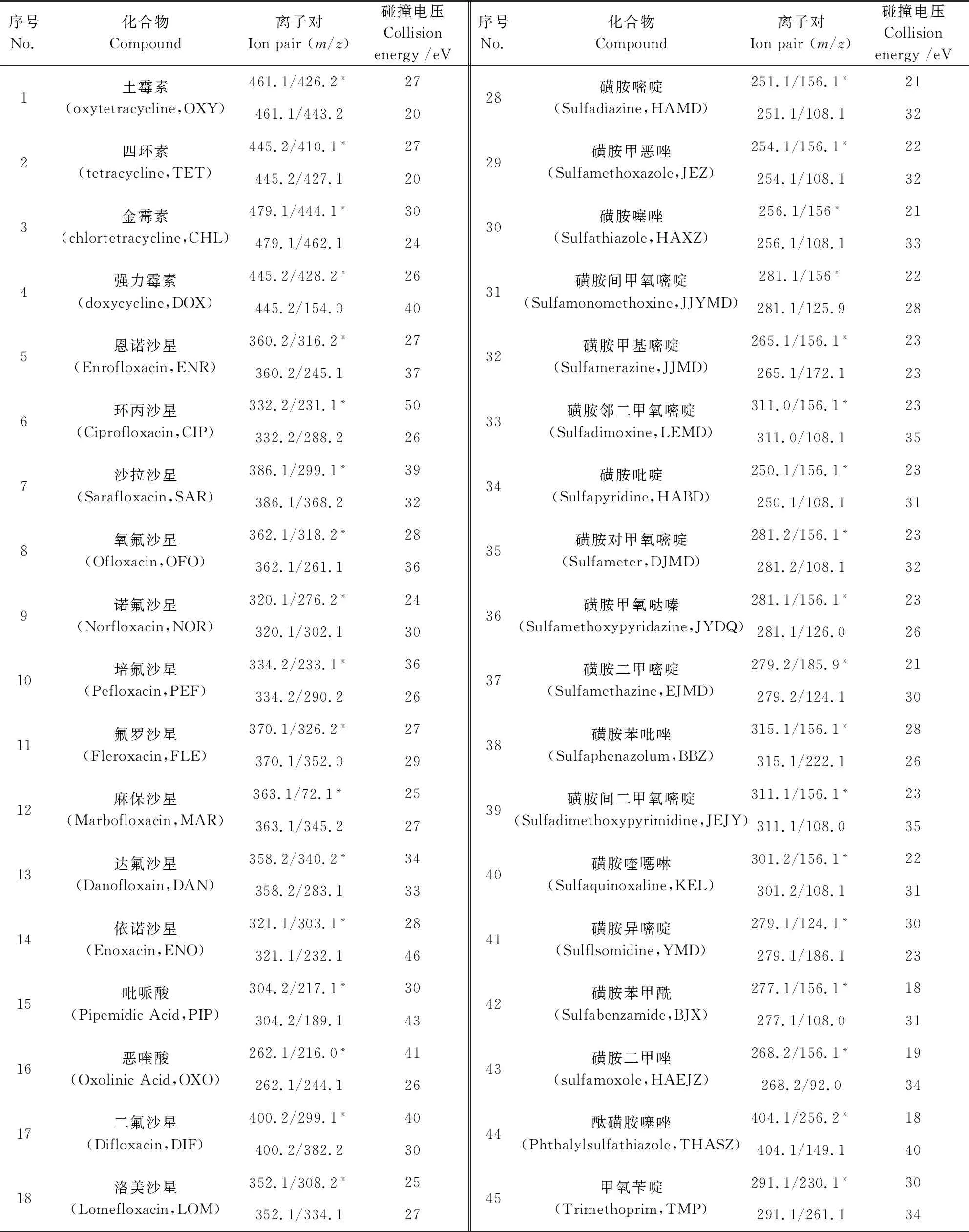
表1 待测化合物的MRM模式检测参数Tab 1 MRM parameters of the target compounds
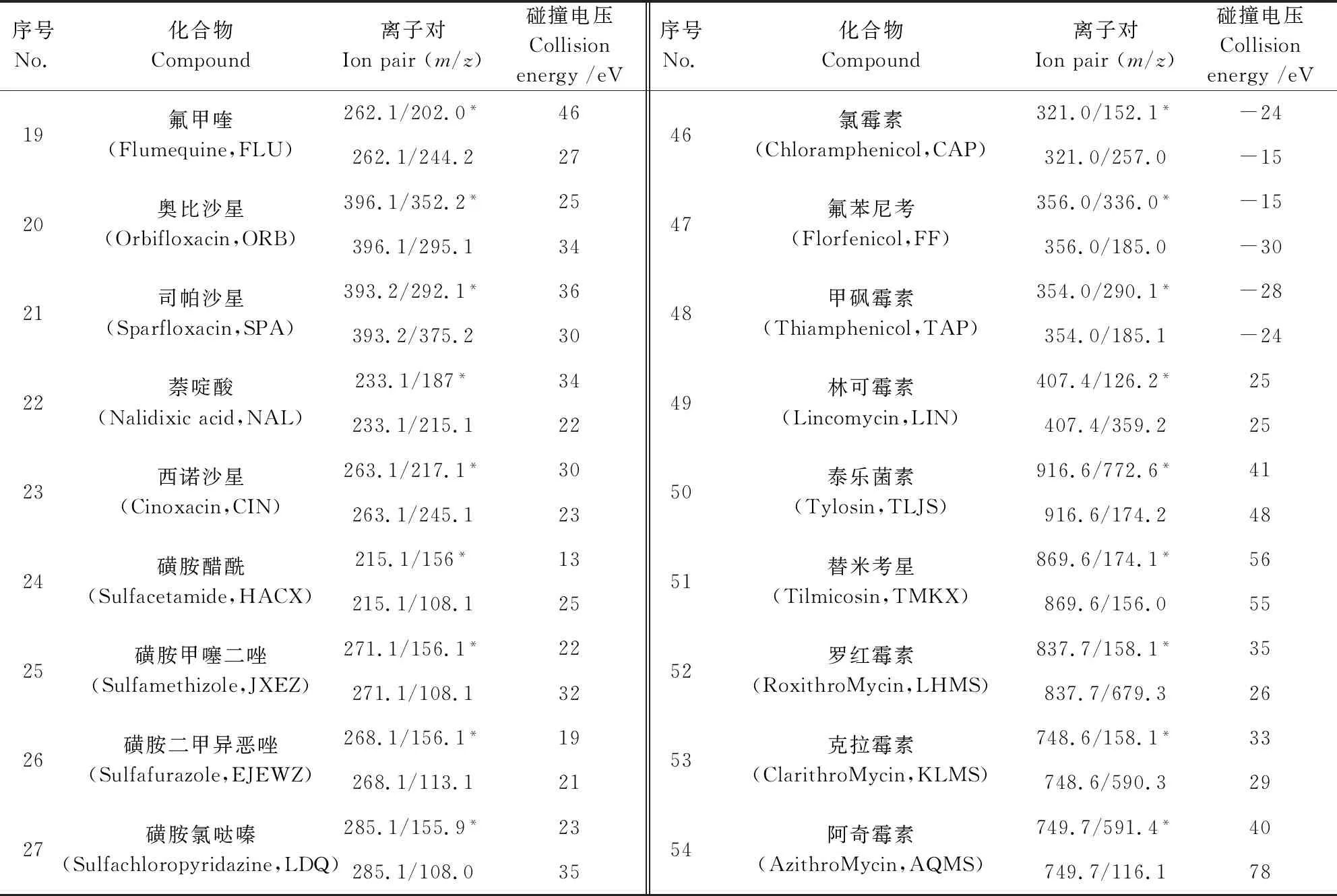
序号No.化合物Compound离子对Ionpair(m/z)碰撞电压Collisionenergy/eV序号No.化合物Compound离子对Ionpair(m/z)碰撞电压Collisionenergy/eV19氟甲喹(Flumequine,FLU)262.1/202.0*46262.1/244.22746氯霉素(Chloramphenicol,CAP)321.0/152.1*-24321.0/257.0-1520奥比沙星(Orbifloxacin,ORB)396.1/352.2*25396.1/295.13447氟苯尼考(Florfenicol,FF)356.0/336.0*-15356.0/185.0-3021司帕沙星(Sparfloxacin,SPA)393.2/292.1*36393.2/375.23048甲砜霉素(Thiamphenicol,TAP)354.0/290.1*-28354.0/185.1-2422萘啶酸(Nalidixicacid,NAL)233.1/187*34233.1/215.12249林可霉素(Lincomycin,LIN)407.4/126.2*25407.4/359.22523西诺沙星(Cinoxacin,CIN)263.1/217.1*30263.1/245.12350泰乐菌素(Tylosin,TLJS)916.6/772.6*41916.6/174.24824磺胺醋酰(Sulfacetamide,HACX)215.1/156*13215.1/108.12551替米考星(Tilmicosin,TMKX)869.6/174.1*56869.6/156.05525磺胺甲噻二唑(Sulfamethizole,JXEZ)271.1/156.1*22271.1/108.13252罗红霉素(RoxithroMycin,LHMS)837.7/158.1*35837.7/679.32626磺胺二甲异恶唑(Sulfafurazole,EJEWZ)268.1/156.1*19268.1/113.12153克拉霉素(ClarithroMycin,KLMS)748.6/158.1*33748.6/590.32927磺胺氯哒嗪(Sulfachloropyridazine,LDQ)285.1/155.9*23285.1/108.03554阿奇霉素(AzithroMycin,AQMS)749.7/591.4*40749.7/116.178
1.8 基质匹配标准曲线的制备 取6份阴性对照试料,除在HLB柱的洗脱液与乙腈提取液的合并液中加入相应标准溶液适量外,其余步骤同1.6 试料前处理项操作。使6份阴性对照试料的上机液中四环素类药物的浓度依次为20、40、80、150、300、500 μg/kg;磺胺类药物、喹诺酮类药物、大环内酯类药物和氯霉素类药物最终上机浓度依次为 5、10、20、50、100、200 μg/kg系列基质标准溶液。上机检测后,以其浓度为横坐标,对应的峰面积为纵坐标,制备基质匹配标准曲线。
1.9 方法的灵敏度、回收率和精密度 采用阴性对照上机液添加目标化合物的方法,依据特征离子质量色谱峰信噪比S/N≥3的浓度为检出限(LOD),S/N≥10的浓度为定量限(LOQ)。依据初定的LOD及LOQ浓度,添加适量标准溶液于2.0 g阴性试料中,经前处理并上机测定。在相应的保留时间处,无共流出物干扰,且满足定性定量检测的浓度,确定方法的灵敏度。
在确定方法定量限的基础上,取阴性试料,作3个添加水平的回收率试验,其中四环素类药物为20.0、40.0、100.0 μg/kg,其他4类药物均为10.0、20.0、50.0 μg/kg,每个水平5个平行,重复3次试验,以确定其方法回收率和精密度。
2 结果与分析
2.1 基质匹配标准曲线线性结果 当四环素类药物在20~500 μg/kg浓度范围内,磺胺类药物、喹诺酮类药物、大环内酯类药物和氯霉素类药物在5~200 μg/kg浓度范围内时,54种待测化合物的浓度-响应曲线,线性良好,R均>0.99(表2)。
2.2 方法的灵敏度、回收率和精密度 在所试条件下,吡哌酸和依诺沙星回收率偏低且西诺沙星响应值偏低,当选取S/N≥3作为检出限时难以满足检测要求,但当选取S/N≥5对应的浓度作为检出限时,可满足检测要求。经试,四环素类药物的LOD和LOQ值最终分别确定为10 μg/kg和20 μg/kg,磺胺类药物、喹诺酮类药物、大环内酯类药物和氯霉素类药物的LOD和LOQ值均则分别确定为5 μg/kg和10 μg/kg。
如表2所示,52种待测化合物的平均回收率在61.3%~111.7%之间,吡哌酸和依诺沙星平均回收率在46%左右,各待测化合物整体回收率在40.8%~126.2%之间,较低的回收率主要集在中浓度相对较低的定量限浓度点。54种化合物的批内回收率在0.7%~14.2%之间,批间回收率则在6.4%~18.3%之间。表明所建立的方法能满足日常检测要求。
2.3 垫料水分含量 结果如表3所示。如表3所示,12家养殖场的异位发酵床垫料样品,水分含量在37.7%~70.2%之间,其均值和中位值分别为54.7%和56.4%。结果表明,生猪异位发酵床垫料样本中水分含量较高,且波动范围也较大。为排除试样水分对评估结果的干扰,本实验中垫料中抗菌药物残留量结果均以折水后含量表示。

表3 生猪异位发酵床垫料样品中水分含量Tab 3 The moisture levels of litters form ectopic pig manure fermentation beds
2.4 垫料中抗菌药物分布 结果如图1所示。如图1所示,在监测的12家养殖场的异位发酵床垫料中检出4种四环素类、10种喹诺酮类、5种磺胺类、2种酰胺醇类和4种大环内酯类药物,共涉及25种抗菌药物残留,残留总量在0.7~28 g/t之间,平均值和中位值分别为6.8 g/t和2.0 g/t。
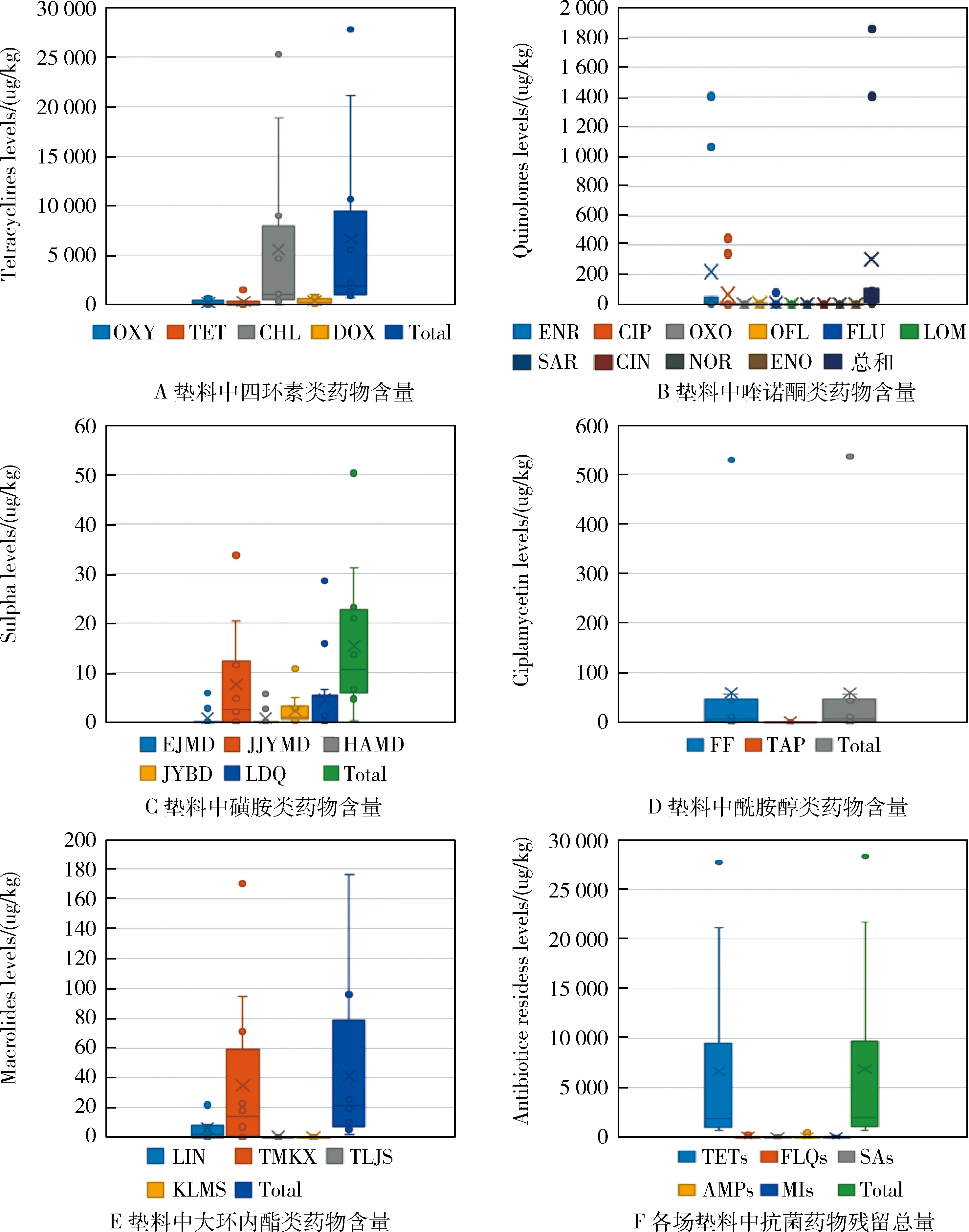
图1 生猪异位发酵床垫料中四环素类、喹诺酮类、磺胺类、酰胺醇类和大环内酯类抗菌药物残留量Fig 1 Tetracyclines(A), Quinolones(B), Sulpha(C), Amphenicols(D), Macrolides(E) levels and the total antibiotics residual levels in litters form 12 ectopic pig manure fermentation beds
在12家养殖场的所有垫料样本中,4种四环素类药物均有检出,总残留量介于687.5~27736.1 μg/kg之间。金霉素和土霉素检出量最高,除11号养殖场外(27.4%),两者对四环素类药物总残留量的贡献率在60.8%~92.4%之间。
12家养殖场的所有垫料样本中,喹诺酮类药物总残留量在5.6~1858.2 μg/kg之间。恩诺沙星和环丙沙星检出率均为100%,两者对喹诺酮类药物总残留量的贡献率在16%~100%之间,氧氟沙星和氟甲喹的检出率则分别为91.7%和41.7%,其余6种检出的喹诺酮类抗菌药物仅为零星检出。
2家养殖场的垫料样本中磺胺类化合物残留量低于检出限,其余10家养殖场垫料样本中的总残留水平在5.6~50.2 μg/kg区间内。磺胺间甲氧嘧啶的检出率为72.7%,检出浓度均值为7.46 μg/kg,其对磺胺类药物残留总量的贡献率在33.1%~97.9%之间。其他磺胺类药物均为零星检出,增效剂磺胺甲氧苄啶尽管检出率达到91.7%,但浓度均在检出限附近,仅10号养殖场样本达到10.7 μg/kg。
就酰胺醇类化合物而言,仅6家养殖场垫料样本有检出,总残留量在8.4~536.2 μg/kg之间。除1号养殖场垫料样本中同时检出氟苯尼考(582.8 μg/kg)和甲砜霉素(7.4 μg/kg)外,其余5份垫料样本均仅检出氟苯尼考,均值为116.3 μg/kg,中位值为45.9 μg/kg。
12家养殖场垫料样本中均有大环内酯类药物检出,总残留量在5.2~176.0 μg/kg之间。其中替米考星和林可霉素检出率均为66.7%,两者之和对大环内酯类抗菌药物残留总量的贡献率达到96%~100%。
3 讨论与结论
3.1 前处理方法 根据前期调研,生猪养殖过程中主要使用的抗菌药物有四环素类、磺胺类、大环内酯类、酰胺醇类和喹诺酮类。因而,所建立的方法应尽量涵盖这些常用抗菌药物。
由于四环素类和大环内酯类药物多对热不耐受,制样采用超低温冷冻球磨的方式,避免了粉碎过程产热对这些药物的破坏。为控制水溶性色素及杂质的共流出干扰,尝试仅使用甲醇、乙腈等有机溶剂进行提取,然而四环素类化合物的添加回收率近乎为零。这可能与饲料中铁、铜、钙等金属元素含量较高有关。这些经粪污进入垫料中的Ca2+、Mg2+、Fe3+离子,可与四环素类化合物B环C12位的烯醇基和C环C11位的酚羟基,形成难溶的螯合物[1]。现有饲料中四环素类药物液质法检测的文献中,基本均使用0.1 mol/L Mcllvaine-Na2EDTA溶液提取配合亲水亲酯型固相萃取小柱(SPE)净化策略。Mcllvaine-Na2EDTA溶液既保障了四环素类抗菌药物的水溶性和水溶液的稳定性,也控制了基质中金属离子对目标化合物的络合反应[4]。磺胺类和喹诺酮类药物通常使用甲醇、乙腈等有机溶剂进行提取。预试结果表明,纯乙腈作提取体系时,可有效降低上机液中的蛋白质类杂质。氟苯尼考的代谢产物氟苯尼考胺通常在偏碱性条件下提取,经试,在本方法条件下氟苯尼考胺的提取效率不稳定,且在C18柱上的色谱行为易受试样中共流出物的干扰。同时,已有研究表明,约64%的氟苯尼考以原型方式通过尿液排出动物体外[5],因而本研究中放弃对氟苯尼考胺的考查,以保全其通用性。
受亲水亲酯型SPE小柱净化过程中对有机相和水相比例要求较为严苛的影响,很难兼顾这5类药物的净化。因而,采取“Mcllvaine-Na2EDTA溶液提取,配合亲水亲酯型SPE小柱净化”加“乙腈进行二次提取”的方式对试样进行提取与净化。将SPE柱洗脱液与乙腈提取液合并后,经吹干、复溶即可上机检测。
3.2 异位发酵床垫料水分含量 一般生猪养殖过程中产生的粪污每天2~4次喷淋在异位发酵床垫料上,且边喷淋边翻抛搅拌以使微生物充分发酵。为保障菌种有适宜的条件生长,蒋锁俊等[6]建议异位发酵床垫料水分控制在37%~45%之间。受喷淋与采样间隔时间以及喷淋量、喷淋雾化效果、发酵床温度等多重因素影响,发酵床垫料中水分含量波动幅度很大,可能严重干扰对垫料中抗菌药物残留量的评估。经干燥后测定的方法,可控制水分的干扰,但干燥方法的选择同样影响抗菌药物残留量的评估。干燥失重的方法可直接测定其水分的相对含量,但105 ℃的常用干燥温度并适合于对热不耐受的抗菌药物。此外,因垫料基质多由木屑、桔杆等对水吸附能力较强的材料组成,测定结果重现性较差,且过长的干燥时间加重样品间交叉干扰的风险。因垫料基质和待测的抗菌药物并不与卡费休试剂反应,且所需样品量很少,故本方法采用费休氏滴定法进行水分含量测定。采用超低温冷冻球磨的方式制样,既有利于减少制样过程中垫料样品中的水分挥发,也利于滴定过程中样品内部水分的全部快速释放。12家养殖场的异位发酵床垫料样品,水分含量在37.7%~70.2%之间,其均值和中位值分别为54.7%和56.4%,略高于蒋锁俊等建议的参考范围[6],这可能与水分测定方式、采样时间和喷淋时间之间的间隔长短、养殖场粪污预处理方式等因素有关。晏婷等[7]在探索异位发酵床对肉鸭粪污处理能力时,在其所试条件下,垫料水分含量在66%~76%之间,与本试验结果部分重合。
3.3 异位发酵床垫料中5大类抗菌药物蓄积量与趋势 在监测的12家养殖场的异位发酵床垫料中共检出5大类25种抗菌药物。5类抗菌药物蓄积总量的平均值排序为:四环素类(6665 μg/kg)>喹诺酮类(84.7 μg/kg)>酰胺醇类(59.5 μg/kg)>大环内酯类(41.4 μg/kg)>磺胺类(15.4 μg/kg),这一排列顺序符合养殖场抗菌药物使用情况调研结果,也基本符合兽医临床中跨类别组方的比例。尽管尚没有垫料中抗菌药物残留检测的相关数据佐证,但与一些畜禽粪便中抗菌药物残留检测结果相符。Zhao等[8]对中国8个省大型养殖场猪粪便的检测结果显示,土霉素和金霉素的残留均值分别为59.06 mg/kg和21.06 mg/kg,环丙沙星和恩诺沙星的残留均值分别为33.98 mg/kg和33.26 mg/kg。Yevenes K等[9]检测发现粪便中四环素类、磺胺类和酰胺醇类药物的浓度在1.4~300 mg/kg之间。
12家养殖场垫料样本中,四环素类残留总量最高。土霉素和金霉素残留量对四环素类药物残留总量的贡献率在61%~94%之间。依据原《农业部公告第168号》[10],土霉素和金霉素除具抑菌作用外,还允许作为促猪、禽生长添加剂使用。在这些养殖场抽取的19批次育肥猪饲料中10批次检出金霉素,13批次保育猪饲料中3批次检出土霉素。多西环素主要用于兽医临床治疗使用,因而,其检出率和检出值均显著低于土霉素和金霉素。
12家养殖场垫料样本中,恩诺沙星和环丙沙星检出率均为100%。除1号养殖场垫料样本中环丙沙星残留量显著高于恩诺沙星残留量外(P<0.05),其余11家养殖场垫料样本中环丙沙星残留量均约为恩诺沙星残留量的1/3~1/7,这些较低含量的环丙沙星可能是恩诺沙星在生猪体内代谢形成[1,11],也不排除在异位发酵过程中经微生物代谢形成的可能,但仍需进一步研究证实。
磺胺氯达嗪和磺胺间甲氧嘧啶被广泛应用于预防夏季和秋季育肥猪的弓形体感染;甲氧苄啶作为磺胺类药物的增效剂,使用量亦较大。因而,在异位发酵床垫料中这3种磺胺类药物检出率较高。其中,磺胺间甲氧嘧啶(均值为7.46 μg/kg)在8家养殖场的垫料样本中检出,其对磺胺类药物残留总量的贡献率在33.1%~97.9%之间。长期以来,磺胺类药物残留量是猪肉产品质量安全检测的重要监测指标,磺胺二甲嘧啶和磺胺间甲氧嘧啶也是猪肉产品质量安全的主要风险因子。然而,在12家养殖场垫料样本中,仅4号和7号养殖场垫料样本中检出低于6 μg/kg的磺胺二甲嘧啶。这一方面与这几家养殖场更倾向于使用磷酸泰乐菌素磺胺二甲嘧啶预混剂有关,一方面可能与磺胺类药物水溶性有关。马文瑾等[2]综述了堆肥处理过程中磺胺类、四环素类、喹诺酮类药物的浓度变化趋势,水溶性较强的磺胺在堆肥过程中会随粪尿流失。
较氯霉素更安全、抗菌活性更好的氟苯尼考成为生猪呼吸道疾病防治的首选。12家养殖场垫料样本中,氟苯尼考检出率为83.3%,但除1号养殖场垫料样本中氟苯尼考残留量为582.8 μg/kg外,其余9个样本中的残留量均低于60 μg/kg。1号和2号养殖场垫料中检出氟苯尼考的同时,还分别检出7.37 μg/kg和0.68 μg/kg的甲砜霉素。
在12家养殖场垫料样本中,9家养殖场垫料样本检出替米考星,且其对大环内酯类抗菌药物残留总量的贡献率达到58%~100%。这与替米考星对治疗胸膜肺炎、巴氏杆菌感染和支原体感染有较好的效果有关。林可霉素虽然有着83.3%的检出率,但残留量均低于26 μg/kg,可能与这些养殖场使用的少量盐酸大观霉素盐酸林可霉素可溶性粉有关。
总体而言,12家养殖场垫料样本中5大类抗菌药物残留总量在0.7~28 g/t之间,平均值和中位值分别为6.8 g/t和2.0 g/t。5大类药物中四环素类药物残留量最高,其对各场垫料中抗菌药物总残留量的贡献率在91.3%~98.8%之间。异位发酵床垫料启用时间最早的2号场(2009年启用,1.2 g/t)垫料样本中抗菌药物残留总量并非最高。表明,异位发酵床垫料中抗菌药物残留量并不完全取决于异位发酵床启用时间,还与养殖场的养殖管理水平、用药习惯以及异位发酵床维护方式方法等因素均有关。
本研究建立了生猪异位发酵床垫料中四环素类、喹诺酮类、磺胺类、酰胺醇类和大环内酯类,共54种抗菌药物残留量的LC-MS/MS检测方法。超低温冷冻粉碎后的垫料样本以费休氏-库仑滴定法测定水分,用Mcllvaine-Na2EDTA缓冲液和乙腈提取,经亲水亲脂平衡固相萃取小柱净化,用LC-MS/MS法测定抗菌药物残留量,最终结果以折水后含量表示。方法具有简便、高通量、抗干扰的特点,满足日常检测要求。在12家养殖场垫料样本中共检出25种抗菌药物,各场垫料样本总残留量在0.7~28 g/t之间,其中四环素类药物对总残留量的贡献率在91.3%~98.8%之间。异位发酵床垫料中抗菌药物残留量并不完全取决于异位发酵床启用时间,还与养殖场的养殖管理水平、用药习惯以及异位发酵床维护方式方法等因素均有关。
