乙醇浓度和应变率对扩散火焰特性的数值分析
2021-06-03石敦峰甘云华罗燕来江政纬周毅
石敦峰,甘云华,罗燕来,江政纬,周毅
(1华南理工大学电力学院,广东广州510640;2广东省能源高效清洁利用重点实验室,广东广州510640)
引 言
液体燃料具有能量密度高、存储方便和易于运输等优点[1],广泛应用于各个领域[2-4]。近年来,随着纳米和微加工技术的进步,设备逐渐向小型化和多功能化方向发展[5]。乙醇是一种常见的清洁液体燃料,在工业和生活中得到广泛应用[6-7]。由于乙醇沸点低、易蒸发,且具有相对较高的火焰传播速度,可以在贫燃的条件下以较低的温度进行燃烧[8],这些特性使得乙醇适用于液体燃料燃烧器。Chen等[9]和Xu等[10]研究了液体乙醇自蒸发微管扩散火焰燃烧特性。甘云华等[11-15]从燃料流量、火焰高度、射流空间等方面考察了液体乙醇微射流扩散火焰的结构和特征。然而相关研究中都是采用射流以及液体燃料直接燃烧的方式形成扩散火焰,而未提前气化处理,乙醇燃烧过程同时受到液体燃料蒸发和火焰动力学的影响[9],不便于分析液体燃料的火焰燃烧特性。
由乙醇沸点低、易蒸发的特点,及静电喷雾[16-20]可产生粒径在微米或纳米量级液滴可知,乙醇可雾化为小粒径的液滴,快速蒸发,从而使得乙醇变为气体参与燃烧反应,而不需要进行预蒸发处理。针对液体燃料的喷雾燃烧,学者们做了一些研究。Nomura等[21]开发了一种部分预蒸发的喷雾燃烧器,探讨了当量比、燃料液滴平均直径以及应变率对燃料液滴和火焰之间的相互作用的影响。叶宏程等[22]采用无水乙醇为燃料,设计液体燃料荷电雾化对冲燃烧器,以液体燃料荷电喷雾形态、火焰形态和火焰温度作为研究对象,探讨不同条件下喷雾形态和火焰特性的变化规律及其影响机制。然而相关研究从实验的角度对喷雾燃烧[23-24]的火焰形态、温度等宏观特性进行讨论,而对燃烧的官能团、基元反应速率、温度敏感性等微观火焰特性的研究还存在不足。
对冲燃烧作为一种基本燃烧方式,其流场中心轴线上的速度分布是一维的,且燃烧器壁面对火焰的干扰度小,可控性强,适用于火焰特性的基础研究[25]。Wang等[26]研究了非预混的二甲醚和乙醇对冲火焰的熄灭应变率随环境压力和反应物温度提高及燃料浓度变化的规律。Seiser等[27]研究了在对冲模型中预混和非预混两种火焰类型下的甲醇和乙醇火焰的熄灭和自燃。Veloo等[28]研究了在对冲模型中预混的甲醇、乙醇和正丁醇火焰的层流火焰速度和熄灭应变率。然而相关的研究中均是将乙醇和二甲醚或者其他燃料,在温度、熄灭应变率、火焰速度等方面进行对比,而对乙醇自身的火焰结构、温度分布等特性随乙醇浓度、应变率等因素变化规律研究较少。本文在本课题组的前期工作基础上[11-15,22],提出在乙醇荷电雾化为小粒径液滴后,可实现乙醇燃料的快速蒸发,使得乙醇变为气体参与燃烧反应,并用叶宏程等[22]的部分实验数据进行验证,最后模拟分析乙醇浓度和应变率对扩散火焰特性的影响,可为液体对冲燃烧器的设计提供理论指导。
1 数值模拟
1.1 物理模型
轴对称对冲扩散火焰模型如图1所示。氮气稀释的乙醇(乙醇/N2)与空气(O2/N2)分别从上喷嘴(燃料侧)和下喷嘴(氧化剂侧)中流出,两个喷嘴之间的距离是1.4 cm,喷嘴直径均为2.5 cm。无水乙醇为液体燃料,沸点351.6 K,本研究条件下的液体燃料乙醇雾化为足够小的液滴,且与周围气体充分接触,可认为乙醇到达喷嘴出口时,其已经完全蒸发为乙醇气体,然后在其下游参与燃烧反应,形成对冲扩散火焰。基于此,设定乙醇/N2出口温度为360 K,空气出口温度298 K,压力为0.1 MPa。
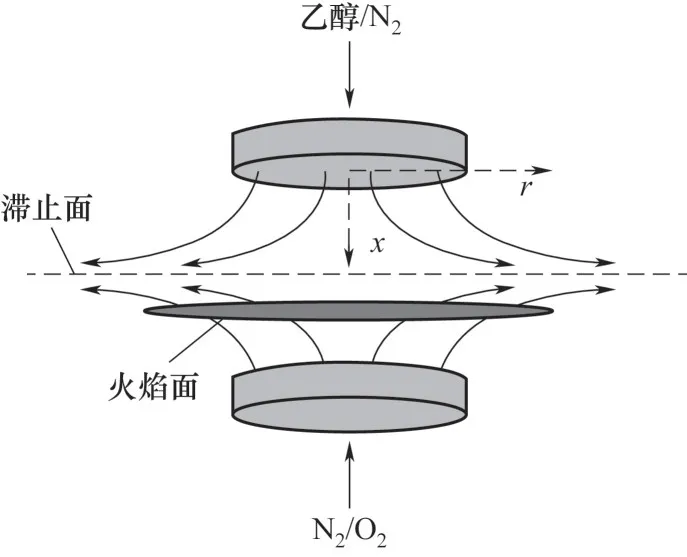
图1 火焰结构示意图Fig.1 Schematic diagramof flame structure
1.2 数学模型
该轴对称问题的控制方程可简化为一维常微分方程,包括质量守恒方程、动量守恒方程、能量守恒方程和组分守恒方程[29]:
质量守恒方程

动量守恒方程

式中,x为轴向坐标;r为径向坐标;u为轴向速度,m·s-1;v为径向速度,m·s-1;T为温度,K;ρ为混合物密度,kg·m-3;cp、cpk分别为常压下混合物、第k种气体的比热容,J·(kg·K)-1;ω˙k为第k种组分的单位体积摩尔生成速率,mol·m-3·s-1;Wk、Yk、hk分别为第k种组分的分子量、质量分数、比焓(J·kg-1);μ为混合物黏度,Pa·s;q˙r为辐射热损失;Vk为第k种组分的扩散速度,可通过式(5)计算:
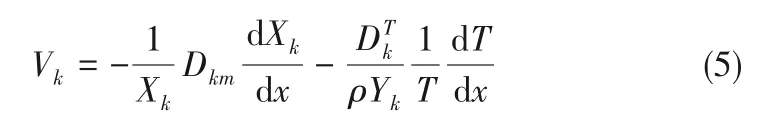
式中,Dkm为混合物平均扩散系数;DTk为热扩散系数;Xk为第k种气体的摩尔分数。
对于辐射热损失采用了光学薄模型[30],仅考虑辐射散热而不考虑气体分子对辐射的再吸收。本研究考虑CO2、H2O、CO和CH4气体的辐射,这4种组分的Planck平均吸收系数αi由文献[31]获得。则辐射热损失q˙r可表示为:
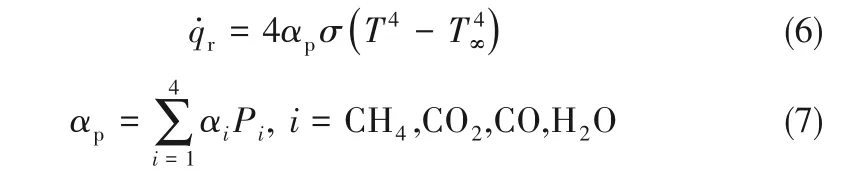
式中,σ为Stefan-Boltzmann常数;T∞为环境温度;αp为气体的Planck平均吸收系数。
1.3 数值方法及边界条件
采用有限差分法对控制方程进行离散。控制方程中的扩散项采用截断误差为二阶的中心差分进行离散。为了更好地收敛,对流项采用迎风差分离散。对冲火焰利用Chemkin的TWOPNT进行稳态求解,采用非均匀网格,同时通过设置网格的Gradient和Curvature这两个参数来改善网格。本模拟采用Mittal等[32]提出的详细化学反应机理及热动力学和传输性质,该反应机理由113种组分和710步化学反应组成。建立沿轴向的坐标系:燃料出口位置为坐标原点x=0,两个喷嘴之间的距离为L,氧化剂出口位置的坐标为x=L。燃料侧和氧化剂侧的边界条件分别为:
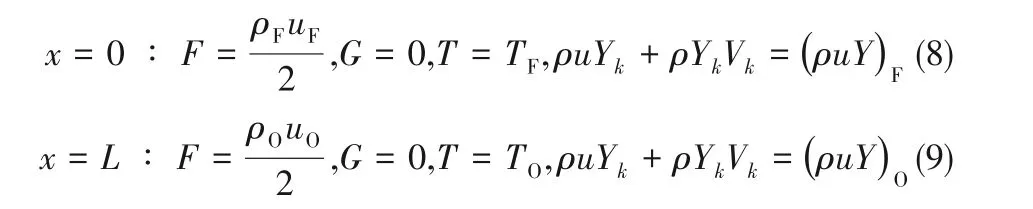
式中,下角标F代表燃料侧,O代表氧化剂侧。
1.4 数值模拟燃烧工况
对冲扩散火焰全局应变率a与火焰轴向速度梯度有关,由两个喷嘴的出口速度及加权密度组成。本研究采用氧化剂侧的应变率来表示全局应变率a,其计算公式为:
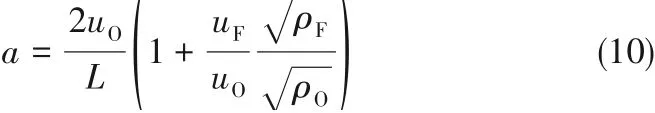
式中,a为应变率,s-1;L为两喷嘴间的距离,cm;uF、uO分别为燃料侧、氧化剂侧速度,cm·s-1;ρF、ρO分别为燃料侧、氧化剂侧密度,kg·m-3。
为了提高对冲扩散火焰的稳定性,两喷嘴出口参数满足动量平衡方程:

燃料侧用乙醇的摩尔分数XF表示乙醇浓度,氧化剂侧保持空气(21%O2/79%N2)组成不变。数值计算的工况如表1所示。
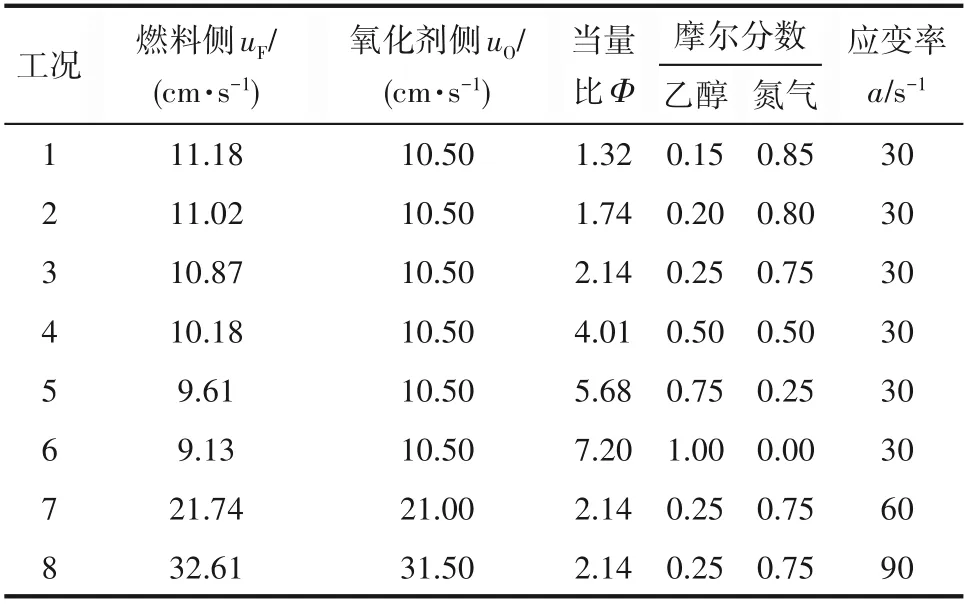
表1 模拟工况(T F=360 K,T O=298 K,P=0.1 MPa)Table 1 Simulation conditions(T F=360 K,T O=298 K,P=0.1 MPa)
2 模型验证
仿真中为了实现纯气相燃烧,将燃料出口温度设计置为360 K,课题组前期工作[22]条件一致。实验的对冲燃烧器两喷嘴之间的距离为1.4 cm,干空气出口温度298 K。用当量比为0.6~1.2、乙醇流量为13 ml·h-1、载气流量为0.8 L·min-1的实验结果来验证模拟结果。实验中,先对整个火焰面进行了不同位置的测量,发现火焰中心位置凸起点的火焰锋面温度最高,所以选取火焰凸起点锋面位置进行温度测量。对该位置的温度测量了5组数据,取平均值作为火焰温度。同时考虑热电偶的辐射误差[33],对火焰温度测量值进行辐射散热修正,取发射率为0.15,Nusselt数为2.0,结果如图2所示。图2中实验值和模拟值均为最高气体温度。由图2可知,火焰温度(模拟值)随当量比的变化趋势,与气相燃烧的火焰温度随当量比的变化趋势(火焰温度随当量比的增加先增大后减小)一致。当量比小于1时,火焰温度峰值的模拟结果与实验结果的相对误差均在10%以内,且温度随当量比变化不敏感,与数值模拟结果一致;但当量比大于1时,相对误差在15%左右,误差较大,是由于当量比增加,空气流量减小,火焰面下移,乙醇液滴周围的温度下降,乙醇蒸发速率降低,同时当量比大于1,乙醇不完全燃烧,两者共同作用使得该条件下不完全是气相燃烧,从而使得误差较大。
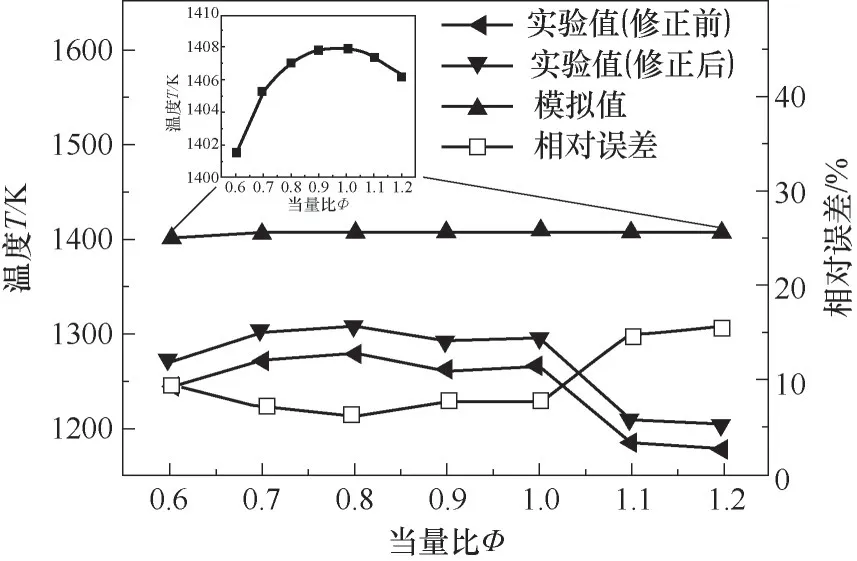
图2 火焰温度的实验与仿真对比Fig.2 The comparison between experimental and simulated results of flame temperature
3 结果与分析
3.1 火焰结构
3.1.1 乙醇浓度对火焰结构的影响 图3和图4分别为在XF=0.25和XF=0.75条件下,扩散火焰的温度、热释放率、组分摩尔分数分布(a=30 s-1),分别对应表1中工况3和5。由图3和图4可知,热释放率(HRR)(1 erg=10-7J)随着距离x的增加,依次表现出吸热和放热的特性,将吸热峰值点标记为A,放热的峰值点依次标记为B和C,滞止面标记为SP。在xA截面附近,C2H5OH摩尔分数快速降低且接近零,主要发生分解反应(吸热反应),分解的中间产物主要为H2、CH4、C2H4和C2H2,且伴随着产物CO和CO2的生成;在xB截面上,主要中间产物(CH4、C2H2、C2H4)基本反应完全,且热释放率峰值与自由基CH峰值在同一位置;在xC截面上,自由基H与OH及O2参与反应放热,且此处热释放率峰值与自由基OH峰值在同一位置。对比图3和图4可知,随XF的增加,热释放率与自由基的相对位置不变,但xSP(滞止面位置)向燃料侧移动,H2、CH4、C2H4、C2H2(中间产物)和
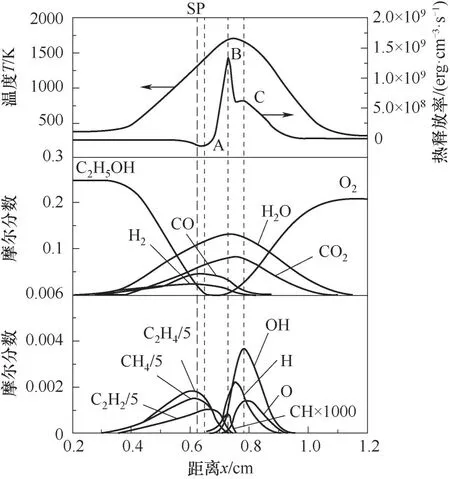
图3 扩散火焰的温度、热释放率和组分的分布(X F=0.25,a=30 s-1)Fig.3 The distributions of temperature,heat release rate and component of diffusion flame(X F=0.25,a=30 s-1)
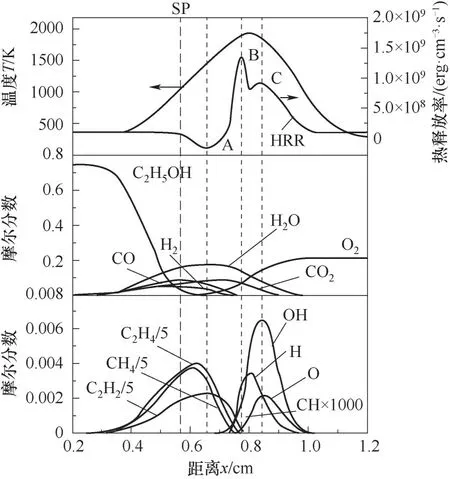
图4 扩散火焰的温度、热释放率和组分的分布(X F=0.75,a=30 s-1)Fig.4 The distributions of temperature,heat release rate and component of diffusion flame(X F=0.75,a=30 s-1)
H2O、CO、CO2(生成物)最大摩尔分数分别升高了110%、167%、103%、138%和31.5%、91.7%、44.3%,自由基CH、O、OH、H最大摩尔分数分别升高了72.7%、51.4%、77.9%、60%。同时CH4摩尔分数由低于C2H4到超过C2H4,CO2和H2O峰值位置由介于xB和xC之间变为介于xA和xB之间,CO和H2反应完全位置由最高热释放率之后变为最高热释放率之前,表明乙醇分解为CH4的比例增加及乙醇不完全燃烧的产物CO和H2的氧化反应位置向燃料侧移动。
3.1.2 应变率对火焰结构的影响 图5所示为贫燃(XF=0.25)条件下,扩散火焰的温度、热释放率、组分摩尔分数的分布(a=90 s-1),分别对应表1中工况3和工况8。图3和图5反映应变率对火焰结构的影响。随着应变率的增加,热释放率与自由基的相对位置不变,但xSP向氧化剂侧移动,xB和xC向燃料侧移动,温度、热释放率、组分摩尔分数分布的变化范围均变窄,自由基CH、O、OH、H及产物CO最大摩尔分数分别升高了47%、35%、1.7%、2%及3.8%,而H2、CH4、C2H4、C2H2、H2O和CO2最大摩尔分数则分别降低了3%、22%、14.4%、15.9%、3%和5.7%。以上结果表明,随着应变率的增加,更多的中间产物参与反应生成CO以及自由基浓度的升高,使得热释放率显著增加,与同一条热释放率曲线的两个峰值(B、C)分别依次增加了136%和88%的现象一致;同时火焰峰值温度下降了34.9 K,由表1可知,a=90 s-1的喷嘴出口速度为a=30 s-1喷嘴出口速度的3倍,使得中间产物的停留时间减小同时带走大量的热量,因此出现热释放率显著提升,而温度轻微下降的现象。
3.2 火焰温度分布
3.2.1 乙醇浓度对火焰温度分布的影响 图6(a)为乙醇浓度对火焰温度分布的影响(a=30 s-1),图6(b)为乙醇浓度对温度、热释放率峰值位置和热释放率峰值大小的影响(a=30 s-1),分析了XF为0.15、0.20、0.25、0.50、0.75、1.00共6种情形,分别对应表1中工况1~6。由图6(a)可知,将火焰温度峰值标记为D点,随着XF的增加,火焰区域变宽,火焰温度峰值升高,xD(温度峰值的位置)向氧化剂侧移动。乙醇流量可由ρFuFXF=ρ0u20XF/uF表示,由表1可知,在应变率a=30 s-1时,随着XF的增加,燃料侧ρF增加,而氧化剂侧uO和ρO不变,从式(8)、式(9)分析得到,燃料侧uF的减小,则乙醇流量增加,火焰温度逐渐升高。由图6(b)可知,xD始终在xB和xC之间靠近xB,而xB和xC随着XF增加而增大,且两者差值逐渐增大,表明热释放率的影响区域增加,因此,xD向氧化剂侧移动且火焰区域变宽。同时B点和C点热释放率的峰值随着XF的增加,HRRB先增加后减小,HRRC逐渐增加,两者差值逐渐减小,表明C点热释放率对温度的影响增加,与xD向xC靠近的现象一致。当XF=0.15时,火焰峰值温度为1571.5 K,当XF以0.05为间距变化到0.25时,峰值温度增加值分别为89.0 K和58.7 K;当XF以0.25为间距从0.25变化到1.00时,峰值温度增加值分别为139.5、56.7和33.1 K,表明随着XF的增加,火焰温度峰值变化逐渐趋于平缓,这是由于该条件下为贫氧燃烧,虽然乙醇流量增加,燃烧放热增加,但不完全燃烧损失增加的比例更多,从而使得火焰温度峰值变化趋势平缓。
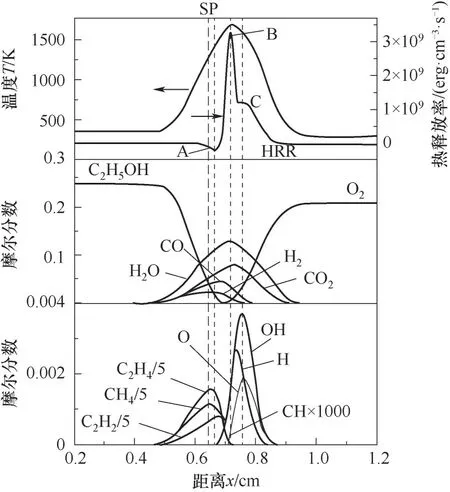
图5 扩散火焰的温度、热释放率和组分的分布(X F=0.25,a=90 s-1)Fig.5 The distributions of temperature,heat release rate and component of diffusion flame(X F=0.25,a=90 s-1)

图6 乙醇浓度对温度分布和热释放率的影响(a=30 s-1)Fig.6 The influence of ethanol concentration on temperature distribution and heat release rate(a=30 s-1)
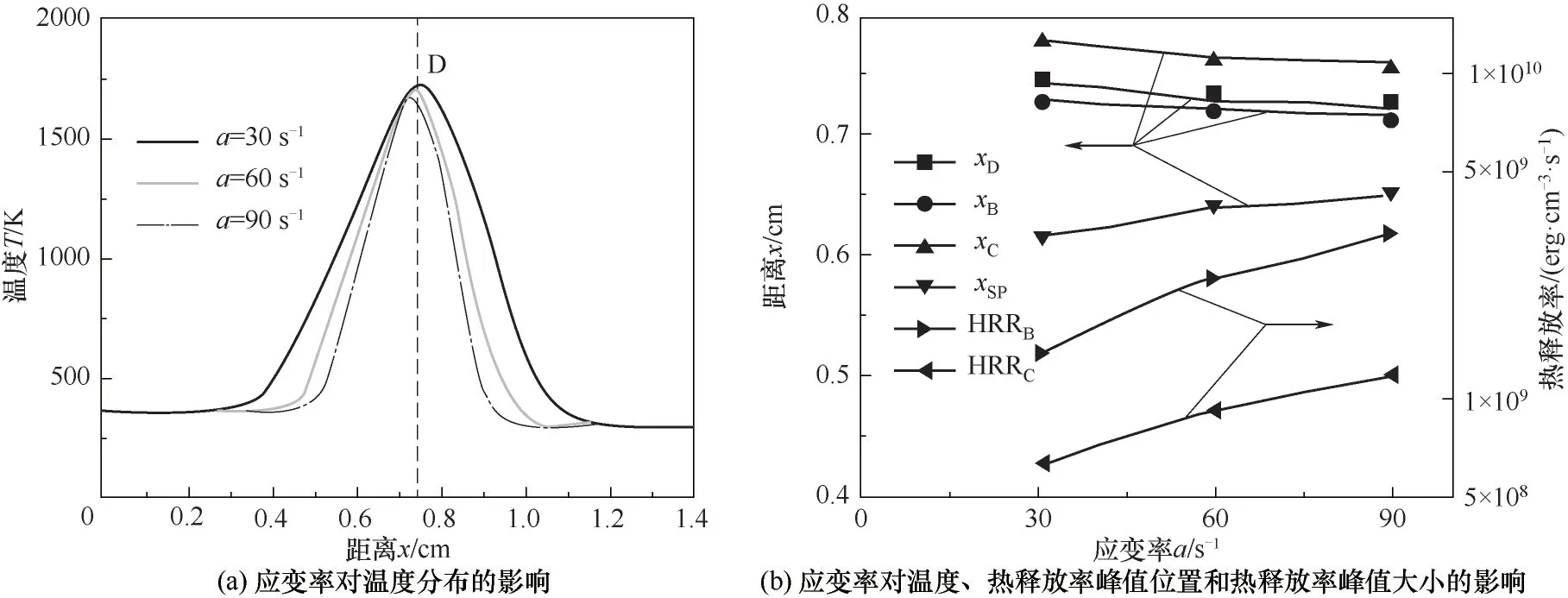
图7 应变率对温度分布和热释放率的影响(X F=0.25)Fig.7 The influence of strain rate on temperature distribution and heat release rate(X F=0.25)
3.2.2 应变率对火焰温度分布的影响 图7(a)为应变率对火焰温度分布的影响(XF=0.25),图7(b)为应变率对温度、热释放率峰值位置和热释放率峰值大小的影响(XF=0.25),分析了应变率为30、60、90 s-1的情形,分别对应表1中工况3、工况7和工况8。由图7(a)可知,随着应变率a的增加,火焰区域变窄,并且火焰温度峰值轻微降低,应变率为30 s-1时,火焰温度峰值为1719.2 K,应变率以30 s-1为间距变化到90 s-1,火焰温度峰值分别降低了18.0 K和16.9 K。由图7(b)可知,随着应变率的增加,xSP向氧化剂侧移动,这是因为uF大于uO,且随a的增大,两喷嘴出口速度差值增大。火焰温度峰值位置xD始终在xB和xC之间靠近xB,随着a的增加,xB和xC均减小,且xB和xC之间的距离减小,表明热释放率影响区域减小,因而xD向燃料侧移动且火焰变化区域变窄;同时HRRB和HRRC均随着应变率的增加而明显增大,但两点的热释放率峰值差值逐渐增大,表明B点热释放率对温度的影响更大,与图中xD更加靠近xC的现象一致。由以上分析可知,随着a的增加,热释放率显著增加,但是火焰温度峰值却表现出降低的现象,这是由于随着a的增加,自由基摩尔分数增加,使得热释放率增加明显,同时两喷嘴的出口速度均呈比例增大,燃烧的产物(包含中间产物)在燃烧区域的停留时间变短,增加的气体同时带走了大量的热量,从而出现热释放率显著增加而温度轻微降低的现象。
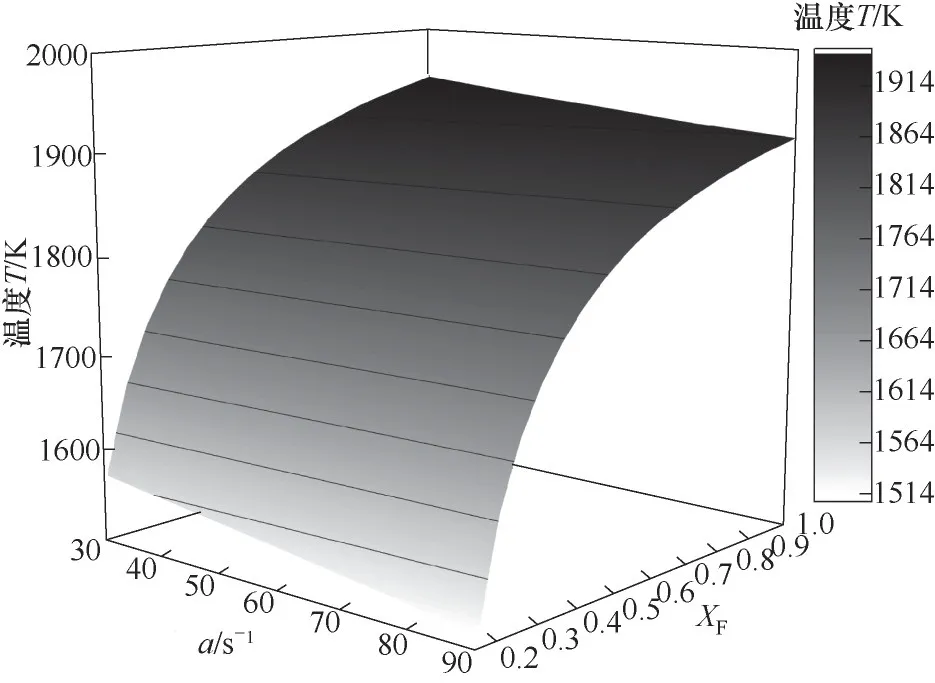
图8 乙醇浓度和应变率对火焰温度峰值的共同影响Fig.8 The effects of ethanol concentration and strain rateon the peak flame temperature
图8为乙醇浓度和应变率对火焰温度峰值的共同影响,从图中可以看出,当a不变时,随着XF的增加,火焰温度峰值逐渐升高,且温度变化趋势逐渐平缓。当XF不变时,随着应变率a的增加,火焰温度逐渐降低,且降低的趋势减小。以上结果表明在该研究范围内,相较于应变率,温度对乙醇浓度更为敏感。

图9 温度峰值点处的乙醇浓度对温度敏感系数的影响(a=30 s-1)Fig.9 The influence of ethanol concentration on the temperature sensitivity coefficient at the peak temperature point(a=30 s-1)
3.3 温度敏感性分析
3.3.1 乙醇浓度对温度敏感系数的影响 温度敏感性系数是反映基元反应对火焰温度发展进程的一个指标,温度敏感性系数绝对值越大对温度的影响越明显。温度敏感性系数若为正,表示该基元反应对温度的提升是促进作用,与之相反,温度敏感性系数若为负,表示该基元反应对温度的提升是阻碍作用。通过对温度敏感性系数的分析,为火焰温度的调控提供理论指导。图9为在温度峰值点处,乙醇浓度对温度敏感系数的影响(a=30 s-1),由图可知,XF分别为0.25、0.50、0.75时,对温度敏感的主要反应均与自由基OH和H相关,由反应R8:H+OH+


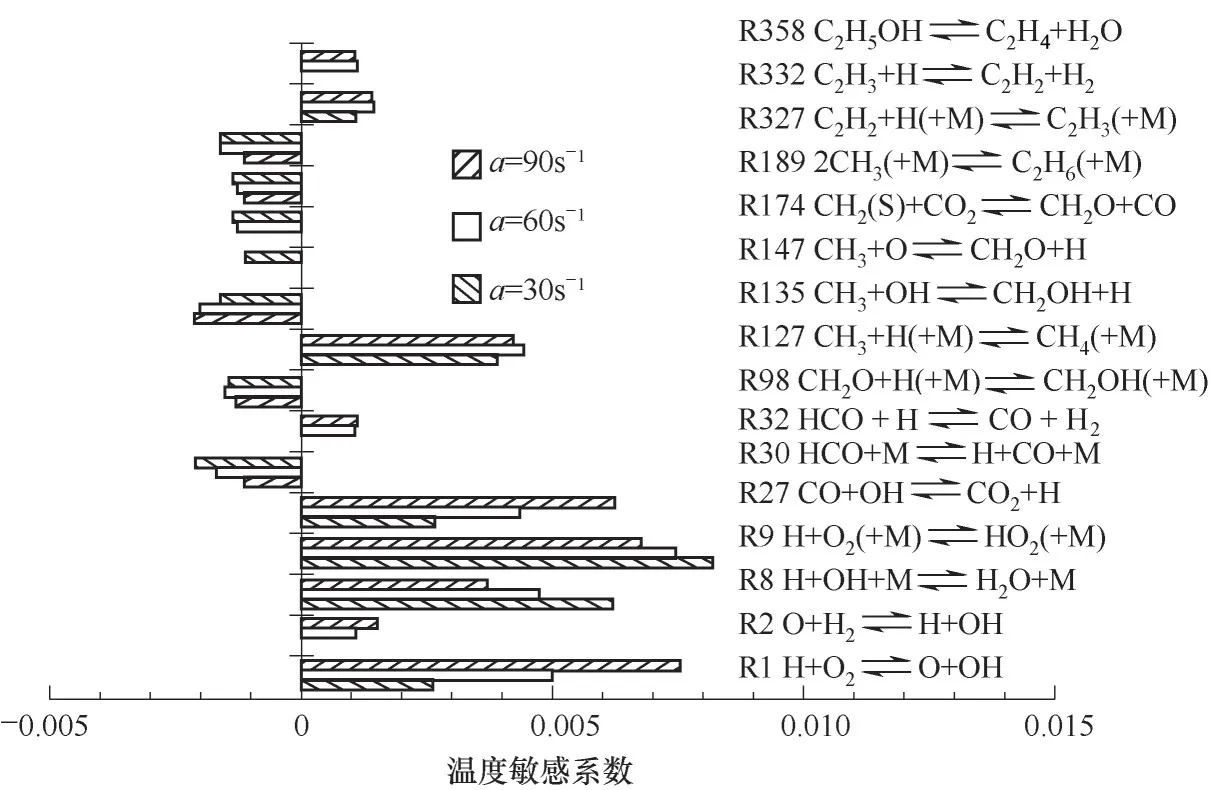
图10 温度峰值点处的应变率对温度敏感系数的影响(X F=0.25)Fig.10 The influence of strain rate on temperature sensitivity coefficient at the temperature peak point(X F=0.25)

4结 论
本文采用对冲扩散火焰模型和光学薄辐射模型,并耦合由113种组分和710步化学反应组成的乙醇详细化学反应机理,对空气与氮气稀释的乙醇对冲扩散火焰的燃烧特性进行模拟,研究了乙醇浓度和应变率对扩散火焰特性的影响。分析了火焰结构、温度分布和温度敏感系数随乙醇浓度、应变率的变化情况,主要结论如下。
(1)随着乙醇浓度的增加,乙醇的流量增加,更多的乙醇分解使得中间产物和自由基浓度增加,使得反应加剧,火焰温度峰值逐渐升高,并导致火焰温度峰值位置向氧化剂侧移动,火焰区域变宽,温度变化趋势逐渐平缓。
(2)随着应变率的增加,喷嘴出口速度增加,组分的分布范围变窄,自由基和CO增多,中间产物减少,热释放率峰值显著增加,火焰温度峰值位置向燃料侧移动,火焰区域变窄,但在反应物停留时间短和增加的气体带走热量的共同作用下,使得火焰温度峰值逐渐降低,且温度降低的趋势小。

符号说明
a——应变率,s-1
cp,cpk——分别为常压下混合物、第k种气体的比热容,J·kg-1·K-1
Dkm,DkT——分别为混合物平均扩散系数、热扩散系数
hk——第k种组分的比焓,J·kg-1
HRR——热释放率,erg·cm-3·s-1
L——两喷嘴间的距离,cm
P——压力,MPa
q˙r——辐射热损失
T,TF,TO,T∞——分别为温度、燃料侧温度、氧化剂侧温度、环境温度,K
uF,uO——分别为燃料侧速度、氧化剂侧速度,cm·s-1
Vk——第k种组分的扩散速度
Wk——第k种组分的分子量
XF——乙醇浓度(摩尔分数)
Xk——第k种气体的摩尔分数
x——距离燃料出口的距离,cm
Yk——第k种组分的质量分数
μ——混合物黏度,Pa·s
ρ,ρF,ρO——分别为混合密度、燃料侧密度、氧化剂侧密度,kg·m-3
σ——Stefan-Boltzmann常数
w˙k——第k种组分的单位体积摩尔生成速率,mol·m-3·s-1
下角标
F——燃料
O——氧化剂
SP——滞止面
