钾素对马铃薯组培苗生长及生理生化特性的影响
2021-06-01张茹艳张卫娜康益晨范艳玲杨昕宇余慧芳王勇刘玉汇张俊莲秦舒浩
张茹艳,张卫娜,康益晨,范艳玲,杨昕宇,余慧芳,王勇,刘玉汇,张俊莲,,秦舒浩
(1.甘肃农业大学园艺学院,甘肃 兰州 730070;2.甘肃农业大学作物遗传改良与种质创新重点实验室,甘肃 兰州 730070)
钾是植物生长发育必需的大量元素之一,与氮、磷并列为植物营养的“三大要素”,在作物的生长发育和代谢过程中发挥着重要作用[1].钾作为生物体内许多酶的活化剂,参与了植物体内诸多代谢过程,如碳水化合物、脂肪和蛋白质的合成等[2].马铃薯(Solanumtuberosum)是我国广泛种植的粮菜兼用型作物[3].马铃薯对钾的需求量很高,作为一种典型的嗜钾作物,充足的钾源是保证马铃薯正常生长的重要条件.马铃薯生产栽培中,合理施用钾肥能够增强马铃薯植株抗逆性,提高块茎产量,改善块茎品质.因此,马铃薯也被认为是钾可用性的指示作物[4-8].
已有大量的试验研究表明低钾胁迫可导致水稻[9]、马铃薯[10]、小麦[11]、大蒜[12]、棉花[13]和大豆[14]等作物植株生物量减少,植株生长缓慢,根系生长受到抑制.在马铃薯生产当中,不同施钾水平对马铃薯的农艺性状、氮磷钾素含量、干物质、产量和品质均会产生较大的影响.低钾环境中适当的增施钾肥可以促进马铃薯植株生长健壮,茎秆粗壮坚韧,增强抗旱、抗寒和抗病能力[14-15].同时,钾也是组织培养的培养基中所必需的营养元素[16].刘玉汇等[17]研究表明,60%的低钾培养环境能促进马铃薯组培苗的生长,使其生物量增多.
采用组培方式获得脱毒的健康种苗是解决病害的一个有效手段[18].目前对马铃薯研究最多的是马铃薯的脱毒、储藏和平衡施肥,而对钾素作用下马铃薯组培苗性状研究较少[19-20].为探讨钾素浓度对马铃薯组培苗生长发育能力的影响,获得适生性更强的栽培种苗,本试验利用组织培养技术,通过设置不同的钾素浓度,筛选最适合青薯9号组培苗生长发育的钾素浓度,研究钾素对马铃薯组培苗生长及生理生化特性的影响,以期为马铃薯生产和大量扩繁组培苗提供理论依据.
1 材料与方法
1.1 试验材料
1.1.1 供试品种 供试品种:马铃薯品种青薯9号,由甘肃省定西市农业科学研究院提供.
1.1.2 试验培养基 以MS培养基+30 g/L蔗糖为基础液体培养基,将配好的培养基分装到200 mL组培玻璃瓶中,每瓶装50 mL,培养基分装后置于121 ℃高压锅中灭菌30 min备用.
1.2 材料培养与试验设计
本试验于2018年9月~2019年6月在甘肃农业大学蔬菜栽培与生物学实验室进行,2018年10月开始扩繁,挑选生长一致的‘青薯9号’马铃薯组培苗,在无菌操作台上剪取至少带有一个叶原基的生长点(约0.2~0.5 mm),迅速接入灭菌后的基础培养瓶中,每瓶转接4株.置于光照培养箱培养,设置25 ℃、4000 lx 光照度、湿度70%~90%、光照16 h/d的条件下培养25 d.后期在无菌操作台对组培苗进行不同浓度外源钾素的处理,吸取不同浓度硫酸钾溶液分别沿培养瓶瓶壁加入到培养瓶中.试验共设置5组处理,钾素浓度梯度依次为K1(10 mmol/L)、K2(20 mmol/L)、K3(40 mmol/L)、K4(80 mmol/L)、K5(100 mmol/L),选取不加硫酸钾处理的组培苗为对照(K0).每个处理重复45瓶,处理10 d后进行各项指标测定,测定期间需不断接种补苗以保持组培苗的最佳测定时期.
1.3 测定项目与方法
生长指标测定:株高以植株茎最高部位距MS培养基的高度为准,用直尺测量取平均值;新叶数和根数计算其平均值;称量鲜质量时将地上与地下部分冲洗干净后用电子天平称量并取其平均值.
抗逆生理指标测定:脯氨酸(Pro)含量采用酸性茚三酮法测定[21];丙二醛(MDA)含量采用硫代巴比妥酸(TBA)法测定[21];过氧化物酶(POD)活性采用愈创木酚法测定[21];过氧化氢酶(CAT)活性采用紫外吸收法测定[22];超氧化物歧化酶(SOD)活性采用NBT光化还原法测定[22];叶绿素含量的测定采用分光光度计法测定[23];电导率的测定采用电导仪测定电导率测定[24].植株钾素含量的测定:用火焰分光光度法测定[25].
1.4 数据分析
采用Microsoft Excel 2010和SPSS 25.0进行原始数据统计、方差分析和作图;LSD法进行差异显著性分析(α=0.05).
2 结果与分析
2.1 钾素对马铃薯组培苗生长特性的影响
不同钾素浓度处理下的马铃薯组培苗各生长指标及状况见表1和图1.K1、K2和K3处理下的组培苗植株株高、新叶数、根数、地上鲜质量、地下鲜质量与对照相比均有不同程度的增加,K4和K5处理下的马铃薯组培苗长势均比对照差.其中K3处理下植株株高增长了119.88%,新叶数和根数分别增加了52.72%和33.33%,地上部与地下部鲜质量分别增加了49.45%和37.57%.与其他处理相比,K3处理下植株生长健壮,各项指标均达到最高且差异显著(P<0.05).
2.2 钾素对马铃薯组培苗叶绿素含量的影响
由图2可知,在钾素处理10 d后,马铃薯组培苗叶片叶绿素含量随钾素浓度的增大呈先增高后降低的整体趋势;与对照相比,K1与K4处理下无显著性差异;K5处理的马铃薯组培苗叶绿素含量与对照相比,降低了47.29%;K2和K3处理的马铃薯组培苗叶绿素含量分别比对照增加了19.38%和63.82%.其中K3处理下马铃薯组培苗叶绿素含量最高,与对照和其他处理间差异显著(P<0.05).

表1 不同钾素浓度对马铃薯组培苗生长指标的影响
2.3 钾素对马铃薯组培苗抗氧化酶活性和MDA含量的影响
马铃薯组培苗叶片中抗氧化酶活性(SOD、CAT和POD)的变化如图3-A~C所示.SOD、CAT、POD活性变化均呈先增高后降低的趋势,且在K3处理下3种抗氧化酶活性均达到最高,分别高达14.80、4.227和48.003 U/g,与对照相比分别增加了15.3%、70.87%和14.99%,差异性显著(P<0.05).马铃薯组培苗叶片MDA含量呈(以鲜质量计)先降低后升高的变化趋势.如图(3-D)所示,K1、K2和K4钾素浓度处理下,MDA含量与对照相比无显著差异,K5处理下马铃薯组培苗叶片MDA含量比对照增高了26.63%,显著高于对照(P<0.05).K3处理下马铃薯组培苗叶片MDA含量比对照降低了53.57%,差异显著(P<0.05).
2.4 钾素对马铃薯组培苗脯氨酸含量和电导率的影响
如图4所示,马铃薯组培苗叶片脯氨酸含量及相对电导率随钾素浓度增大均呈先降低后增加的变化趋势.从图4-A可知,K1处理下脯氨酸含量与对照无显著性差异;从K2、K3处理下马铃薯组培苗脯氨酸含量显著低于对照(P<0.05),K4和K5处理分别比对照高20.31%和49.48%,与对照相比差异显著(P<0.05);从图(4-B)可知,K1、K2处理的马铃薯组培苗叶片相对电导率与对照无显著差异;K4和K5处理的叶片电导率分别比对照高11.02%和13.63%,与对照差异显著(P<0.05).K3处理下马铃薯组培苗叶片脯氨酸含量和电导率分别比对照降低了58.32%和13.6%,均显著低于对照和其他各处理(P<0.05).

图1 不同浓度钾素处理下马铃薯组培苗生长状况图Figure 1 Growth status of potato tissue cultured seedlings treated with different concentrations of potassium
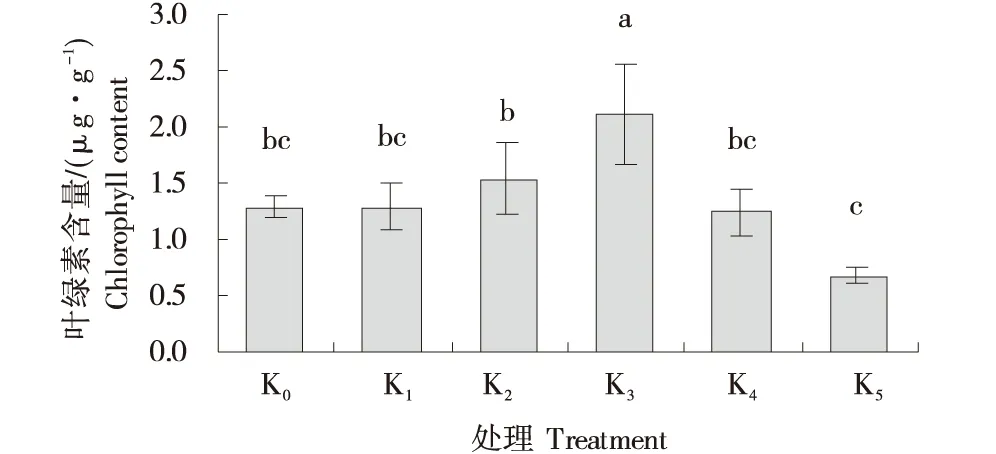
不同字母表示差异显著(P<0.05).Different letters indicate significant differences(P<0.05).图2 不同浓度钾素处理对马铃薯组培苗叶绿素含量的影响Figure 2 Effects of different potassium concentrations on chlorophyll content of potato tissue cultured seedlings
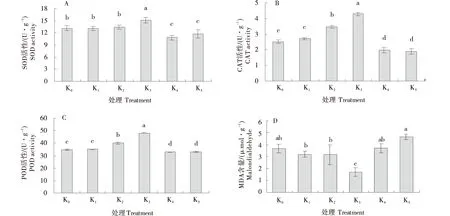
不同字母表示差异显著(P<0.05).Different letters indicate significant differences(P<0.05).图3 不同钾素处理对马铃薯组培苗对马铃薯组培苗抗氧化酶活性和MDA含量的影响Figure 3 Effects of different potassium treatments on antioxidant enzyme activity and MDA content of potato tissue cultured seedlings
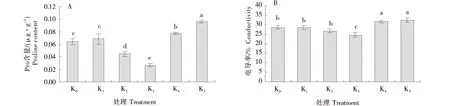
不同字母表示差异显著(P<0.05).Different letters indicate significant differences(P<0.05).图4 不同浓度钾素处理对马铃薯组培苗渗透调节物质(Pro)含量和电导率的影响Figure 4 Effects of different concentrations of potassium on Pro content and electrical conductivity of potato tissue cultured seedlings
2.5 钾素对马铃薯组培苗植株钾含量的影响
如图5所示,在钾素处理10 d后,马铃薯组培苗植株钾含量随着钾素浓度增大呈现出先大幅度增大后小幅度降低的整体趋势.与对照相比,K1、K2、K3、K4和K5处理的马铃薯组培苗植株钾含量分别比对照增加了66.79%、222.33%、291.49%、264.78%和207.85%,均与对照差异显著(P<0.05),其中K3处理下的马铃薯组培苗钾素含量最高,与对照和其他处理差异显著.

不同字母表示差异显著(P<0.05).Different letters indicate significant differences(P<0.05).图5 不同浓度硫酸钾处理对马铃薯组培苗钾含量的影响Figure 5 Effects of different concentrations of potassium sulfate on the potassium content of potato tissue seedlings
3 讨论
本研究中,适宜的钾素浓度可促进青薯9号马铃薯组培苗的生长发育,对植株株高、新叶发生能力和根的生长以及地上地下部的增重均具有促进作用.同时,马铃薯组培苗的叶绿素含量达到最高水平,植株发育最好,但钾素含量过高时,会抑制根数以及地上地下部的增长,不利于植株的生长,叶绿素的合成受阻,光合作用下降,有机物合成下降.
有研究表明,不同施钾条件下,对马铃薯的株高、茎粗、主茎数等衡量其长势的重要形态指标的影响效果不尽相同.缺钾时马铃薯植株发育迟缓、植株矮小、根系不发达、叶片变小且早衰、光合作用差、块茎小、品质差产量低[26-27].钾营养充足时马铃薯植株生长健壮、保水能力强、抗病力强、茎杆增粗、抗倒伏能力强,钾的合理施用可以提高植株高度和作物活力,增强抗旱、抗冻和抗病能力,能够在生长初期增加叶片扩张并延长叶片持续时间,块茎成熟后期可延迟叶片脱落,能显著改善马铃薯的品质.在一定范围内,钾肥施用量越多马铃薯产量和商品率越高,经济效益越好.但当钾肥施用量增加到一定限度后,随钾肥用量增加,马铃薯的产量反而下降.高浓度的钾不仅不利于马铃薯增产,还会降低淀粉含量和单株淀粉产量,不利于薯块形成[27-29].
抗氧化酶是植物自身保护酶系统的重要构成成分,SOD、POD、CAT等作为植物活性氧清除系统中重要的酶,在植物体内起着清除自由基、保护植物器官、延缓叶片早衰的作用,它们的活性能够反映细胞内活性氧与其清除系统之间的平衡状态[30].MDA含量是反映植物受胁迫时细胞膜脂过氧化损伤程度的指标,作为考察细胞受到胁迫严重程度的指标,MDA含量的高低反应着植物受损伤程度的大小,进而判断植物生长环境条件是否适宜.有研究表明钾素浓度过低和过高都会使马铃薯幼苗的抗氧化酶活性增强,丙二醛含量增大.适宜的钾素利于马铃薯叶片活性增增强,延缓叶片衰老[31].
脯氨酸是植物体内主要的渗透调节物质,可以清除活性氧,提高抗氧化能力,稳定生物大分子结构等[32],细胞提取液电导率能够反应植物细胞质膜透性.有研究结果表明,马铃薯幼苗游离脯氨酸含量在钾素浓度过低和过高时都会增加,施钾能够降低细胞膜透性,保持叶片细胞膜的完整[33],使叶片的相对电导率和降低.这些结果均与本研究适量的钾素用量有利于保护细胞膜透性的结果一致.适宜的钾肥用量可以更好地促进马铃薯对钾营养的吸收[34].在没有钾素处理的情况下,马铃薯组培苗的钾含量非常低,其体内的钾来自于培养基,其他马铃薯组培苗植株钾含量都随培养基中钾素浓度增加而上升,不同钾素浓度对植株钾的吸收累积有显著差异,在高钾水平下生物量已经产生负面效应.由于植物对钾的吸收存在奢侈吸收[34-35],环境中的钾浓度越高,植物吸收的就越多.
综上所述,适宜的钾素浓度在青薯9号组培苗的生长发育过程中发挥着重要的作用,但是,钾素的用量是有一定限制的,当浓度超过一定的值时,会对植株造成伤害,继而抑制马铃薯生长.本研究中,40 mmol/L的钾素浓度最适合青薯9号组培苗的生长.关于钾素浓度对马铃薯产量及品质的影响还需继续进一步探究.
