粗饲料颗粒替代玉米青贮对肉牛瘤胃发酵及微生物菌群的影响
2021-06-01祁有鹏左志石斌刚董巧霞张雪萍赵芳芳赵世杰李少斌权金鹏甘辉林胡江
祁有鹏,左志,石斌刚,董巧霞,张雪萍,赵芳芳,赵世杰,李少斌,权金鹏,甘辉林,胡江
(1.甘肃农业大学动物科学技术学院,甘肃省草食动物生物技术重点实验室,甘肃 兰州 730070;2.张掖市草原工作站,甘肃 张掖 734000)
农作物秸秆是草食动物重要的粗饲料资源.我国农作物秸秆资源丰富,据估计秸秆理论收集量10.4亿t,实际可收集量8.26亿t,玉米、水稻和小麦3类秸秆占总量的79.19%[1].秸秆粗纤维含量高、质地粗硬、适口性差,且不易长途运输等因素影响了饲料化利用[2].为提高秸秆资源的利用率,充分发掘其饲用潜力,很多学者开展了不同研究,如青贮[3]、混贮[4]、氨化[5]、颗粒化[6]等.颗粒化是秸秆等粗饲料的重要处理方式之一.秸秆制成颗粒,其密度较玉米秸秆增加10倍,体积减小而容重增加,便于长途运输和储藏[7-8];秸秆制粒后适口性也有所改善,可提高动物的采食量和利用率[9].
秸秆等粗饲料是饲喂反刍动物的重要饲料资源.反刍动物瘤胃中多种微生物相互协作,将摄入的饲料营养物质分解为挥发性脂肪酸(VFA)、氨基酸、肽链和NH3-N,并成为体内代谢和合成过程的重要前体物质及调节物质,为动物生长、生产提供能量和营养,同时影响瘤胃中其他微生物活动[10-11].粗饲料类型及物理状态是影响瘤胃发酵和微生物菌群的重要因素[12].许多研究表明,反刍动物瘤胃pH、NH3-N浓度、VFA含量及组成等受粗饲料物理形态影响,也受采食量、饲料组成、营养成分消化率、微生物利用率和瘤胃排出速度等因素共同作用[13].如结构粗糙的饲料,动物采食、咀嚼及反刍时间延长,唾液增多以加强对瘤胃缓冲,进而影响瘤胃发酵[14].瘤胃微生物区系随反刍动物品种、年龄、生理、饲养管理条件及日粮组成等改变而发生动态变化,其中粗饲料物理形态和组成影响瘤胃微生物种类.Yang等[15]报道,饲料颗粒大小影响其在瘤胃内消化、外流速度,进而影响微生物蛋白合成及其在肠道消化;杨宏波等[16]研究表明,高精料全价颗粒饲料可抑制奶公犊牛瘤胃纤维降解菌和厌氧真菌生长;周封文[17]报道,饲喂秸秆颗粒日粮时,小尾寒羊瘤胃原虫数量减少而总细菌数量增加.因此,粗饲料种类和状态显著影响瘤胃生态环境,而瘤胃环境反作用于微生物活动,最终影响粗饲料在瘤胃中的降解速率[18-19].
秸秆的合理加工调制是提高粗饲料品质,进而改善反刍动物瘤胃环境以提高微生物对其利用效率的重要措施.目前,粗饲料颗粒对肉牛瘤胃发酵参数及微生物的影响报道很少.本试验采用玉米秸秆和苜蓿干草混合制成粗饲料颗粒,替代部分全株玉米青贮饲料育肥架子牛,评估粗饲料结构及加工方式对肉牛瘤胃发酵和菌群的影响,为秸秆资源合理利用和肉牛饲料科学配制提供参考.
1 材料与方法
1.1 试验动物与试验设计
肉牛育肥试验于2018年9月4日至2019年1月16日,在甘肃省民乐县希诺农牧业有限公司进行.选择18月龄、体质量约(424.98±19.07)kg的健康西门塔尔杂种公牛(西门塔尔牛♂×本地黄牛♀)20头,分为4组,每组5头;试验组1、2和3的粗饲料组成分别为粗饲料颗粒20%+全株青贮玉米80%、粗饲料颗粒50%+全株青贮玉米50%和粗饲料颗粒80%+全株青贮玉米20%,对照组粗饲料全部为全株青贮玉米.试验牛预饲期15 d,正饲期120 d(前期90 d,后期30 d).育肥期结束后,每组选择3头体质量接近的肉牛采集瘤胃液,测定4组瘤胃发酵参数,经表型性状筛选后,运用16S rDNA高通量测序分析试验组3和对照组的瘤胃菌群多样性.
1.2 试验日粮
粗饲料颗粒为风干玉米秸秆和苜蓿干草粉碎后,按1∶1比例混合,使用PELLET MILL环模制粒机(SZLH-420)制粒.其中秸秆原料粉碎粒度8 mm,总水分含量8%,环模孔径7 mm,颗粒长度3~4 cm.按照《肉牛饲养标准 NY/T 815-2004》[20]配制试验牛各阶段日粮,日粮组成及营养成分见表1.
1.3 饲养管理
试验肉牛编号入舍,预饲期用伊维菌素驱虫,小苏打健胃;试验期肉牛拴系饲养,人工饲喂,自由采食;每天6∶00和17∶00饲喂1次,饲喂后2 h饮水.
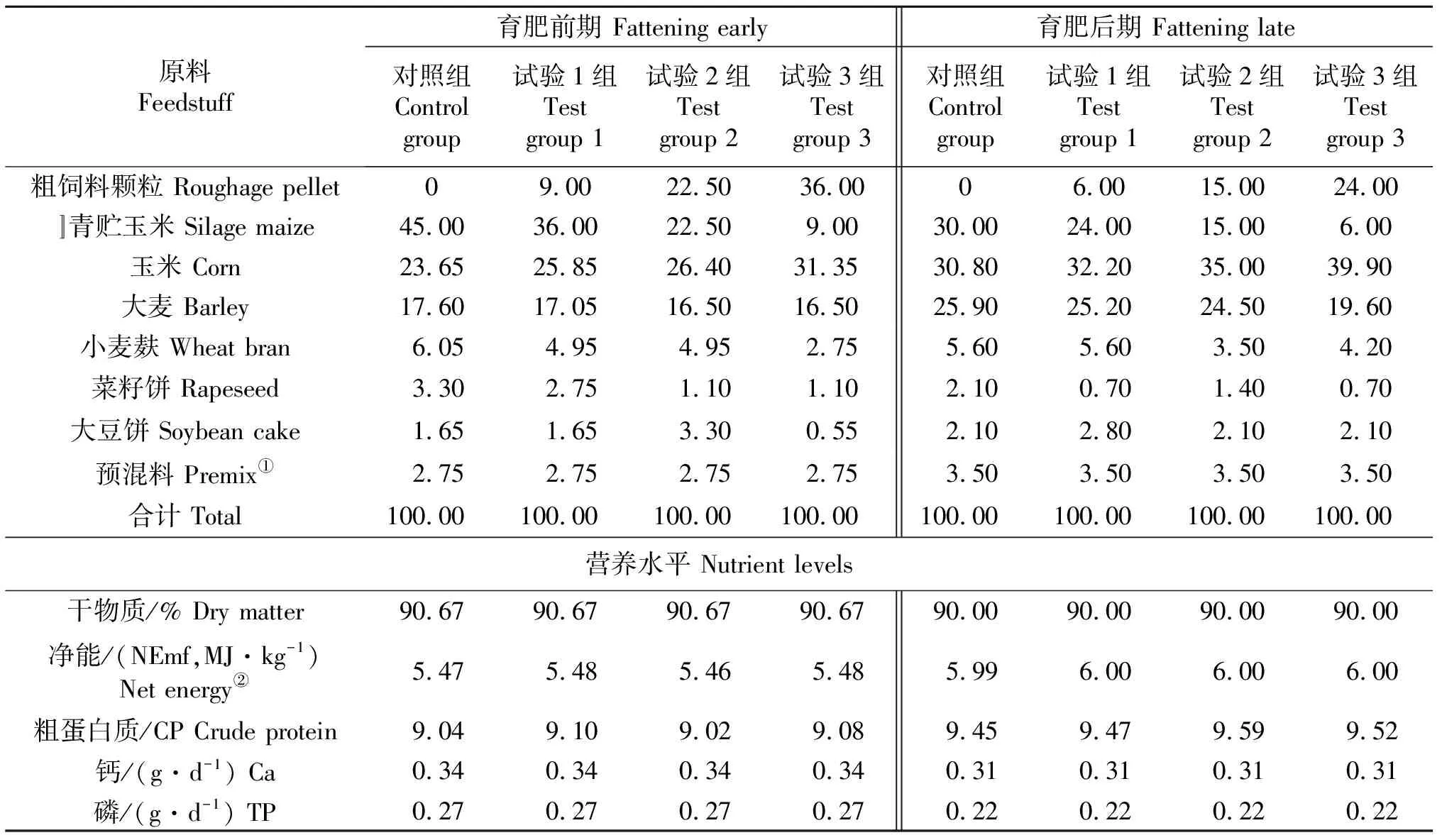
表1 试验牛日粮组成及营养水平(风干基础)
每天清扫圈舍,定期消毒.
1.4 样品采集
育肥期结束,每组选择3头体质量接近的肉牛晨饲前屠宰,迅速从腹腔取出瘤胃,立即打开瘤胃,从瘤胃不同部位取出内容物、混匀,取约200 mL瘤胃液四层纱布过滤,分装到4个50 mL离心管中,立即投入液氮中带回实验室,转移至-80℃冰箱保存,分别用于挥发性脂肪酸、氨氮浓度及微生物区系测定.
1.5 测定方法
1.5.1 NH3-N测定 NH3-N测定采用比色法[21].本试验确定的标准曲线为:
y=1.501 8x+0.021 7R2=0.992 6
式中:y为氨氮浓度(mmol/L);x为光密度读数;R2为常数.
1.5.2 瘤胃挥发性脂肪酸(VFA)测定 瘤胃液解冻后,转移至10 mL离心管中,5 400 r/min离心10 min,取1 mL上清液转移至1.5 mL离心管中,加入0.2 mL含有内标物2-乙基丁酸的25%(W/V)偏磷酸溶液混匀,冰浴30 min以沉降蛋白,10 000 r/min离心10 min,再将上清液转移至1.5 mL离心管中4℃保存待测.VFA采用安捷伦(Agilent)6890N 型气相色谱仪测定瘤胃液中VFA含量.色谱柱为HP 19091N-213毛细管柱,进样量0.6 μL.色谱条件:进样口温度220 ℃、N2流量2.0 mL/min、分流比40∶1,程序升温模式(120℃保持3 min,而后10 ℃/min升高至180℃保持1 min),色谱仪内装氢离子火焰检测器(FID),载气为高纯氮气,FID 250 ℃,FID空气、H2和N2流量分别为450、40、45 mL/min.
1.6 数据统计分析
采用SPSS 24.0的one-way ANOVA对VFA和氨氮浓度测定数据进行方差分析,用Duncan法进行多重比较;用t检验进行菌群多样性分析;利用Welch′st检验模型鉴别两比较组间差异KEGG通路.
2 结果与分析
2.1 粗饲料颗粒对育肥肉牛瘤胃发酵的影响
育肥肉牛瘤胃发酵参数测定结果见表2.粗饲料颗粒替代不同比例全株玉米青贮,对育肥肉牛瘤胃液NH3-N、乙酸、丙酸和乙酸/丙酸比值有显著影响.NH3-N浓度随粗饲料颗粒替代比例增加而下降,且对照组NH3-N浓度显著高于试验组(P<0.05);试验3组瘤胃液乙酸浓度最低且极显著低于试验1组(P<0.01),显著低于对照组和试验2组(P<0.05),丙酸浓度最高且极显著高于其他组(P<0.01),乙酸/丙酸比值最低且极显著低于试验2组(P<0.01),显著低于对照组和试验1组(P<0.05).粗饲料颗粒替代比对总挥发性脂肪酸和丁酸含量无显著影响(P>0.05).
2.2 肉牛瘤胃菌群的基因序列和多样性分析
2.2.1 肉牛瘤胃菌群DNA的PCR扩增和高通量测序 从对照组和试验组3中,每组各取3个肉牛瘤胃液样品,对瘤胃菌群16S rRNA基因V3+V4高变区进行PCR 扩增,扩增产物经1.8%浓度琼脂糖凝胶电泳检测,扩增条带清晰,无非特异性扩增条带.经Illumina HiSeq测序平台测序,2组肉牛共获得972 358 Reads对,双端Reads拼接、过滤后共产生946 944条质控后tags(clean tags),去除嵌合体产生的928 445条有效 Tags (effective tags),每个样品至少产生137 965条Clean tags,平均产生155 258条Clean tags.用 Uparse 软件对所有样品有效Tags 以97%的一致性聚类,共获得6 004个操作分类单位(OTUs),不同样本的OTUs和Tags数量见图1.
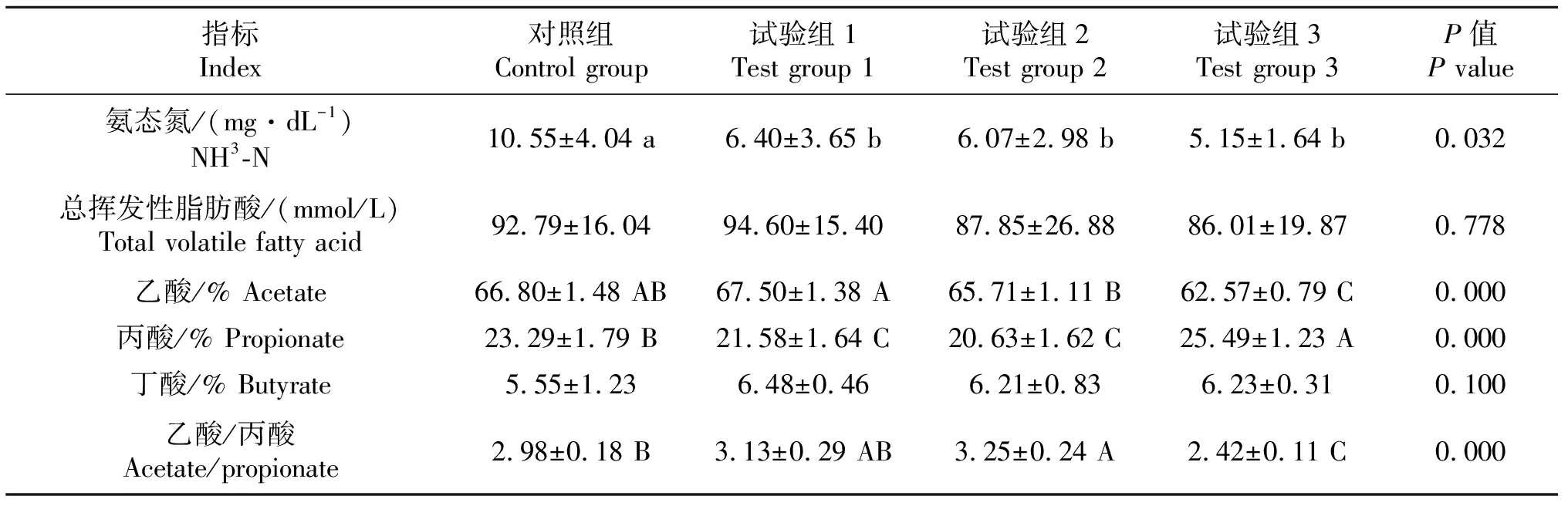
表2 粗饲料颗粒对肉牛瘤胃内环境的影响
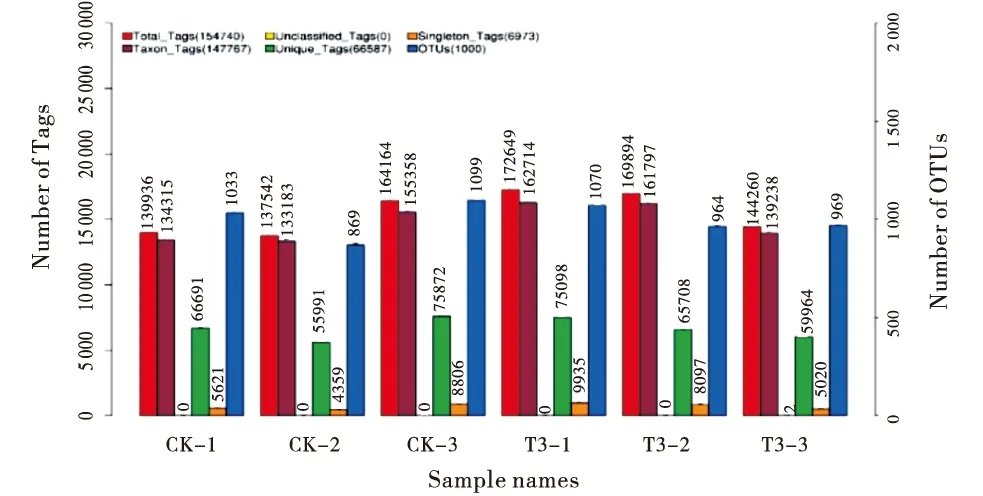
CK:对照组;T3:试验组3.CK:Control group;T3:Test group 3.图1 肉牛瘤胃菌群OTUs和Tags数量Figure 1 OTUs and tags numbers in rumen microflora of beef cattle
2.2.2 OTUs丰度及多样性分析 根据OTUs聚类分析结果,分析不同样品的聚类信息,依照其共有、特有的OTUs信息绘制韦恩图(Venn graph,图2),对照组和试验组3肉牛瘤胃共获得1 473 OTUs,2组肉牛共有OTUs为802个,对照组和试验组3肉牛瘤胃特有OTUs分别为359个和312个.
2.2.3 Alpha多样性分析 Alpha多样性反映瘤胃菌群的群落(within-community)丰富度和多样性,其中Chao1 / ACE 指数主要阐明样本的物种丰富度信息,Good’s Coverage反映样本的低丰度OTU覆盖情况,Observed species 表示能检测到的OTU种类情况,Simpson / Shannon 主要综合体现物种的丰富度和均匀度.对照组和试验组3肉牛瘤胃菌群Alpha多样性差异分析见表3,2组肉牛瘤胃菌群多样性指数Chao1、ACE、Shannon、observed_species、Simpson和Good’s Coverage均无显著性差异(P>0.05).
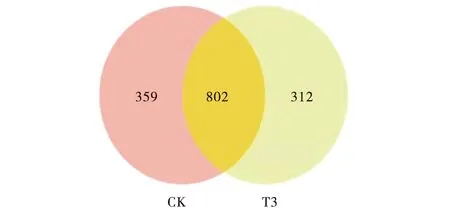
CK:对照组;T3:试验组3.CK:Control group;T3:Test group 3.图2 肉牛瘤胃菌群OTUs分布韦恩图Figure 2 Venn graphs of OTUs for microflora in rumen fluid of beef cattle
2.2.4 Beta多样性分析 对照组和试验组3肉牛瘤胃液菌群的主坐标分析(PCoA)见图3,PCo1 和PCo2 2个主成分贡献值分别为28.43%和22.23%,同组肉牛瘤胃液菌群没有明显聚集,2组肉牛瘤胃液菌群距离没有明显差异.基于bray对群落结构分析见图4,2组肉牛瘤胃液菌群Beta多样性无显著差异(P>0.05).
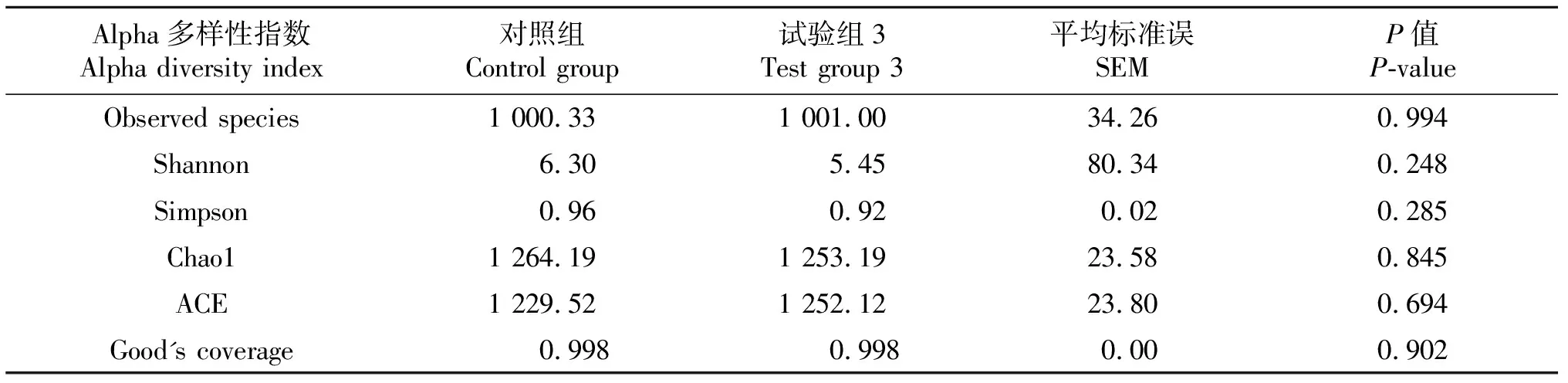
表3 肉牛瘤胃菌群Alpha多样性分析
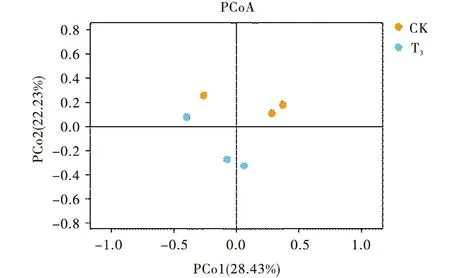
CK:对照组;T3:试验组3.CK:Control group;T3:Test group 3.图3 基于bray curtis算法的PCoA分析Figure 3 PCoAanalysis based on Bray Curtis algorithm
2.2.5 菌群组成分析 对照组和试验组3肉牛瘤胃菌群丰度排名前10的门和属见表4.拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)是组成2组肉牛瘤胃液菌群的主要细菌门类,其相对丰度占瘤胃菌群比例82%以上.普雷沃氏菌属(Prevotella_1、Prevotella_7)为对照组和试验组3肉牛瘤胃菌群的优势菌属,且试验组3的普雷沃氏菌属丰度较对照组高.
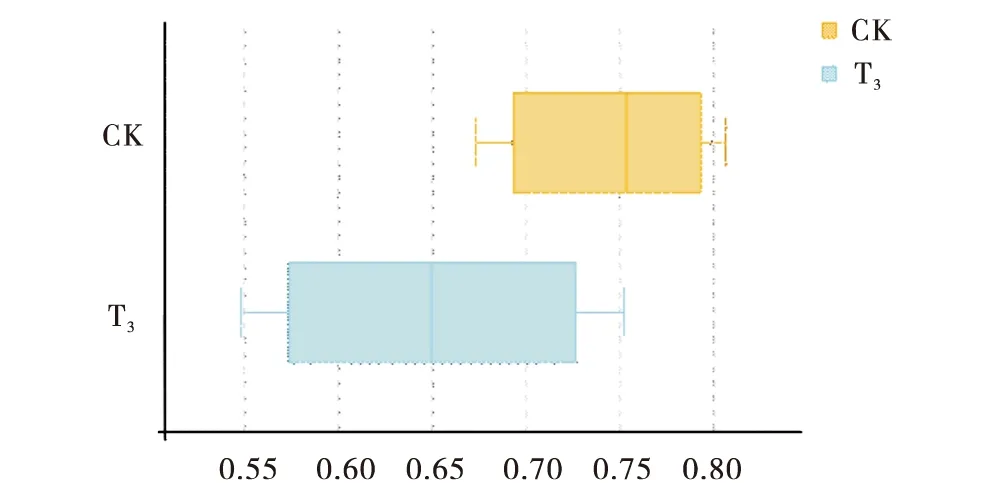
CK:对照组;T3:试验组3.CK:Control group;T3:Test group 3.图4 基于bray curtis算法的群落结构分析Figure 4 Community structure analysis based on Bray Curtis algorithm
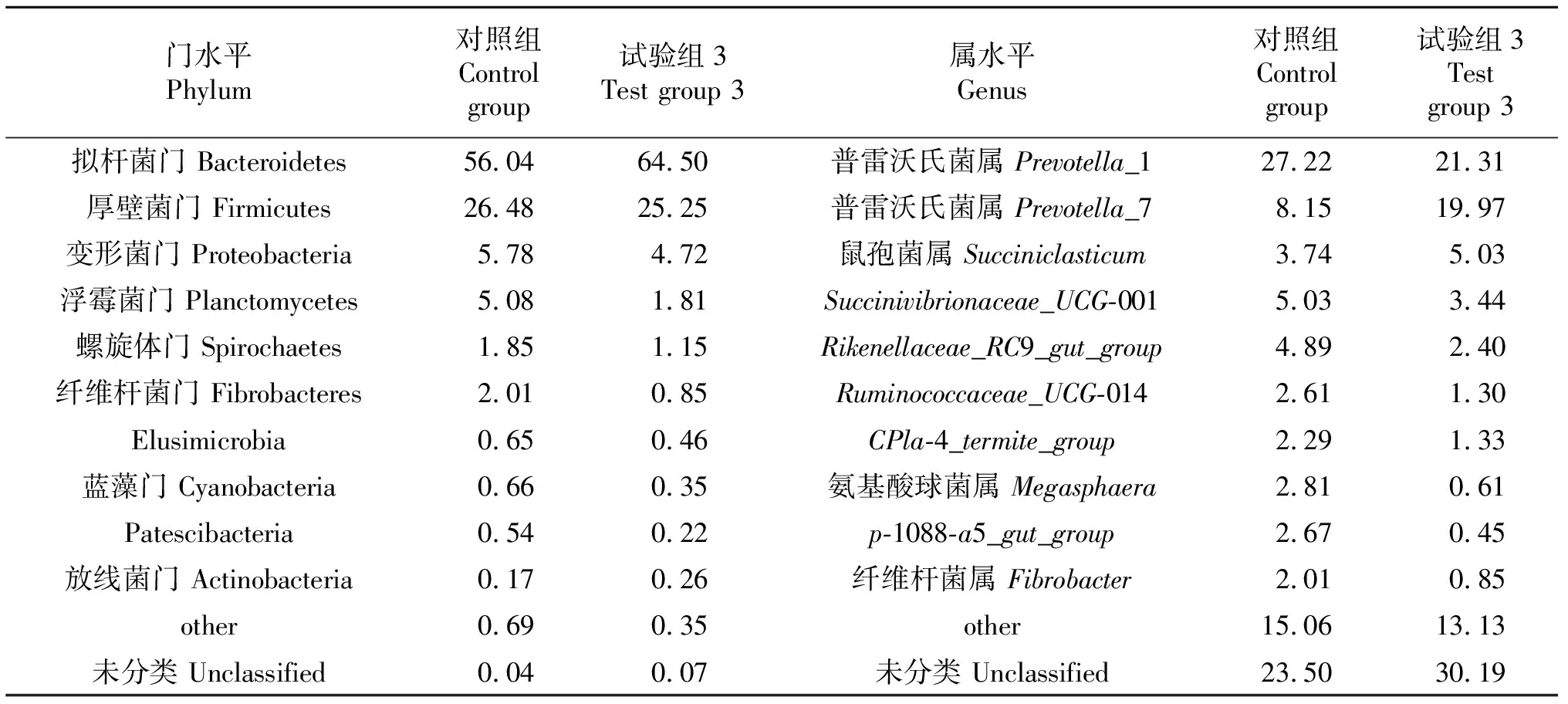
表4 肉牛瘤胃液菌群在门和属水平的相对丰度
2.2.6 KEGG功能预测 利用Welch′st检验模型预测两组肉牛瘤胃液菌群间差异KEGG通路(图5).结果表明有9个差异显著的通路,包括不饱和脂肪酸的生物合成(biosynthesis of unsaturated fatty acids)、细胞色素P450(drug metabolism cytochrome P450)等.
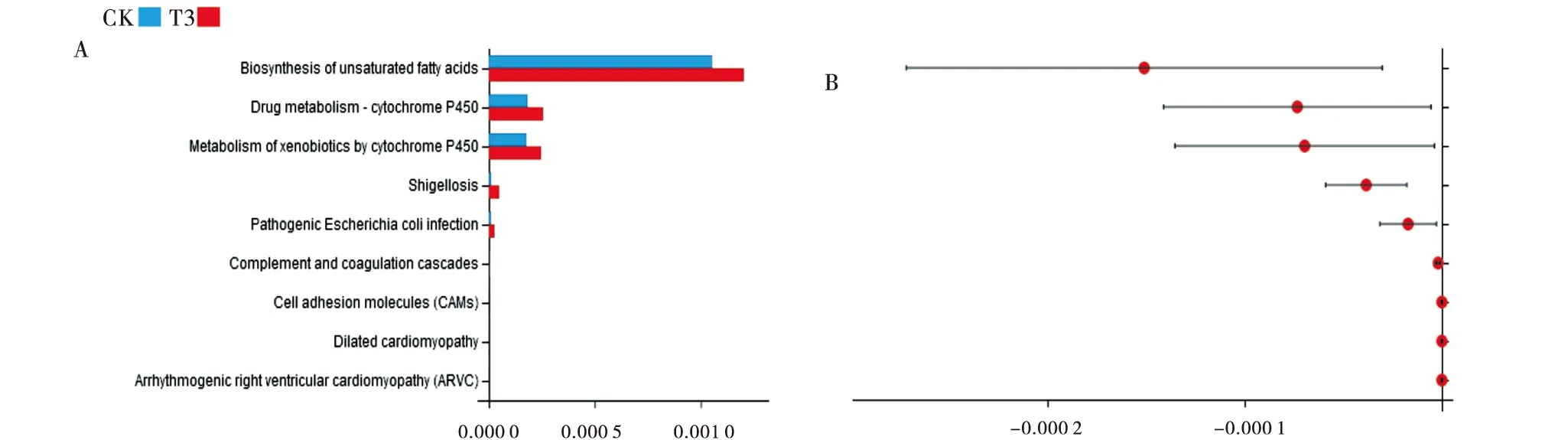
CK:对照组;T3:试验组3.A表示富集在KEGG的reads数目,B表示相应的P值.CK:Control group;T3:Test group 3.A represents the number of reads enriched in KEGG.B is the corresponding P value.图5 肉牛瘤胃菌群KEGG预测代谢途径差异分析Figure 5 KEGG prediction for metabolic pathways of bacteria in rumen fluid of beef cattle
3 讨论
3.1 粗饲料颗粒替代部分全株玉米青贮对肉牛瘤胃发酵的影响
NH3-N是瘤胃内源氮、饲料氮和非蛋白氮分解最终产物,也是瘤胃微生物生长所需氮的主要来源,其为微生物提供18%~100%的氮源;NH3-N含量在一定程度上反映了饲粮蛋白质含量、瘤胃内降解特性、能量供应和特定饲粮组成下蛋白质降解与合成之间的平衡关系[23].饲料中粗蛋白水平及蛋白质降解速度是影响瘤胃液NH3-N浓度的主要因素.本试验表明,试验组肉牛瘤胃液NH3-N浓度均显著低于对照组,且随粗饲料颗粒替代比例增加瘤胃液NH3-N有下降趋势.本试验制作粗饲料颗粒的原料粉碎粒度为8 mm,与青贮饲料(约2~3 cm)相比长度大幅度减小,推测粗饲料颗粒在瘤胃中稀释率高,胃肠道形成的食糜流通速度快,停留时间短,瘤胃微生物对蛋白质的消化率下降,使瘤胃液NH3-N浓度降低.贺鸣等[24]、邬彩霞等[25]、曾银等[26]、Einasron等[27]和Beauchemin等[28]均认为,瘤胃中NH3-N浓度随粗饲料长度减小显著下降,与本试验结果一致.Wanapat等[29]报道瘤胃微生物生长的适宜NH3-N浓度范围为5~28 mg/dL,本试验中肉牛瘤胃液NH3-N浓度为5.15~10.23 mg/dL,均处于适宜范围.
瘤胃VFA主要为乙酸、丙酸、丁酸等,是反刍动物主要的能量来源及合成乳脂肪和体脂肪的原料,VFA的含量及组成比例是衡量瘤胃消化代谢的重要指标之一,受动物、饲料及饲养条件等因素影响.本试验发现,粗饲料颗粒替代不同比例全株玉米青贮对肉牛瘤胃总VFA浓度无显著影响,但试验组3乙酸比例、乙酸/丙酸比值低于其他组,而丙酸比例高于其他组.因反刍动物瘤胃消化的复杂性,粗饲料长度对瘤胃总VFA及乙酸、丙酸的影响效果,国内外研究结果并不一致.马冬梅等[30]、Beauchemin等[28]研究发现,减小粗饲料长度对奶牛瘤胃VFA总量没有显著影响,乙酸浓度则显著下降.然而Krause等[31]报道,减小粗饲料长度能够提高奶牛瘤胃VFA 含量,其中丙酸含量变化率高于乙酸,乙酸/丙酸比值降低;而Yang等[32]报道,增加奶牛粗饲料长度能提高瘤胃总VFA含量,但乙酸/丙酸比值没有显著变化.反刍动物饲粮中粗饲料长度降低,增大了微生物与饲料接触表面积,进而增加了微生物对饲料的发酵,使总VFA产量增加;但饲料粉碎过细,可缩短其在瘤胃内停留时间,进而减少微生物消化时间,导致总VFA产量下降.另外,试验所测定的VFA仅代表采集时间点瘤胃液中的含量,而瘤胃壁吸收量和外流量也会影响到总VFA的产量.因此,瘤胃总VFA含量受粗饲料类型、饲料颗粒大小、外流速度及动物个体差异及此类因素间互作等多方面的影响[33].本试验中,随粗饲料颗粒替代青贮饲料比例由20%增加至80%,肉牛饲粮组成中粗饲料长度下降,但其瘤胃液总VFA浓度没有显著变化.以上试验均证明饲料长度并不是唯一影响瘤胃液总VFA含量的因素.
3.2 粗饲料颗粒替代部分全株玉米青贮对肉牛瘤胃液微生物菌群的影响
反刍动物瘤胃微生物主要包括细菌、原虫和真菌,在营养物质消化代谢过程中发挥着重要作用,饲料中70%以上碳水化合物和蛋白质的消化由瘤胃微生物完成[34],瘤胃微生物定植于饲料,将其降解为低聚物,最终生成VFA、维生素及其他微生物生长所需辅助因子[35].因此,饲粮组成是影响瘤胃菌群结构和功能的重要因素[23,36].瘤胃细菌种类约有7 000余种,是瘤胃中数量最丰富、种类最复杂的微生物[37];许多研究表明,拟杆菌门(Bacteroidetes)和厚壁杆菌门(Firmicutes)是瘤胃优势菌群,对瘤胃发酵起重要作用,且饲粮中纤维素和淀粉水平对此类菌群数量无明显影响[38-40].拟杆菌门菌群,如普雷沃氏菌属(Prevotella)主要降解瘤胃中非纤维性碳水化合物;而厚壁菌门中存在分解纤维的菌属,如瘤胃球菌属(Ruminococcaceae)、丁酸弧菌属(Butyrivibrio)等.张霞等[41]研究表明,不同育肥阶段的西杂牛瘤胃拟杆菌门、厚壁菌门和软壁菌门为优势菌群;Kim等[42]报道,肉牛瘤胃中绝大多数细菌属厚壁菌门(56.1%)和拟杆菌门(30.54%);Thoetkiattikul 等[43]报道,拟杆菌门在奶牛瘤胃中丰度最高.本试验表明,拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)在两组肉牛瘤胃中的相对丰度比例在82%以上,是两组肉牛瘤胃菌群的主要细菌门类,与以上研究报道一致.
本研究也发现,普雷沃氏菌属(Prevotella_1、Prevotella_7)为2组肉牛瘤胃菌群中的优势菌属,且试验组3的丰度较对照组高.普雷沃氏菌属(Prevotella)是反刍动物瘤胃中的关键菌群,数量可达瘤胃菌群总量的60%~70%,虽然不降解纤维素,但却是瘤胃中主要的蛋白降解菌之一,且对淀粉、半纤维素、木质素和果胶降解至关重要[44-47].Grilli等[48]报道,饲喂高饲草的山羊瘤胃普雷沃氏菌属丰度更高;Pitta等[49]研究表明,高粗蛋白的小麦秸饲喂肉牛,瘤胃普雷沃氏菌属显著增加.本试验中,试验组3肉牛用粗饲料颗粒替代80%全株玉米青贮,饲粮中半纤维素及木质素水平升高,普雷沃氏菌属丰度增加可能有利于此类物质降解,也可以提高饲粮中蛋白质、淀粉等有机物消化率.另外,普雷沃氏菌在瘤胃中发酵产物主要是乙酸、丙酸和琥珀酸,而琥珀酸通过微生物酶作用很快转化为丙酸[50].本试验中,试验组3瘤胃VFA中丙酸比例增加,也可能与普雷沃氏菌相对丰度较高有关.
Alpha多样性和Beta多样性均用于分析微生物种群内的多样性,其中Chao1 / ACE 指数可反映菌群丰度,并通过丰度反映微生物适应特定环境及竞争营养物质的能力[51];Simpson/Shannon 指数则表示菌群的均匀度和多样性.本试验发现2组肉牛瘤胃菌群Alpha多样性的各项指数和Beta多样性均无显著差异,说明粗饲料颗粒替代80%青贮饲料,对肉牛瘤胃菌群丰度和多样性无显著影响.李艺[52]报道,谷草替代不同比例玉米秸秆黄贮饲喂西门塔尔杂种牛,瘤胃菌群丰度和多样性没有显著变化;赵娜等[53]研究表明,饲喂青贮玉米及青贮饲用油菜,不影响山羊瘤胃菌群种类和丰度;郭成等[54]报道,奶牛日粮添加低聚异麦芽糖不影响瘤胃微生物多样性,均与本研究结果类似.而郭婷婷等[55]研究表明,添加甘露寡糖降低了奶牛瘤胃菌群的多样性,与本研究结果并不一致.结合本研究结果也进一步表明,反刍动物瘤胃菌群多样性可能与动物种类、发育阶段、饲粮结构及饲养环境等因素有关.
4 结论
粗饲料颗粒替代部分玉米青贮饲喂肉牛,可影响肉牛瘤胃发酵参数,但对瘤胃菌群结构影响较小.对瘤胃总VFA浓度无显著影响,但能降低NH3-N浓度、乙酸比例和乙酸/丙酸比值,增加丙酸比例;粗饲料颗粒替代80%全株玉米青贮,肉牛瘤胃液菌群丰度及多样性无显著变化,拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)为优势菌群门类,普雷沃氏菌属(Prevotella)为优势菌属,有增加不饱和脂肪酸的生物合成的趋势.
