热带睡莲花青素pH示差法测定技术的摸索
2021-05-31黄秋伟龙凌云毛立彦黄欣欣唐毓玮石兰蓉
黄秋伟 龙凌云 毛立彦 黄欣欣 唐毓玮 石兰蓉
摘 要:本研究以热带睡莲“印度红”的色素提取液作为测定材料,采用pH示差法来测定提取液中花青素含量,通过考察测定波长、测定缓冲液pH梯度、平衡时间和反应温度对测定体系中吸光值的影响,来筛选pH示差法较优的测定条件参数,并与热带睡莲“巴拿马”一起进行花色苷含量测定验证试验。试验结果表明,适合热带睡莲红色系花青素含量的pH示差法测定条件为:测定波长536 nm、测定缓冲体系为pH1.0和pH4.5、平衡时间为70 min、反应温度为35℃。此外,“印度红”和“巴拿马”色素提取花青苷含量开展三次重复测定试验的RSD值分别为2.49%、1.54%,说明测定方法具有一定的可靠稳定性。
关键词:睡莲 红色 pH示差法 花青素
Determination of Anthocyanin in Tropical Water
Lily by pH Differential Method
HUANG Qiuwei,LONG Lingyun*,MAO Liyan,
HUANG Xinxin,TANG Yuwei,SHI Lanrong
(Guangxi Subtropical Crops Research Institute, Nanning, Guangxi 530001, China)
Abstract: The anthocyanin content in the pigment extracts of tropical water lily “Indian Red” and “Panama” were determined and verified by pH differential method in this study. The optimal parameters of pH differential method were selected by examining the influence of determination wavelength, buffer solution pH gradient, equilibrium time and reaction temperature on the light absorption value in the determination system. Results showed that the suitable conditions for the determination of anthocyanins in red tropical water lily by pH differential method were as follows: wavelength 536 nm, buffer systems pH1.0 and pH4.5, equilibrium time 70 min, reaction temperature 35℃. The determination test of anthocyanin in “Indian red” and “Panama” pigment was repeated three times, and the RSD values were 2.49% and 1.54% respectively, indicating that the determination method has a certain reliability and stability.
Key words:Water lily;red;pH differential method;anthocyanin
睡莲是睡莲科(Nymphaeaceae)睡莲属(Nymphaea)多年生宿根浮叶植物的统称。依据分布区域和生态适应性可将睡莲分为耐寒睡莲和热带睡莲两大类,其中热带睡莲的花色相较耐寒睡莲的要多,且层次更鲜明,其常见颜色有红色、粉色、紫色、黄色等,主要着色器官为鲜花的花瓣,而植物花色的形成主要是由花青素来决定。当前,关于睡莲的研究报道热点主要是基于不同技术手段探究睡莲系统发育[1-4]、睡莲基因组研究[5]、睡莲代谢物组成[6]、睡莲生理特性及其对水体修复机制[7-10]等,但关于睡莲花青素方面的研究较少。此外,关于植物色素中的花青苷含量测定方法常见报道的有分光光度法和HPLC法[11-12]。HPLC法虽然测定结果准确度高,但要求操作专一性,成本较高,步骤繁琐,因而研究文献以分光光度法使用居多,其中分光光度法又分有单一pH法、pH示差法、差减法[13]等。pH示差法相对来说方便快捷,成本低,适合快速测定植物色素中花青苷含量,但根据测定对象的不同,测定条件会有所差异。本次试验选择热带睡莲品种“印度红”的色素提取液作为测定材料,对pH示差法测定提取液中总花青苷含量的测定条件进行筛选研究,同时选择热带睡莲品种“印度红”和“巴拿马”的色素提取液一起开展测定体系的验证研究,从而为后期热带睡莲色素的提取开发提供一些理论依据。
1 材料与方法
1.1 试验材料
1.1.1 原料与试剂
热带睡莲品种“印度红”和“巴拿马”:由广西亚热带作物研究所睡莲种质资源圃提供,摘取两者的花瓣并置于45℃鼓风干燥箱中烘干至花瓣含水量控制在3%~7%,并经机械粉碎至过20目筛网;无水乙醇(AR级)2.5 L装:成都市科隆化学品有限公司;冰乙酸、无水乙酸钠、柠檬酸、柠檬酸钠、氯化钾、盐酸等分析纯试剂均采购于广西南宁茵兴科技有限公司。
1.1.2 試验设备
T6紫外可见分光光度计:北京普析分析仪器有限公司;GR200型电子分析天平:日本A&D有限公司;DHG-9109A型电热恒温鼓风干燥箱:上海精宏实验设备有限公司;QE-300型中药材高速粉碎机:武义屹立工具有限公司;MJ33型快速水分测定仪:梅特勒-托利多公司;HH-S4型数显示恒温水浴锅:金坛市医疗仪器厂;3-30K高速冷冻离心机:德国SIGMA公司。
1.2 试验方法
1.2.1 色素粗提液的获取
称取“印度红”花瓣干粉0.5 g,采用超声破碎-微波辅助溶剂提取方式,以60%乙醇-草酸(含0.01 g/mL草酸)为提取剂。提取条件分别设定为:料液比1:40、超声探头破碎时间2 min、微波温度40 ℃、微波时间5 min、微波功率400 W。提取完成后将提取液置于20 ℃及12000 r/min的条件下离心10 min,取上清液进行抽滤,所得到的滤液即为色素提取液,将提取液置于冰箱冷藏保存。
1.2.2 花青素测量波长的选择
取色素提取液0.2 mL置于10 mL容量瓶中,并用提取剂稀释定容至10 mL,相当于将提取液稀释50倍。将稀释液置于紫外/可见分光光度计,在320~700 nm的范围内进行波长扫描,扫描数据采集间隔为1 nm,取蒸馏水作为空白基线调零,选择谱图中在可见光区出现吸收峰的波长作为色素测定波长。
1.2.3 花青素测量pH的选择
因整个测定试验要求在pH<7的酸性环境下进行测定,因此本次试验在pH 0.5~6范围内配制13个pH梯度缓冲液,其中,pH 3.0~6.0缓冲液采用柠檬酸-柠檬酸钠缓冲液体系,具体按照表1进行配制,同时用1mol/L的盐酸滴加微调至相应的pH值,调整过程中用pH计进行实时监测。
pH0.5、pH0.8、pH1.5、pH2.0、pH2.5缓冲液的配制:量取0.1mol/L的一水柠檬酸溶液,缓慢加入至20 mL1mol/L的盐酸中,用pH计调整至所需的pH值;pH 1.0氯化钾-盐酸缓冲液的配制:取0.2 mol/L氯化钾溶液、0.2 mol/L盐酸、蒸馏水,三者按50:100:50的体积比混合后,用1 mol/L盐酸微调至pH 1.0;pH 4.5乙酸钠-醋酸缓冲液的配制:取0.2 mol/L三水乙酸钠溶液和0.2 mol/L醋酸溶液按1:1的体积比混合后,用1 mol/L盐酸微调至pH 4.5。取13个10 mL的容量瓶,各吸取0.2 mL置于瓶中,并吸取相对应的pH梯度缓冲液定容至刻度,混匀后,置于30℃的水浴条件下,暂定混合反应时间30 min,以蒸馏水作为空白,于测定波长处测定吸光值,选取吸光值差值最大的两个缓冲体系作为测定pH梯度条件。
1.2.4 花青素测量反应时间与反应温度的选择
配制1.2.3步骤筛选出的两个pH梯度缓冲液,分别吸取色素提取液0.2 mL置于2个10 mL容量瓶中,并分别加入相应的pH缓冲液混合定容至刻度。然后分别将混合液置于25℃、35℃、45℃的水浴锅中,摇匀后开始计时,每隔10 min就在分别在测定波长及700 nm处测定吸光值,并用测定波长测得的OD值减去OD700 nm,求其差值来消除样品液浑浊的影响,并以吸光值的差值作为纵坐标,反应时间作为横坐标,做变化曲线图,依据结果来筛选出适宜的平衡时间及反应温度 。
1.2.5 花青素含量测定条件的稳定性验证
各称取热带睡莲红色品种“印度红”和热带睡莲紫色品种“巴拿马”的花瓣干粉0.5 g,以同样的提取方式提取色素,分别取各自的色素提取液,并按照上述试验步骤得到的pH示差法测定条件进行测定,提取测定试验平行重复3次,并按照下式来计算提取液花青苷含量:
花青苷含量(mg/L)=(A×MW×DF×1000)/(E×L)
该式中:A表示示差法中两个pH梯度稀释液所测得的吸光度的差值,其值的计算方法(OD536 nm- OD700 nm)pH1.0-(OD536 nm-OD700 nm)pH4.5;MW表示矢车菊素葡萄糖苷分子量,值为449.4g/mol;DF表示稀释倍数,本次试验为稀释50倍;E表示矢车菊葡萄糖苷的摩尔消光系数,值为26900(单位为L/(mol·cm));L表示光程的厘米数,值为1cm。
2 结果与分析
2.1 测量吸收波长的确定
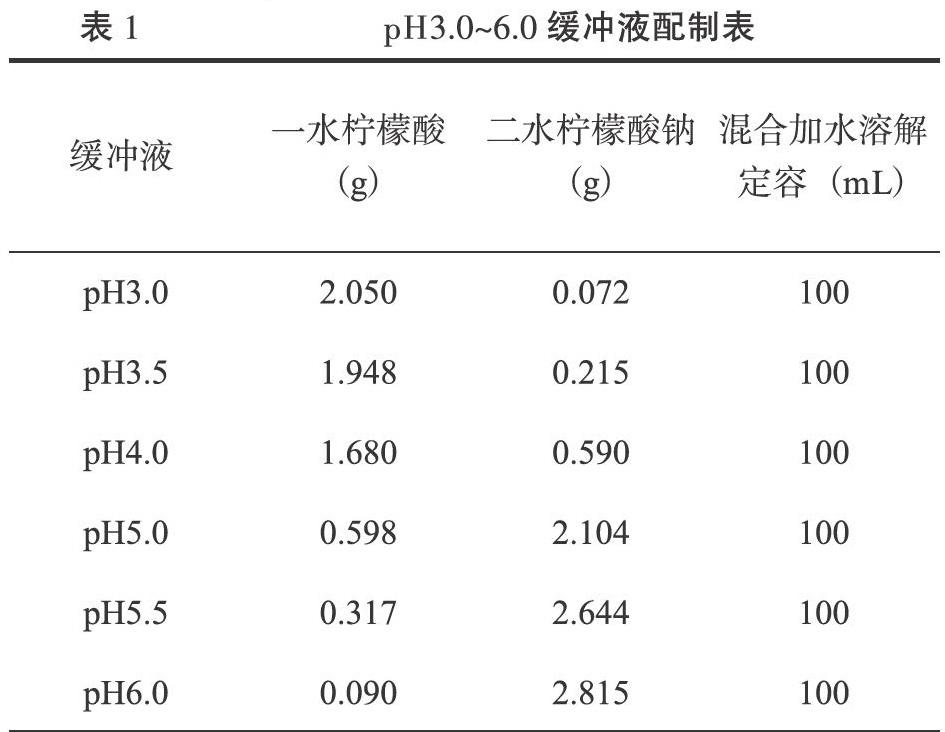
经超声破碎-微波辅助溶剂提取得到的睡莲花色素提取液,用相应的提取溶剂稀释50倍后波长扫描图谱见图1。
如图1所示,经提取剂稀释50倍后的色素提取液很明显在可见光区536 nm处有一吸收峰,在此波长测得的OD值为0.413,处于朗伯比尔定律吸光值与底物浓度成正比范围(即吸光值处于0.2~0.8),因此,本次pH示差法总花青苷含量的测量波长确定为536 nm。
2.2 测量pH梯度的确定
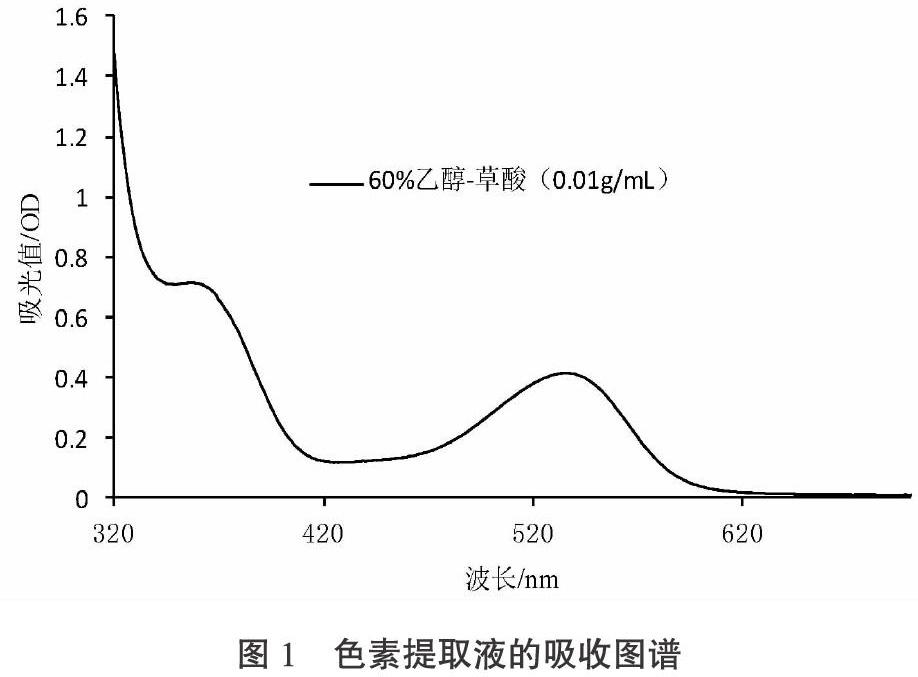
色素提取液与不同pH梯度缓冲液混合后,在同样的反应温度和反应时间条件下,其在波长536 nm处相对应的吸光值变化曲线见图2。
如图2所示,随着pH逐步提高,其相对应的吸光值的变化趋势是先表现出缓慢波动升至一个最大值,然后有规律地下降至一个最低值,最后略高于最低值呈平稳状态。明显看出pH 1.0混合液的OD536最大,pH 4.5混合液的OD536最小,两者的差值最大,故本次示差法所选用的缓冲体系分别为pH 1.0、pH 4.5。
2.3 平衡时间与反应温度的确定
两种pH混合缓冲液在不同反应时间和反应温度的环境条件下,其吸光值差值的变化曲线见图3与图4。
如图3和图4所示,3个温度梯度的pH缓冲稀释液,其吸光值差值均会随着反应時间延长出现波动性的变化,并在60 min时出现一个高点,而当时间延长至70 min时再往后吸光值差值基本处于一个稳定的平衡状态。此外,在相同的反应时间区段内,35℃测得的吸光值差值整体上比其它温度的要高,且曲线稳定。因此综合来看,本次试验pH示差法测定睡莲色素提取液中花青苷含量的体系中平衡时间定为70 min,反应温度定为35℃。
2.4 测定条件的稳定性验证结果
经超声破碎-微波辅助溶剂提取得到的两种色素提取液,其中,“印度红”色素提取液经重复三次提取及测定试验,其花青苷含量分别为261.45、274.82、268.14 mg/L,重复均值为268.14 mg/L,重复试验结果的相对标准偏差(RSD)为2.49%;“巴拿马”色素提取液经重复三次提取及测定试验,其花青苷含量分别为81.86、84.37、82.70 mg/L,重复均值为82.97 mg/L,重复试验结果的相对标准偏差(RSD)为1.54%,两者相对标准偏差均较小。以上结果可以看出两种色素提取液花青苷含量重复试验具备可靠的稳定性,且“印度红”色素提取液花青苷含量要明显高于“巴拿马”品种。
3 讨论与结论
色素分子一般在植物体内是以花青苷的形式存在,花青苷在酸性环境下(pH<7)是稳定的,同时其吸光值随pH值的变化而变化[14],通过测定pH 0.5~6范围内样品的吸光值,可以获得吸光度差异最大且稳定的2个pH值,在此这两个差值最大的pH值下进行检测的吸光值,通过相应公式的计算,即可获得最精确花青苷含量的测定结果,本次测定结果中,pH 1.0和pH 4.5两者吸光值之间的差值最大。此外,花青苷在缓冲液中,其结构变化是一种随时间变化后并达到稳定的动态平衡反应。因此当用缓冲液来稀释花色素时,混合均匀后,需要放置一段时间,待其反应稳定后再开始测定,本次测定结果中,吸光值差值曲线均为反应时间为70 min达到平衡点,时间再延长无明显变化。花青苷大多是热不稳定性的物质,受热易分解失活[15],因此缓冲液稀释后,等待反应稳定所放置的温度条件也是较为关键的因素。本次测定结果发现红色系热带睡莲花青苷最适温度为35℃,提高至45℃时,部分花青苷结构受到破坏而导致吸光值降低。
本次研究以經乙醇-草酸提取热带睡莲红色系品种“印度红”的色素提取液为测定对象,对pH示差法测量提取液中总花青苷含量的测定条件进行了筛选,主要考察吸收波长、缓冲液pH梯度、平衡时间和反应温度这四个条件参数。依据筛选试验结果,最终确定pH示差法测定热带睡莲红色总花青苷的条件,即测定波长为536 nm、缓冲体系为pH 1.0和pH 4.5、平衡时间70 min、反应温度35℃。在此测定条件下,经过两个热带睡莲品种色素提取液的重复测定验证试验,所得到的吸光值准确及稳定,能够更好代入公式换算相应的总花青苷含量,所算出来的花青苷含量重复性较好,测定体系有一定的可靠稳定性。
参考文献
[1] 刘艳玲,徐立铭,倪学明,等. 基于ITS 序列探讨睡莲属植物的系统发育[J]. 武汉大学学报(理学版),2005(2):258-262.
[2] 张海平,房伟民,陈发棣,等. 部分睡莲属植物形态性状的多样性分析[J]. 南京农业大学学报,2009,32(4):47-52.
[3] Péter P, Kinga K M, István S, et al. Genetic Variability of Thermal Nymphaea(Nymphaeaceae) Populations Based on ISSR Markers: Implications on Relationships, Hybridization, and Conservation[J]. Plant Molecular Biology Reporter, 2011, 29(4): 906-918.
[4] 苏群,杨亚涵,田 敏,等. 睡莲种质资源遗传多样性分析及DNA 指纹图谱构建[J]. 热带作物学报,2020,41(2):258-266.
[5] Zhang L S, Chen F, Zhang X T, et al. The water lily genome and the early evolution of
flowering plants[J]. Nature, 2020, 577(7788): 79-84.
[6] 袁茹玉.不同品种睡莲花挥发物组成及其茶汤功能成分和抗氧化活性评价[D]. 南京:南京农业大学,2014.
[7] 古琴.低温胁迫对不同热带睡莲品种抗寒生理的影响[J]. 上海农业学报,2016,32(5):114-
118.
[8] 张雅君,吴含玉,张会金,等.夏季小花睡莲挺水叶光抑制加剧的机制[J]. 植物生理学报,
2018,54(1):54-62.
[9] 柯美玉,陈栩.光对睡莲开花生物钟的调控作用研究[J]. 中国园艺文摘,2018,(5):21-25.
[10] 宋力,黄勤超,黄民生. 利用荷花与睡莲对沉积物中重金属的修复研究[J]. 光谱学与光谱分析,2016,36(9):2884-2888.
[11] 杨萍,李哲. pH示差法与HPLC测定黑枸杞花青素方法比较[J]. 中国农机化学报,2017, 38(7):74-78.
[12] 周丹蓉,叶新福,方智振,等. HPLC法测定李果实中花色苷含量及其与pH示差法的比较研究[J]. 东南园艺,2018,(1):1-7.
[13] 翦祎,韩舜愈,张波,等. 单一pH法、pH示差法和差减法快速测定干红葡萄酒中总花色苷含量的比较[J]. 食品工业科技,2012,33(23):323-423.
[14] 桑戈,赵力,谭婷婷,等. pH示差法测定紫薯酒中花青素的含量[J]. 酿酒科技,2015,(6):
88-91.
[15] 杨萍,李哲. pH示差法测定黑枸杞花青素技术的研究[J]. 中国食品添加剂,2017, (10):
107-111.
