基于高通量测序的木薯根域土壤微生物群落结构研究
2021-05-31韦云东罗燕春郑华李军盘欢雷开文周时艺
韦云东 罗燕春 郑华 李军 盘欢 雷开文 周时艺
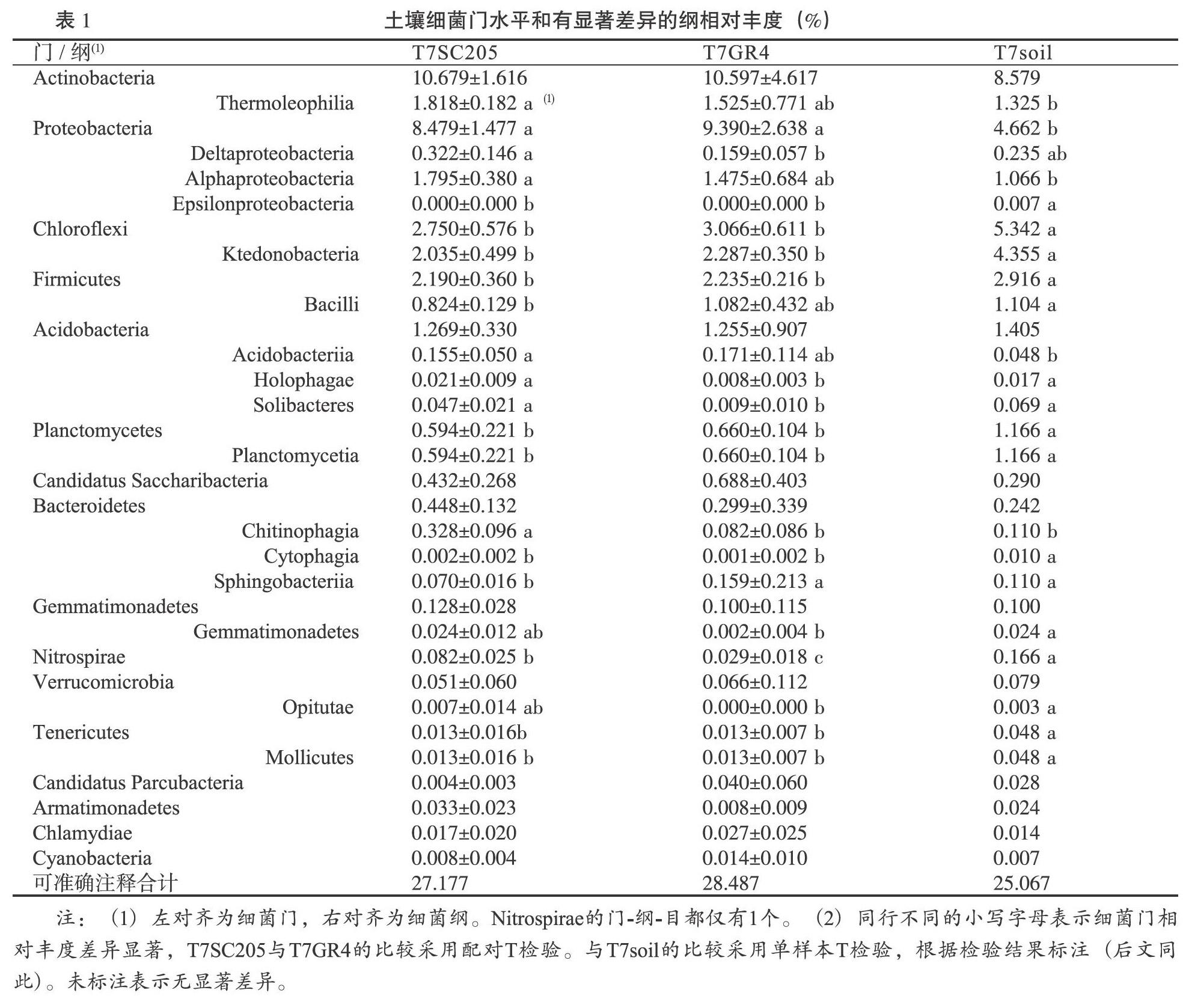
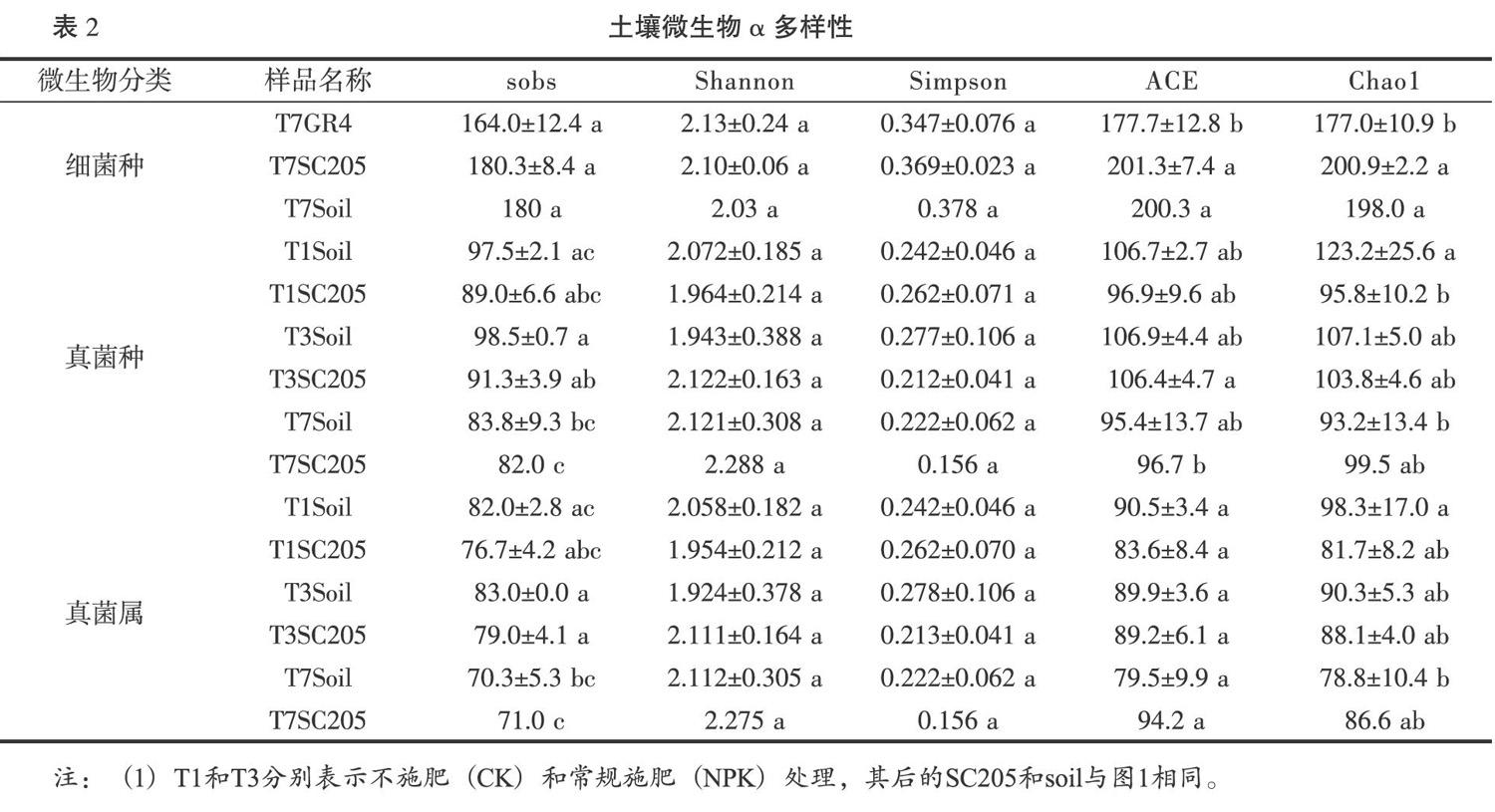
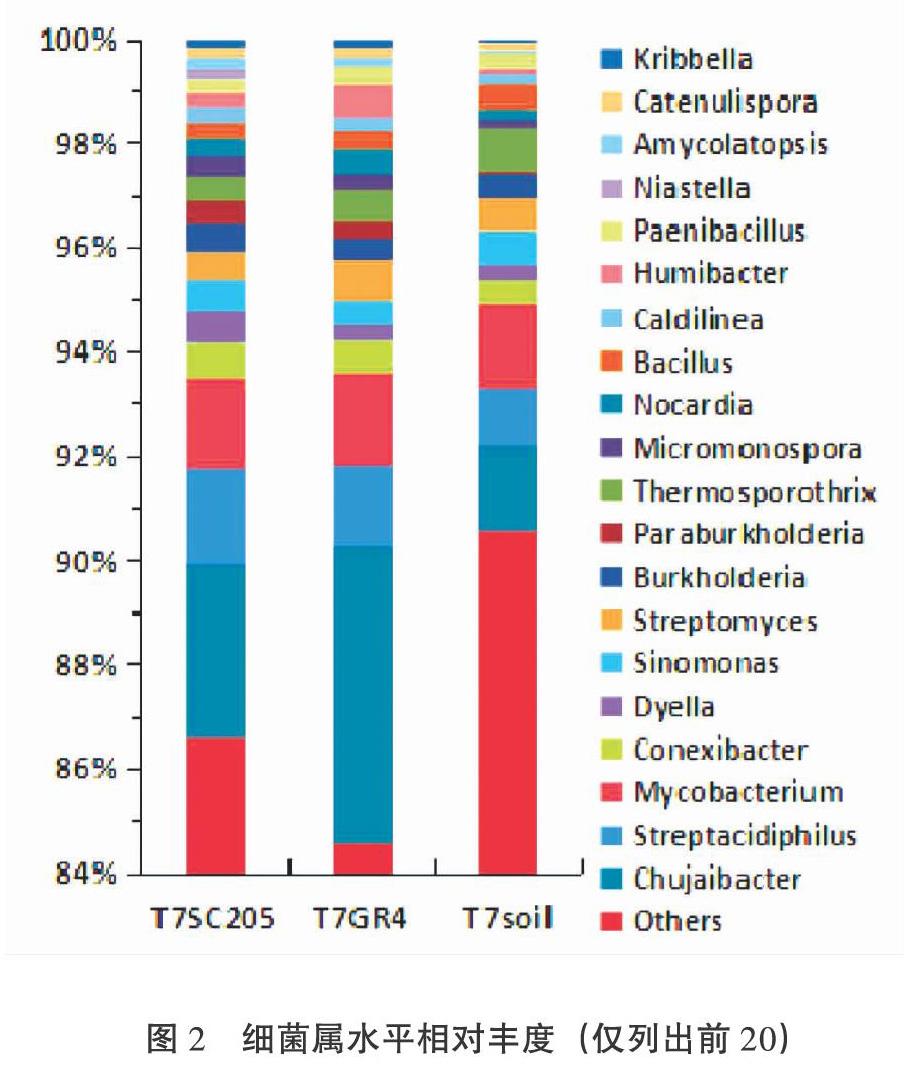
摘 要:為研究木薯根域土壤微生物群落结构,开展了根袋试验,处理包括2个木薯品种(华南205:SC205和桂热4号:GR4)和3个施肥处理(包括不施肥T1,普通施肥T3,施2倍氮肥T7),并进行了Illumina Hiseq高通量测序。结果表明,细菌优势群落为放线菌门(Actinobacteria,8.579%~10.697%),变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)等。根域土壤比非根际土壤相对富集变形菌门和10个细菌属;SC205根域的硝化螺旋菌门(Nitrospirae)、5个纲(δ变形菌纲等)和6个属(Flavisolibacter等)的相对丰度比GR4要高,但鞘脂杆菌纲则相反。真菌优势群落为子囊菌门(43.71%~59.79%)、毛霉门、担子菌门等。根域土壤施肥抑制壶菌门(Chytridiomycota)相对丰度。相对于根域土壤,T7提高了非根际土壤中的Agaricomycetes, Geminibasidiomycetes和Microbotryomycetes纲的相对丰度。T7比T1显著降低了根域土壤Chytridiomycetes纲的相对丰度。LEfSe结果表明:根域土壤施肥降低了哈茨木霉的相对丰度。α多样性结果表明:土壤细菌物种丰度顺序为T7 GR4 关键词:木薯根域 微生物群落 鞘氨醇杆菌属 硝化螺旋菌门 哈茨木霉 中图分类号:S154.3,S533 文献标识码:A 基金项目:现代农业产业技术体系建设专项资金资助(NO. CARS-11);广西自然科学基金资助(No. 2020GXNSFAA259042);广西农业科学院基本科研业务专项资助项目(桂农科2021YT150)。 作者简介:韦云东(1988-),男,土壤学硕士,助理研究员,主要从事木薯栽培与施肥管理研究。 *通信作者:郑华(1983),男,高级农艺师,生态学博士,主要从事木薯水肥管理研究,E-mail: zhenghua8305@yeah.net。 收稿日期:2020-06-22 Study on Soil Microbial Community Structure in Cassava Rhizosphere by High-throughput Sequencing Techniques WEI Yundong,LUO Yanchun,ZHENG Hua*,LI Jun,PAN Huan, LEI Kaiwen,ZHOU Shiyi (Guangxi Subtropical Crops Research Institute, Nanning,Guangxi 530001, China) Abstract: The soil microbial community structure in cassava rhizosphere was studied by root-bag experiment with two cassava varieties (SC205 and GR4) and three fertilization treatments (T1-no fertilization, T3-conventional fertilization, T7-two times nitrogen fertlizer). Bacteria (16S) and fungi (18S) were tested by Illumina Hiseq high-throughput sequencing. Results showed that the dominant bacterial communities were Actinobacteria (8.579%~10.697%), Proteobacteria, Chloroflexi, et al. Proteobacteria and 10 genus in rhizosphere soil were relatively higher than those in non-rhizosphere soil. The relative abundance(RA) of Nitrospirae, 5 classes (Deltaproteobacteria,et al.),and 6 genus (Flavisolibacter,et al.)in SC205 rhizosphere were higher than those in GR4 rhizosphere, while Sphingobacteriia did the opposite. The dominant fungi communities were Ascomycota (43.71% - 59.79%), Mucoromycota and Basidiomycota,et al. Fertilization in rhizosphere soil inhibited the RA of Chytridiomycota. In T7, the RA of Agaricomycetes, Geminibasidiomycetes and Microbotryomycetes in non-rhizosphere soil increased, but the RA of Chytridiomycetes in rhizosphere soil decreased. LEfSe analysis demonstrated that fertilization in rhizosphere soil decreased the RA of Trichoderma harzianum. α diversity index indicated that the soil bacterial species abundance in GR4 rhizosphere was lower than that in SC205 rhizosphere and all non-rhizosphere soil in T7. The fungi abundance in T3 was higher than that in T7, and the Chao1 index in T7 was lower than that in T1. Conclusion: bacterial species abundance, and the RA of Nitrospirae and 5 classes and 6 genus in GR4 rhizosphere were relatively lower than those in SC205 rhizosphere. Differences of bacteria infered difference of nitrogen cycle and root exudates. Fertilization decreased the fungal species abundance.Chytridiomycota, 4 Eumycetes and Trichoderma harzianum were affected by fertilization or cassava roots, suggesting the function of the fungi in fertilizers transformation or their interaction with root exudates. The study would provide basis for further study of cassava rhizosphere microbes. Key words: Cassava rhizosphere;microbial community;Sphingobacterium;Nitrospirae;Trichoderma harzianum 根际是受植物根系生长影响,性质有别于其他土体的微域土区,是植物与土壤进行物质、能量交换的重要场所。根际土壤微生物群落是土壤生态系统持续发挥作用的重要媒介,是反应土壤健康状态的重要指标[1]。根际微生物主要来源于土壤[2],而植物对根际微生物有一定的筛选作用[3,4],主要是通过根际分泌物吸引特异微生物种群[5]。 根际微生物群落结构受植物年龄[6]、生长时期[7,8]、耕作制度[9]、连作[10]、施肥[11,12]等多种因素的影响。不同的土壤质地也导致根际微生物的差异[13]。作物不同品种间的根际微生物也有差异,如水稻的籼稻根际比粳稻根际富集更多参与氮代谢的微生物群落[14];苏小惠等[15]研究表明不同苎麻品种根际微生物也有一定的差异。李强等[16]的研究认为不同品种的烤烟,其根际微生物种类和优势种群数量并无差异,但微生物种群的分布情况存在显著差异。 木薯是我国南方重要的经济作物,其用途广泛,是食品、化工、生物燃料等多种行业的重要原料。对木薯根际微生物的研究十分有限,如唐秀梅等[17]的研究表明木薯/花生间作可增加根际土壤细菌、真菌、放线菌及总微生物数量和微生物多样性。徐海强等[18]的研究表明木薯与花生间作有利于木薯和花生根際土壤向细菌型转化,且间作同时可改变木薯和花生根际土壤细菌和真菌的群落结构。 “抖落法”[19,20]和“根袋法”[21,22]是研究根际土壤较常用的方法。木薯根毛少,使用“抖落法”采集根际土壤十分困难。本研究采用“根袋法”结合高通量测序技术,研究木薯根域(根袋内)和非根际(根袋外)土壤的微生物群落结构差异以及木薯品种间差异,以期为了解木薯根际过程包括根系分泌物、养分吸收与微生物交互作用提供理论依据。 1 材料与方法 1.1 材料 参试土壤从南宁市武鸣区采样,采样地种植木薯有10年以上历史。质地为粘土,其粘粒(<0.002 mm)、砂粒(2~0.05 mm)、粉(砂)粒(0.05~0.002 mm)含量分别为58.49%,33.00%,8.51%;粘土pH值、全氮、全磷、全钾、速效氮、速效磷、缓效钾分别为5.7,1.410 g/kg,2.65 g/kg, 4.39 g/kg, 122.0 mg/kg,154 mg/kg, 65.7 mg/kg。试验前风干过2 mm筛。 所试木薯品种为桂热4号(GR4)和华南205(SC205)。其中SC205为我国木薯种植区域广泛分布的主栽品种;桂热4号为广西壮族自治区亚热带作物研究所(以下简称热作所)育种,于2011年通过品种审定。其品种亲本单株编号为SM1600,来源于国际热带农业中心木薯种质PAR164自然杂交后代。 根袋材质为300目尼龙网,分为大袋和小袋。大袋为50 cm × 30 cm × 15 cm的长方体,上部中间有长13 cm,高7 cm的一条开口,方便放入小袋。小袋为长30 cm,直径5 cm,正中间有高10 cm,直径5 cm的T型凸起,凸起上下均开口,用于种植木薯种茎。 所用化肥均为市购,其中尿素(N 46.4%)由重庆建峰化工股份有限公司生产、复合肥(N:P2O5:K2O比例为15:15:15)由欧洲化学安特卫谱公司生产、氯化钾(K2O 60%)由中化化肥有限公司生产,磷酸二氢钾(P2O5≥51.5 %,K2O≥33.9 %)由安徽省尼古拉斯植物营养有限责任公司生产。 1.2 方法 1.2.1 试验设计 试验于2017年在热作所木薯试验基地开展(N 22°54′02.58″,E 108°20′05.43″)盆栽试验。该试验完整共17个,包括两种土壤(粘土和砂质壤土),不同施肥量的氮磷钾肥和不同的中微量元素肥料组合。该文中参与分析的数据包括处理1、3、7,均为粘土。其中处理1(编号T1)和处理3(编号T3)的木薯品种为SC205,T1和T3分别为不施肥处理(CK)和常规施肥(NPK);T7的木薯品种为GR4和SC205,施肥为2倍氮肥(N2PK)。NPK的施肥量为N:P2O5:K2O为76.9 mg/kg:76.9 mg/kg:76.9 mg/kg,以复合肥(15:15:15)的形式施入;N2PK的施肥量为153.8 mg/kg:76.9 mg/kg:76.9 mg/kg,以尿素、磷酸二氢钾、氯化钾的形式施入。同一处理根袋内外的施肥量均一致。T1根袋内外样品名称分别为T1SC205和T1soil;T3根袋内外样品名称分别为T3SC205和T1soil;T7根袋内外样品名称分别为T1SC205(品种SC205)、T7GR4(品种GR4)和T1soil。每个处理4次重复。 盆栽用盆的大小为620 mm×395 mm×170 mm。种植时,将土壤(粘土和砂质壤土)按各处理与肥料混匀后按各处理分别装入到试验用盆中。每个盆内装入40 kg土壤。然后将各处理的土壤500 g分别装入到根袋中。每个根袋分别种植一株长约30 cm的木薯种茎,之后埋入大盆的土壤中深10 cm左右。每盆中植入GR4和SC205各1株。处理随机区组排列。 2017年4月27日种植后用水浇透,之后进入日常管理。于2017年8月8日(植后103 d)取样。取样时分别取大盆内的土壤和根袋内的土壤,每个样品通过四分法分为三份:一份重量大约10 g,取样后迅速放入液氮中速冻,之后保存在-40℃冰箱。第二份取样后迅速放入4℃冷藏箱,之后保存于4℃冰箱中;第三份取样后风干。 T7SC205,T7GR4和T7soil(样品含义见表1)进行高通量细菌多样性测序;并选取T1soil、T3soil、T7soil、T1SC205、T3SC205、T7SC205进行高通量真菌多样性测序。 1.2.2 测试与分析方法 将保存在-40℃的样品在液氮下使用玛瑙研钵磨碎,使用干冰运输(约-40℃)送检测试高通量微生物多样性。细菌(16S)和真菌(18S)多样性由上海美吉生物医药科技有限公司开展,遵照Hov等[23]和Ma等[24]中的标准程序,但真菌的扩增引物由ITS改为18S:SU0817F(5'-TTAGCATGGAATAATR RAATAGGA-3')和1196R(5'-TCTGGACCTGGTGAG TTTCC-3' )的V5-V7可变区。且最后利用RDP classifier (http://rdp.cme.msu.edu/)每条序列进行物种分类注释时,比对的数据库为nt,设置比对阈值为70%。 1.2.3 数据统计分析 方差分析采用RStudio version 1.1.463(基于R Version 3.5.2)中的ANOVA进行,T7GR4与T7SC205之间的比较采用配对t检验,二者与T7soil的比较采用t检验,多重比较采用SSR法,其中t检验(包括配对t检验)采用基本函数t.test()进行,多重比较采用Rstudio中的boxplert.R程序进行。热图(Heatmap图)采用Pheatmap包进行作图。 LEfSe(LDA EffectSize)按照Segata等[25]中的方法计算,LDA值分布柱状图中展示了LDA Score大于设定值(默认设置为4)的物种,即组间具有统计学差异的Biomarker。PCoA(principal co-ordinates analysis)是一种研究数据相似性或差异性的可视化方法,通过一系列的特征值和特征向量进行排序后,选择主要排在前几位的特征值,PCoA 可以找到距离矩阵中最主要的坐标,结果是数据矩阵的一个旋转,它没有改变样品点之间的相互位置关系,只是改变了坐标系统。通过PCoA 可以观察个体或群体间的差异。LEfSe和和PCOA均在美吉生物云平台中进行(https://cloud.majorbio.com)。考虑到样品数,仅3个处理参与LEfSe分析:T1SC205,T3SC205和T7SC205。分析后得到有显著差异的指示物种,之后采用上述boxplert.R程序进行方差分析和作图。 2 结果与分析 2.1 土壤细菌 高通量测序结果表明:各样品细菌测得的序列数范围为32413-48484个,平均长度在431.3~434.9,最短序列长度的范围为267~332 bp,最长序列长度为494~510 bp(图表略)。细菌测得的OUT能注释到种的仅为63.8%(150/235),可识别的有效tags数占总有效tags数的10.5%~20.1%(图表略),其中T7soil最低,T7GR4最高。 图1可以看出,T7SC205和T7GR4分别有222和227个细菌种,大于T7soil(180个)。根袋内外的土壤共有种有171个,两个品种根袋内土壤单独共有44个细菌种(不包括三者共有),而单独与根袋外的土壤共有细菌种仅各为4个。三者分别有8,3,1个特有细菌种,查看原始OTU表格可知(图表略):T7soil仅有1个独有种Helicobacter_pylori,其有效tags数较小;T7GR4有6个特有种能注释到物种名,而且有效tags数为5~125,超过10个的有酸土环脂芽孢杆菌,葡萄球菌属未注释种,Microlunatus terrae(小月菌属),Devosia sp.,噬几丁质菌属(Chitinophaga sp.BHS15),這些细菌种可能对GR4根际有一定的选择性。T7SC205根袋内仅一个鞘脂单胞菌属下的未知种(Novosphingobium sp.),且有效tags数为76,该属是鞘脂单胞菌目下的属,是能够直接利用根系分泌物的细菌。 表1可以看出,可准确注释到细菌门共16个,相对丰度的占总测序数的比例仅25.067%~28.487%。放线菌(Actinobacteria)相对丰度最高,达到8.579%~10.697%,其下属的Thermoleophilia纲表现为T7SC205>T7soil。其次为变形菌门(Proteobacteria),相对丰度为4.662%~9.390%,再次为绿弯菌门(Chloroflexi),厚壁菌门(Firmicutes)等。 根据处理间细菌门和纲的差异,将它们大致分为三类:第一类表现出了两个品种的差异,且部分还有根袋内外差异,包括δ变形菌纲(Deltaproteobacteria)、全噬菌纲(Holophagae)、索利氏菌纲(Solibacteres)、Chitinophagia纲、硝化螺旋菌门(Nitrospirae)及其下属的唯一纲-硝化螺旋菌纲,这5个纲的相对丰度大小均为T7SC205> T7 GR4,另外,还有一个鞘脂杆菌纲(Sphingobacteriia)的相对丰度为T7SC205< T7GR4。第二类两个品种与根袋均有显著差异,但品种间无显著差异,包括柔膜菌门(Tenericutes) 及其唯一下属的柔膜菌纲(Mollicutes)、厚壁菌门(Firmicutes)、绿弯菌门(Chloroflexi)及其下属的Ktedonobacteria纲,浮霉菌门(Planctomycetes)及其下属的Planctomycetia纲,Epsilonproteobacteria纲、Cytophagia纲,以上细菌门类均表现为根袋内小于根袋外,而变形菌门则表现为根袋内大于根袋外。第三类为1个品种与根袋外有显著差异。包括Thermoleophilia纲、α变形菌纲、酸杆菌纲三者都为T7SC205>T7soil,杆菌纲(Bacilli)相对丰度为T7SC205< T7soil,芽单胞菌纲和Opitutae纲顺序均为T7GR4 α多样性指标结果表明(见表2):T7土壤细菌种水平的ACE和Chao1指标表现为GR4小于T7soil和T7SC205。说明GR4根袋内土壤的细菌物种丰度最低。但处理间细菌的其它α多样性指标均无显著差异。 图2为细菌属水平的相对丰度,可准确注释的属中,Chujaibacter属(变形菌门)相对丰度最大(1.6461%~5.6787%),其次分别为放线菌门下的Streptacidiphilus(1.0974%~1.8509%)、Mycobacterium(1.6288%~1.8372%)、Conexibacter(0.4176%~ 0.6762%),和变形菌门下的Dyella(0.3229% ~0.6238%),以及放线菌门下的Sinomonas和Streptomyces,变形菌门下的Burkholderia,Paraburkholderia、绿弯菌门下的Thermosporothrix和放线菌门下的Micromonospora等。 经过统计检验,发现处理间共有41个可准确注释属相对丰度有显著差异(表3),根据处理间的差异水平,可以分为3类。第1类只表现出了品种间的差异,有2个属(Kutzneria和Holophaga),其大小顺序为T7SC205>T7GR4。第2类同时表现出了品种间的差异和根袋内外的差异,有4个属,其中有2个属大小顺序为T7SC205≈T7soil>T7GR4,包括Flavisolibacter,Candidatus Solibacter;另外2个属大小顺序为T7SC205> T7GR4和T7soil,包括Niastella和Legionella。第3类则仅表现出了根袋内外的差异,共有35个属,其可分为4小类:第1小类(分类号为3A)有6个属,其大小顺序为T7soil>T7GR4,包括Ralstonia,Pseudonocardia、Sediminibacterium、Nitrolancea、Ornithinibacillus、Chlamydia。除了Ralstonia,其它属的相对丰度均较小,范围在0~0.0014%之间;第2小类(3B)有13个属,其大小顺序均为T7SC205 总结起来,表现出品种间差异的细菌属有6个,包括分类1和2A,2B,均为SC205大于GR4。表现出根袋内外差异的细菌属有39个,其中根袋内小于根袋外有30个,包括T7GR4 对样本的土壤细菌群落的OTU数据实施了主坐标分析(PCoA),结果如图3所示,主成分PC1和PC2对细菌群落变异的解释度仅分别为29.89%和19.59%。而T7GR4的样点全部分布在一、三象限,另外两个处理则分布在二、四象限,说明主成分PC1不能成为区分处理间差异的标准,而PC2则在一定程度上能表征处理间的差异。 2.2 土壤真菌 可准确注释到真菌门分类共有6个,其相对丰度总和的范围为38.18%~73.34%,所有樣品平均值为59.92%±9.40%(图表略)。各处理相对丰度最高的门为子囊菌(Ascomycota),其相对丰度大小为43.71%±11.59%~59.79%±8.05%,其次为毛霉门(Mucoromycota),各处理相对丰度大小为0.590%~4.662%;再次为担子菌门(Basidiomycota),0.781%~7.863%;壶菌门(Chytridiomycota),0.118%~0.946%;捕虫霉门(Zoopagomycota),0.0606%~0.213%;芽枝霉门的相对丰度最小0~0.066%。其中处理间的壶菌门相对丰度有显著差异,T1SC205最高(0.946%±0.254%),显著高于T3SC205(0.349±0.184%),T7soil(0.141%),T7SC205(0.118%±0.123%)(图4),可见对根域土壤施肥后壶菌门受到一定的抑制。 真菌纲共有21个,相对丰度(所有样品平均值)超过1%的共有5个,分别是Eurotiomycetes(36.65%),Sordariomycetes(12.89%),Dothideomycete(2.858%),unclassified_p_Mucoromycota(2.689%),Pucciniomycetes(1.656%)(图4)。有4个纲表现出了处理间的显著差异(图4),其中蘑菇菌纲(Agaricomycetes)和双生担子菌纲(Geminibasidiomycetes)的T7soil显著高于其它处理,表明相比其它施肥处理,2倍施氮处理显著提高了土壤中二者的相对丰度,但该处理的根袋内显著低于根袋外,说明受木薯根系影响,其在根袋内相对减少,保持了与其它施肥处理根袋内一致的水平。壶菌纲(Chytridiomycetes)则表现为T1SC205> T7SC205,表明2倍施氮肥会比不施氮肥显著降低根袋内该真菌纲的相对丰度。微球黑粉菌纲(Microbotryomycetes)的相对丰度顺序为T7soil显著大于其它所有处理,T3soil其次,T3soil显著大于T1SC205和T3SC205,该真菌纲对施肥和木薯根系表现出了一定的敏感性:根袋外施2倍氮肥比施1倍氮肥和不施肥的相对丰度高,说明施2倍氮肥显著提高真菌该纲的非根际土壤中的相对丰度;而施1倍和2倍氮肥时,根袋内均小于根袋外,说明该真菌纲在施肥的条件下,根袋内相对丰度低于根袋外,但不施肥时该真菌纲的根袋内外无显著差异。 对T1SC205,T3SC205和T7SC205三个处理进行LEfSe结果表明,仅有肉座菌科(Hypocreaceae)-木霉属(Trichoderma)-哈茨木霉种(Trichoderma harzianum)有显著差异(由于结果比较简单,图表略)。经过查看原始数据,发现三者为唯一包含关系,即1科1属1种。经过方差分析,发现哈茨木霉表现为T7SC205≈T3SC205>T1SC205(图5)。说明施肥导致根袋内该真菌种相对丰度显著增加,由于该种是真菌的优势种群,很可能表明该真菌种与木薯根域环境内的肥料转化有关。 各处理间和根袋内外土壤真菌属和种水平的α多样性的Shannon,Simpson指数无显著差异(表2)。代表物种丰度的指标在处理间有显著差异:种水平Sobs指标(表示观察到的物种数)的处理间差异表现为T3soil大于T7soil和T7SC205,T3SC205大于T7SC205,属水平则表现为T3soil和T3SC205显著大于T7soil和T7SC205;真菌种ACE指标表现为 T3SC205大于T7SC205;种水平Chao1指标为T1soil大于T1SC205和T7soil,属水平为T1soil大于T7soil。根据sobs指标和ACE指标的结果表明,表现出了施一倍氮肥比施两倍氮肥的物种数高,无论是属或者种水平,还是根袋内、外。表明增加氮肥用量降低了真菌物种数。而物种丰度指标ACE也部分支持这一观点。但Chao1指标仅支持施2倍氮肥的真菌物种丰度比不施肥要低。 对样本的土壤真菌群落属水平数据实施了主坐标分析(PCoA),结果如图3所示,主成分PC1和PC2对细菌群落变异的解释度分别为32.34%和25.18%。T1SC205与T3SC205的三个样品,T1soil基本可以聚在一起第二和第一象限,T3SC205的B09SC205样品可能受到培养过程中随机因素的影响,表现出了单独在第三象限,受到PC1的影响大(负相关)。而T3soil和T7SC205则都表现出了一定的聚集性,且二者可以通过PC2来大致区分。整体上各处理可以通过各样品受到PC1的影响进行大致聚类。 3 结论与讨论 3.1 根域土壤细菌群落 在T7(N2PK)处理的可注释细菌门中,放线菌的相对丰度最大(8.579%~10.697%),其次为变形菌(4.662%~9.390%)、绿弯菌门,厚壁菌门、酸杆菌门等。放线菌是植物根际土中一类重要的微生物,在促进植物生长方面,防治病害方面起到重要作用[26,27]。本研究中,根袋内相对富集的细菌仅有变形菌门,其根袋内相对丰度显著大于根袋外,可能说明变形菌门比较适应木薯根域内根际分泌物丰富的区域。而根域内相对减少的细菌有5个门6个纲,包括浮霉菌门及其下属的Planctomycetia等3個纲,绿弯菌门及其下属的Ktedonobacteria纲,柔膜菌门(Tenericutes) 及其唯一下属的柔膜菌纲(Mollicutes)、厚壁菌门(Firmicutes),还有硝化螺旋菌门及其下属唯一的纲。不同的物种根际微生物特征不一致,如杨美玲等[28]的研究表明裕民红花根际土壤的放线菌门、变形菌门、厚壁菌门、酸杆菌门、芽单胞菌门等;叶文雨等[29]的研究结果表明,菌草根际土检测到细菌类群主要的优势菌门为酸杆菌门、变形菌门、放线菌门、厚壁菌门等。赵悦[30]的研究发现转BT基因棉花根分泌物进入土壤后提高了绿弯菌和酸杆菌相对丰度,降低了变形菌和放线菌的相对丰度。艾超[31]发现小麦根际碳沉积分解转化过程中变形菌和放线菌发挥了关键作用,而根际酸杆菌、绿弯菌、厚壁菌、拟杆菌主要参与土壤有机质的分解。而根系分泌物的数量与质量是影响根际细菌群落的重要因素[29],木薯根域土壤微生物的特征还需要更深入的研究。 表现出品种间差异的细菌共有1个、6个纲,包括硝化螺旋菌门、硝化螺旋菌纲、δ变形菌纲、全噬菌纲、索利氏菌纲、Chitinophagia纲,鞘脂杆菌纲,前面5个纲相对丰度大小均为SC205> GR4,最后一个相反。其中硝化螺旋菌门下仅有一个属即硝化螺旋菌属,作为硝化细菌(Nitrifier),可将亚硝酸盐氧化成硝酸盐[32],这是反硝化作用的一个步骤。该属同时表现出了品种差异和根袋内外差异。根袋内外差异的差异可能是由于氧化还原电位的差异,或者受到根际的影响。有研究认为:根分泌物刺激细菌的呼吸作用和根呼吸作用增强所导致O2分压的下降,是所观察到活根刺激反硝化作用加强的原因[33]。而根袋内品种间的差异则很可能暗示了品种对根际氮利用的差异。不同木薯品种对氮的吸收的差异可能反应在根际微生物上,可继续深入研究证实。而全噬菌纲、索利氏菌纲属于酸杆菌门,而酸杆菌门是一种寡营养的细菌[34],寡营养细菌的相对丰度很可能与根系分泌物的量和成分有关系,需要进一步研究。 另外,细菌中出现的浮霉菌门是一小门水生细菌,在海水、半咸水、淡水中都可被发现;绿弯菌门是兼性厌氧生物,在光合作用中不产生氧气,不能固氮,在本研究中较大量出现(相对丰度2.750%±0.576%~5.342%);还有适宜水生和土壤环境的疣微菌门,以及极低丰度的能进行产氧气光合作用的蓝细菌,并有极微量的蓝藻门。这些细菌门类的出现的对本研究的培养环境的反应:该试验在室外进行,盆内雨水容易聚集。但根袋内土壤很可能受到根系影响,减少了浮霉菌门和绿弯菌门等的相对丰度,即减少了培养环境的影响。细菌中出现的适宜水生和可光合作用的细菌包括浮霉菌门、绿弯菌门、疣微菌门、蓝细菌、蓝藻门等,是对试验环境的反应。 表现出品种间差异的细菌属有6个:黄杆菌(Flavisolibacter,0.003%-0.083%),Candidatus Solibacter(0.009%~9.069%),Kutzneria,Holophaga,Niastella(0.008%~0.223%),Legionella(0.003%~0.068%),且均为SC205>GR4。其中Holophaga下属有细菌种可以降解甲氧基化芳香化合物[35]。品种间存在差异的细菌很可能与根系分泌物的差异有关。 表现出品种间差异的细菌属有6个,包括Flavisolibacter(0.003%~0.083%),Candidatus Solibacter(0.009%~9.069%),Kutzneria,Holophaga,Niastella(0.008%~0.223%),Legionella(0.003%~0.068%),且均为SC205大于GR4。表现出根袋内外差异的细菌属有39个,其中根袋内小于根袋外有30个,T7GR4 GR4根域特有6个细菌种,包括有酸土环脂芽孢杆菌,噬几丁质菌属(Chitinophaga sp.BHS15)等,SC205根域则仅独有1个細菌种:Novosphingobium sp.,其为鞘脂单胞菌科下的属。鞘脂单胞菌科中的部分细菌具有降解酚类物质的功能[41]。特有种表明一定的专一性,也暗示着特殊的根系分泌物成分。 细菌α多样性结果表明2倍施氮量处理GR4根域土壤的细菌物种丰度小于SC205根域和非根际土壤。品种间的细菌多样性有所差异,苏小惠等[15]研究表明不同苎麻品种根际微生物的α多样性也有一定的差异。 总之,品种间根域细菌群落的差异暗示品种间根系分泌物的差异。 3.2 根域土壤真菌群落 各处理真菌相对丰度最高的门为子囊菌门(43.71%±11.59%~59.79%±8.05%),其次为毛霉门,担子菌门等。真菌纲共有21个,相对丰度最大的为Eurotiomycetes(36.65%),Sordariomycetes(12.89%),Dothideomycete(2.858%),Pucciniomycetes(1.656%)等。方差分析表明施肥比不施肥处理降低了木薯根域土壤壶菌门(Chytridiomycota)的相对丰度。真菌有4个纲表现出了处理间的显著差异。相对于根域土壤,2倍施氮量提高了非根际土壤中的Agaricomycetes,Geminibasidiomycetes和Microbotryomycetes纲的相对丰度,三者的相对丰度均在有施肥的根域内显著降低,说明三者对施肥和根域土壤均有相应。Chytridiomycetes纲则表现为T1SC205> T7SC205,表明2倍施氮肥会比不施氮肥显著降低根袋内该真菌纲的相对丰度。 LEfSe结果表明:哈茨木霉的相对丰度顺序为T7SC205≈T3SC205>T1SC205。说明施肥导致根袋内该真菌种相对丰度显著增加,由于该种是真菌的优势种群,很可能表明该真菌种与木薯根域环境内的肥料转化有关。哈茨木霉也是益生菌,能促进植物生长,也对植物病虫害有一定的防治效果[42-44]。哈茨木霉在木薯根域的出现暗示着其可能在木薯根域起作用,添加含有哈茨木霉的菌剂可能对木薯有一定的作用,需要进一步的研究。 3.3 根域土壤微生物α多样性 真菌α多样性则表现出了粘土1倍施氮量比2倍处理的物种丰度高,无论是属还是种水平,根袋内或者根袋外。Chao1指标还支持2倍施氮量的真菌物种丰度比不施肥的低。总之,本研究中施肥或者施2倍氮肥减少了真菌物种丰度。这与其它研究得到的结论有异同,如单施化肥增加了红壤真菌种群丰度与多样性,但是对细菌的种群丰度与多样性影响不大[45]。Zhou 等[46]研究发现对东北黑土增施用氮肥和氮、磷肥配施可增加真菌数量,降低真菌多样性。丁建莉等[47]的研究结果表明,施化肥对黑土中真菌多样性影响不显著,对真菌丰度也没有显著影响。聂三安等[48]研究表明黄泥田水稻土三个处理(不施肥CK、单施化肥NPK、化肥配施秸秆NPKS)的细菌α多样性的Shannon和Simpson指数无显著性差异,但NPK处理的Chao1和ACE指数均显著低于CK和NPKS处理。真菌的4个α多样性指数均表现为NPK处理显著低于CK和NPKS处理。可见,施肥处理对土壤微生物多样性指标因土壤和作物等有所差异。 参考文献 [1] Nihorimbere V,Ongena M,Smargiassi M,et al. Beneficial effect of the rhizosphere microbial community for plant growth and health [J]. Biotechnology,Agronomy,Society and Environment,2011,15(2):327-337. [2] Berg G,Smalla K.Plant species and soil type cooperatively shape the structure and function of microbial communities in the rhizosphere[J].FEMS Microbiol Ecology,2009,68(1):1-13. [3] Garbeva P,Van Veen J A,Van Elsas J D.Microbial diversity in soil: selection of microbial populations by plant and soil type and implications for disease suppressiveness[J].Annual Review of Phytopathology,2004,42:243-270. [4] Broeckling C D,Broz A K,Bergelson J,et al.Root exudates regulate soil fungal community composition and diversity [J]. Applied and Environmental Microbiology,2008,74(3):738-744. [5] 周文杰,吕德国,秦嗣军.植物与根际微生物相互作用关系研究进展[J].吉林农业大学学报,2016,38(3):253-260. [6] 王学翠,童晓茹,温学森,等.植物与根际微生物关系的研究进展[J].山东科学,2007(6):40-44,50. [7] 刘珊珊,韦鑫,盛福瑞,等.棉花不同发育时期根际微生物的动态变化[J].浙江农业学报,2019,31(8):1361-1371. [8] 颜朗,张义正,清源,等.马铃薯全生育期内根际微生物组变化规律[J]. 微生物学报,2020, 60(2):246-260. [9] 安曈昕,湛方栋,李旺,等.旱坡地间作群体对作物根际微生物数量的影响[J].干旱地区农业研究,2017,35(5):102-106,150. [10] 李建鹃,罗扬,周柳婷,等.连栽木麻黄根际微生物群落结构和功能特征[J].森林与环境学报,2020,40(1):9-15. [11] 李依韦,毕佳欣,袁琴,等.不同施肥处理玉米根际微生物种群结构及代谢多样性[J].中国微生态学杂志,2020,32(1):21-24,30. [12] 李金婷,黄少欣,韦持章,等.不同氮素营养水平对茶树根际土壤微生物的影响及其在养分调控中的作用[J]. 华北农学报,2019,34(S1):281-288. [13] 刘松涛,田春丽,曹雯梅,等.基于不同土壤质地棉花根际微生物和酶活性特征分析[J]. 中国农业科技导报,2020,22(2):73-79. [14] 王孝林,王二涛.根际微生物促进水稻氮利用的机制[J].植物学报,2019,54(3):285-287. [15] 苏小惠,白玉超,佘玮,等.不同苎麻品种根际微生物多样性群落结构分析[J].中国麻业科学,2019,41(3):114-121. [16] 李强,孙敬钊,皮本阳,等.不同品种烤烟根际微生物群落结构及多样性研究[J].安徽农业科学,2018,46(30):160-163. [17] 唐秀梅,钟瑞春,蒋菁,等.木薯/花生间作对根际土壤微生态的影响[J].基因组学与应用生物学,2015,34(1):117-124. [18] 徐海強,黄洁,刘子凡,等.木薯/花生间作对其根际土壤微生物数量、群落结构及多样性的影响[J].南方农业学报,2016,47(2):185-190. [19] Riley D,Barber S A . Bicarbonate accumulation and pH changes at the soybean (Glycine max (L.) Merr.) root-soil interface [J]. Soil Science Society of America Journal,1969,33(6):905-908. [20] Riley D,Barber S A. Salt accumulation at the soybean (Glycine max (L.) Merr.) root-soil interface[J]. Soil Science Society of America Journal,1970,34:154-155. [21] Steen E. Usefulness of the mesh bag method in quantitative root studies. In:Atkinson D,ed. Plant root growth in an ecological perspective [M]. Blackwell,Oxford,1991. [22] 蔡昆爭,骆世明,段舜山. 水稻根系在根袋处理条件下对氮养分的反应[J]. 生态学报,2003,23(6):1109-1116. [23] Hov J R,Zhong H,Qin B,et al. The influence of the autoimmunity-associated ancestral HLA haplotype AH8.1 on the human gut microbiota: a cross-sectional study [J]. PLoS one. 2015,10(7):0133804. [24] Ma J,Wang Z,Li H,et al. Metagenomes reveal microbial structures,functional potentials,and biofouling-related genes in a membrane bioreactor[J]. Applied Microbiology and Biotechnology 2016,100(11):5109-5121. [25] Segata N,Izard J,Waldron L,et al. Metagenomic biomarker discovery and explanation[J]. Genome Biology,2011,12(6):R60. [26] Doumbou CL, Salove MKH, Crawford DL, et al. Actinomycetes, promising tools to control plant diseases and to promote plant growth[J]. Phytoprotection, 2001, 82(3): 85-144. [27] Tokala RK,Strap JL,Jung CM,et al. Novel plant-microbe rhizosphere interaction involving Streptomyces lydicus WYEC108 and the pea plant (Prisum sativum)[J]. Applied and Enviromental Microbiology,2002,68(5):2161-2171. [28] 杨美玲,张霞,王绍明,等.基于高通量测序的裕民红花根际土壤细菌群落特征分析[J].微生物学通报,2018,45(11): 2429-2438. [29] 叶文雨,廖海萍,许钰滢,等.基于高通量测序技术分析2种菌草根际土壤细菌群落多样性[J]. 热带作物学报,2019,40(09):1783-1788. [30] 赵悦.转Bt基因抗虫棉根分泌物对土壤N转化的影响及机制[D].武汉:华中农业大学,2016. [31] 艾超. 长期施肥下根际碳氮转化与微生物多样性研究[D].北京:中国农业科学院,2015. [32] Ehrich S,Behrens D,Lebedeva E,et al. A New obligately chemolithoautotrophic,nitrite-oxidizing bacterium,Nitrospira moscoviensis sp. nov. and its phylogenetic relationship [J].Archives Microbiology,1995,164(1):16-23. [33] Klemedtsson L,Svensson B H,Rosswall T. Dinitrogen and nitrous oxide produced by denitrification and nitrification in soil with and without barley plants [J].Plant and Soil,1987,99(2-3):303-319. [34] Fierer N,Lauber C L,Ramirez K S,et al.Comparative metagenomic,phylogenetic and physiological analyses of soil microbial communities across nitrogen gradients [J].The ISME Journal,2012,6(5):1007-1017. [35] Liesack W,Bak F,Kreft JU,et al. Holophaga foetida gen. nov., sp. nov., a new, homoacetogenic bacterium degrading methoxylated aromatic compounds [J]. Archives of microbiology,1994,162(1-2):85-90. [36] 蔡训辉,王如意,胡胜男,等.鞘氨醇杆菌的研究进展[J/OL].基因组学与应用生物学:1-9[2020-03-10].http://kns.cnki.net/kcms/detail/45.1369.Q.20190110.1330.004.html. [37] 杜思瑶,于淼,刘芳华,等.设施种植模式对土壤细菌多样性及群落结构的影响[J].中国生态农业学报,2017, 25(11): 1615-1625. [38] 闫杨,刘月静,陈芳.枯草芽孢杆菌的应用现状概述[J].生物学教学,2019,44(2):2-3. [39] 黎妍妍,王林,彭五星,等.解淀粉芽孢杆菌施用方式对烟株根际土壤真菌群落的影响[J].中国烟草科学,2020,41(4):1-6. [40] 毛露甜,林晓霖,麦景,等.青枯病拮抗菌筛选及其生防菌剂研制[J]. 惠州学院学报,2019, 39(6):53-57. [41] 聂铭. 不同连作年限地黄生长生理特性及其根区土壤化感物质研究[D].郑州:河南农业大学,2017. [42] 车永梅,赵方贵,陈同金,等.AM真菌、木霉和PGPR组合的促生效应研究[J].青岛农业大学学报(自然科学版),2019,36(2):95-102. [43] 朱洪江,王勇,刘东阳,等.哈茨木霉对烟草青枯病田间控制效果及生物学性状的影响[J].植物医生,2019,32(5):26-31. [44] Wang ZS, Li Y, Zhuang LB, et al. A Rhizosphere-Derived Consortium of Bacillus subtilis and Trichoderma harzianum Suppresses Common Scab of Potato and Increases Yield[J]. Computer Structure Biote- chnology Journal, 2019, 17:645-653. [45] 于冰,宋阿琳,李冬初,等.長期施用有机和无机肥对红壤微生物群落特征及功能的影响[J].中国土壤与肥料,2017(6):58-65. [46] Zhou J,Jiang X,Baoku Z,et al. Thirty four years of nitrogen fertilization decreases fungal diversity and alters fungal community composition in black soil in northeast China[J]. Soil Biology and Biochemistry,2016,95:135–143. [47] 丁建莉,姜昕,马鸣超,等.长期有机无机肥配施对东北黑土真菌群落结构的影响[J].植物营养与肥料学报,2017,23(4):914-923. [48] 聂三安,赵丽霞,王祎,等.长期施肥对黄泥田土壤微生物群落结构和多样性的影响[J].农业现代化研究,2018,39(4):689-699.
