诊疗一体化胶质瘤靶向纳米粒增效声动力治疗及多模态显像:体外实验研究
2021-05-31刘姝伶郭大静冉海涛钟毅欣侯静馨王俊锐
刘姝伶,郭大静,冉海涛,钟毅欣,侯静馨,王俊锐,张 维*
(1.重庆医科大学附属第二医院放射科,重庆 400010;2.超声分子影像重庆市重点实验室,重庆 400010)
胶质瘤呈浸润性生长,手术难以完全切除,加之其渗透增强、滞留较弱及血脑屏障(blood-brain barrier, BBB)等因素,导致化学治疗药物不能有效聚集于肿瘤部位[1-2],手术切除辅以放射、化学治疗,总体预后仍不容乐观。基于纳米医学诊疗方法已在胶质瘤研究中崭露头角[3-4]。声动力治疗(sonodynamic therapy, SDT)具有非侵入性、深组织穿透性和高度聚焦性等优点,用于治疗深部肿瘤应用前景广阔[5-8];但传统有机声敏剂不能有效聚集于肿瘤部位,分子生物利用度低,导致SDT治疗效果较低而阻碍其临床推广[9]。多模态显像是当前影像学技术的发展趋势[10]。本研究以聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid), PLGA]为载体,包载具有肿瘤细胞靶向能力的荧光材料(IR780)和相变材料全氟戊烷(perfluoropentane, PFP),构建靶向诊疗一体化多模态显像纳米粒(IR780-PFP@PLGA),并观察其体外胶质瘤细胞靶向能力、多模态显像及体外增效SDT效果。
1 材料与方法
1.1 主要试剂和仪器 PLGA(分子量12 000 Da,聚合比50∶50,济南岱罡生物科技有限公司);IR780、PFP、2’,7’-二氯荧光黄双乙酸盐(DCFH-DA),美国Sigma 公司;单线氧荧光探针(SOSG,美国Thermo Fisher公司);线粒体膜电位检测试剂盒(JC-1,中国碧云天公司);钙黄绿素/碘化丙啶(Calcein-AM/PI,日本同仁公司)。Sonics 630-0435声振仪,Malvern Zetasizer Nano ZS90粒径测量仪,Hitachi S-3400N透射电子显微镜,岛津UV2500 UV-VIS紫外可见分光光度计,低强度聚焦超声(low-intensity focused ultrasound, LIFU)治疗仪,Lecia TCSSP2 激光共聚焦显微镜,Visual Sonics Vevo LAZR光声成像系统,PerkinElmer IVIS Lumina Series Ⅲ活体荧光成像仪,U87细胞株(人脑胶质瘤细胞)购自中国上海细胞库。
1.2 IR780-PFP@PLGA制备 采用双乳化法。称取50 mg PLGA和2 mg IR780加入2 ml CH2Cl2溶液并充分溶解,冰浴条件下向混合液中加入200 μl PFP,以声振仪乳化3 min(50 W,振5 s停5 s)得到初乳,再加入8 ml 4% PVA进行第2次乳化,加入10 ml 2%异丙醇溶液混合均匀后置于磁力搅拌器冰浴下搅拌3 h,至有机溶剂完全挥发。4℃离心(10 000 rpm,5 min)洗涤数次,去除未包载的IR780,得到IR780-PFP@PLGA。制备过程中不加IR780或PFP,得到PFP@PLGA或IR780@PLGA。
1.3 基本特征检测 将制备好的IR780-PFP@PLGA用双蒸水适当稀释后,于透射电子显微镜、激光共聚焦显微镜下观察其形态、分布特征及内部结构等。用粒径仪检测其粒径、分布及表面电位,并监测粒径及电位变化7天。采用紫外分光光度计检测不同浓度(0、1、2…9、10 μg/ml)IR780的吸光度,并根据最大吸收峰处吸光度绘制标准曲线。以紫外分光光度计记录IR780、PFP@PLGA、IR780-PFP@PLGA的吸收光谱。对IR780-PFP@PLGA行低温离心,直至澄清后取上清液测定吸光度,根据标准曲线计算IR780包封率。
1.4 体外多模态显像
1.4.1 光声(photoacoustic, PA)显像 取200 μl IR780-PFP@PLGA纳米粒水溶液加入2%琼脂糖凝胶模型中,以PA成像系统行全波长扫描(波长680~970 nm,步长5 nm),寻找其PA显像最佳激发波长。将不同浓度(0.1、0.2、0.4、0.8、1.6 mg/ml)IR780-PFP@PLGA水溶液(200 μl)加入凝胶模型中,以最佳激发波长激光辐照后采集PA图像,定量分析PA信号值。
1.4.2 超声(ultrasound, US)显像 取1 ml IR780-PFP@PLGA水溶液(1 mg/ml)置于10 ml EP管内,经LIFU(2 W/cm2)辐照(0、5、10、15、20 min)后转移至2%凝胶模型中,用US成像系统采集B模式和造影模式超声声像图,以灰度量化分析软件分析各靶区声强值。
1.4.3 荧光(fluorescence, FL)显像 将IR780-PFP@PLGA配置成不同浓度(0.1、0.2、0.4、0.8、1.6 mg/ml)水溶液,分别取200 μl加入96孔板中。用活体荧光成像系统、激发波长/发射波长为780 nm/850 nm进行扫描,以系统自带软件勾画ROI,并测量荧光信号强度值。
1.5 细胞毒性及体外寻靶实验
1.5.1 细胞毒性实验 将U87细胞接种于96孔板,24 h后弃掉旧培养基,分别加入100 μl不同浓度(0、10…90、100 μg/ml)IR780-PFP@PLGA完全培养基稀释液,每组3个复孔,共孵育24 h,以 CCK-8检测细胞存活率。
1.5.2 体外寻靶实验 将U87细胞接种于共聚焦培养皿内,24 h后弃掉旧培养基,加入1 ml含DiI标记的PFP@PLGA或IR780-PFP@PLGA(60 μg/ml)完全培养基稀释液共同孵育(0.5、1.0、1.5 h)。以磷酸盐缓冲液(phosphate buffer solution, PBS)洗3次,加入100 μl DAPI溶液染色10 min,再以PBS冲洗,于激光共聚焦显微镜下观察。
1.6 体外增效SDT效果
1.6.1 SOSG检测活性氧(reactive oxygen species, ROS) 以SOSG为ROS指示剂,将IR780-PFP@PLGA稀释至不同浓度(100、200、300、400、500 μg/ml),各取200 μl与适量SOSG甲醇溶液充分混匀。以强度为2 W/cm2的LIFU辐照1 min后,用M3型多功能酶标仪检测其荧光强度,激发波长/发射波长为488 nm/525 nm。
1.6.2 DCFH-DA法检测细胞内ROS 将U87细胞接种于共聚焦培养皿内,24 h后随机分为4组,即对照组、IR780-PFP@PLGA组、LIFU组及IR780-PFP@PLGA+LIFU组;纳米粒浓度60 μg/ml,孵育时间1.5 h,LIFU强度2 W/cm2(1 min)。处理后立即加入DCFH-DA探针继续孵育30 min,以PBS洗涤3次后在激光共聚焦显微镜下观察。
1.6.3 JC-1法检测线粒体膜电位 将U87细胞接种于6孔板内,分组同1.6.2。行JC-1染色后,以流式细胞仪检测线粒体膜电位。
1.6.4 Calcein-AM/PI染色观察细胞存活情况及CCK-8检测细胞存活率 将U87细胞接种于6孔板内,24 h后随机分为6组,即对照组、LIFU组、IR780-PFP@PLGA组、PFP@PLGA+LIFU组、IR780@PLGA+LIFU组及IR780-PFP@PLGA+LIFU组;纳米粒浓度60 μg/ml,孵育1.5 h后,以PBS洗涤3次,LIFU(2 W/cm2,1 min)辐照后加入200 μl Calcein-AM/PI染色15 min,以PBS洗去多余染料,用荧光显微镜观察细胞存活情况。将U87细胞接种于96孔板24 h后分组同上,每组3个复孔,处理后继续孵育1~2 h,采用CCK-8检测细胞存活率。
1.7 统计学分析 采用GraphPad Prism 7统计分析软件。计量资料以±s表示,多组间比较采用单因素方差分析,两两比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 基本特性 IR780-PFP@PLGA在透射电镜下呈大小均匀的圆形,中心颜色较淡(图1A);激光共聚焦显微镜下呈均匀红色颗粒(图1B);其粒径为(240.67±1.30)nm(图1C),电位为(-9.50±0.06)mV (图1D),且稳定性在7天内保持良好(图1E、1F)。IR780最大吸收峰在近780 nm处,吸光度随浓度升高而增加(图1G、1H);紫外吸收光谱显示其保留了IR780的特征吸收峰(图1I),IR780包封率为(92.03±0.42)%。
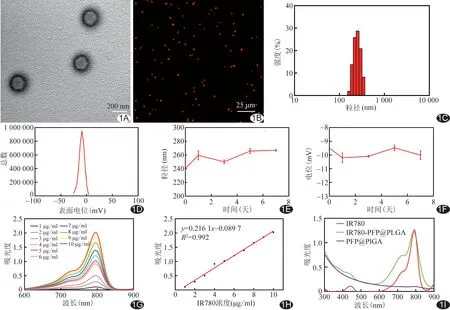
图1 IR780-PFP@PLGA基本表征 A.透射电镜图; B.激光共聚焦图; C.粒径分布图; D.电位分布图; E.粒径稳定性; F.电位稳定性; G.IR780紫外可见光谱图; H.IR780标准曲线; I.紫外吸收光谱
2.2 体外多模态显像 PA显像显示IR780-PFP@PLGA在785 nm处PA信号最强,在此波长激发下,PA信号随浓度递增逐渐增强(图2A),呈线性改变(图2B)。US显像显示IR780-PFP@PLGA经LIFU辐照后,B模式和造影模式回声随时间延长,开始逐渐增强,再逐渐减弱(图2C),定量分析结果证实B模式和造影模式回声强度均随时间延长先上升再下降,且最强回声强度均在15 min(图2D、2E)。FL显像显示随IR780-PFP@PLGA浓度增加,FL信号强度逐渐增强(图2F、2G)。
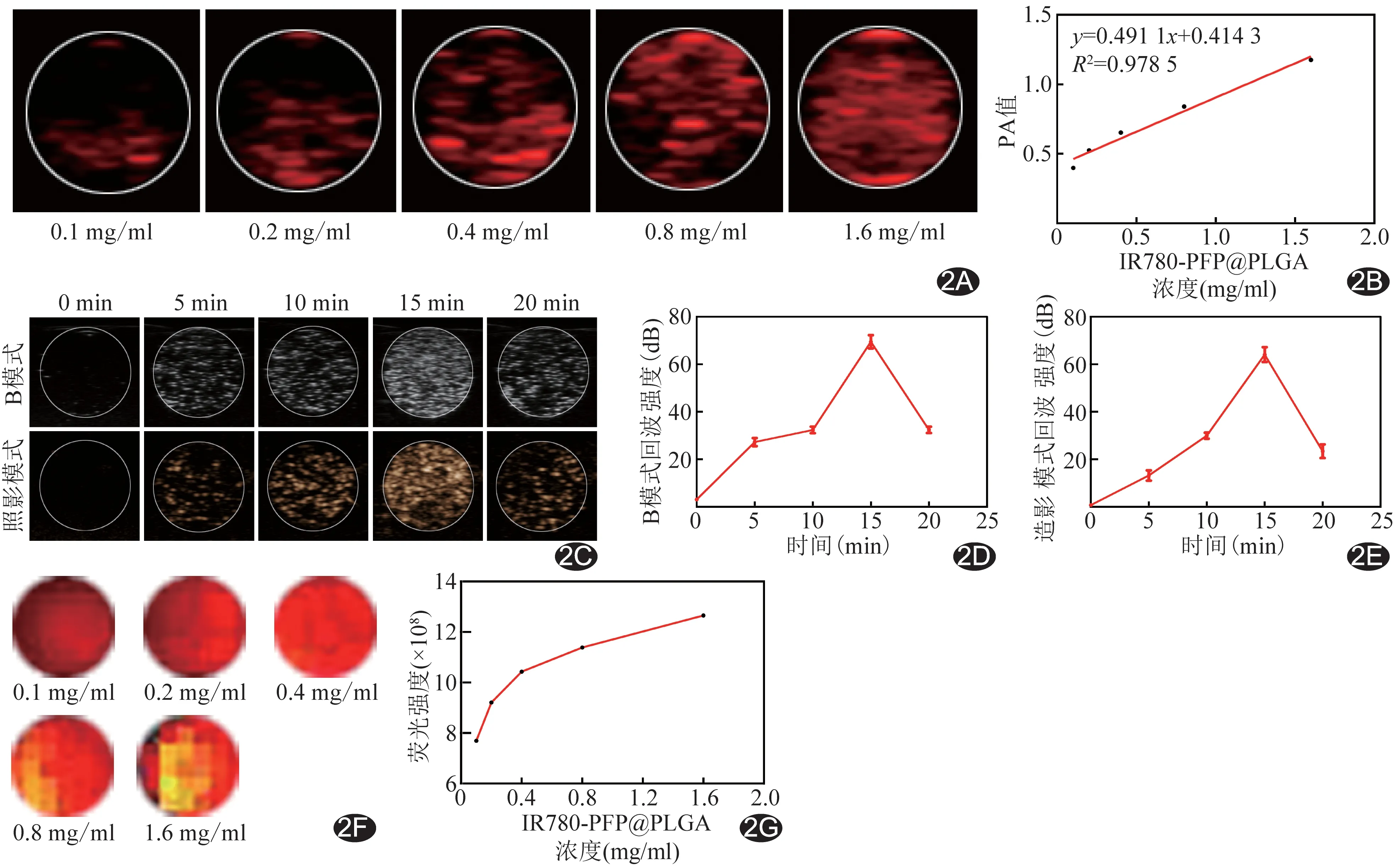
图2 IR780-PFP@PLGA多模态显像 A.体外PA显像图; B.不同浓度PA值变化图; C.不同LIFU辐照时间体外US显像图; D.不同LIFU辐照时间B模式回声强度值变化图; E.不同LIFU辐照时间造影模式回声强度值变化图; F.体外FL显成像图; G.不同浓度FL强度值变化图
2.3 细胞毒性及体外寻靶实验 浓度在10~60 μg/ml之间的IR780-PFP@PLGA与U87细胞共孵育24 h后,细胞存活率均高于90%(P>0.05,图3)。共聚焦图显示,靶向组(IR780-PFP@PLGA)细胞膜周围及细胞质内大量纳米粒聚集,且随时间延长逐渐增多;而非靶向组(PFP@PLGA)仅细胞膜周围见少量纳米粒聚集(图4)。
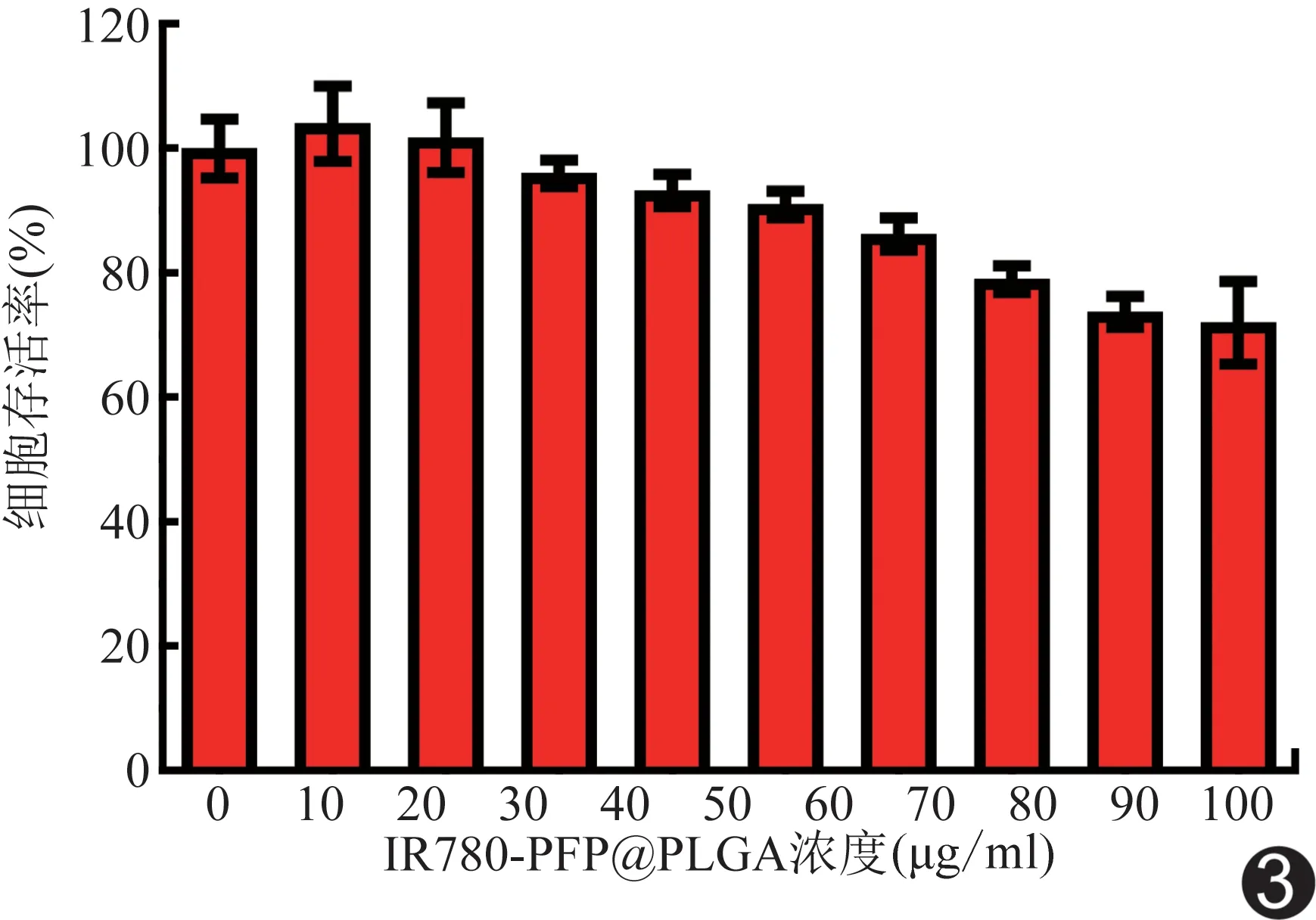
图3 IR780-PFP@PLGA对U87细胞的毒性
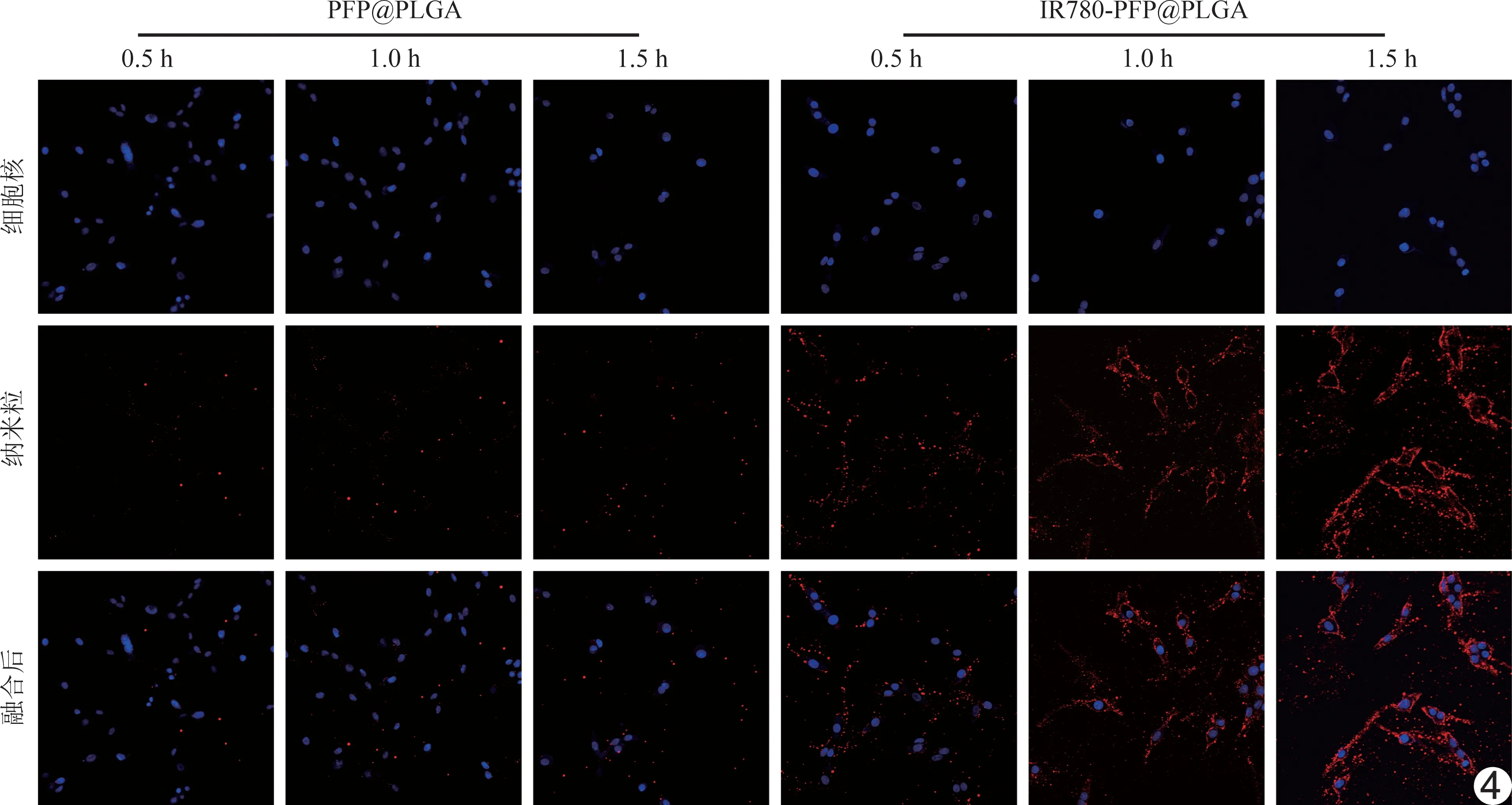
图4 IR780-PFP@PLGA对U87细胞的主动靶向能力(×400)
2.4 体外增效SDT效果 SOSG实验显示,经LIFU (2 W/cm2,1 min)辐照后,随IR780-PFP@PLGA浓度增加,产生的ROS逐渐增多 (P<0.05,图5)。DCFH-DA染色显示,对照组、IR780-PFP@PLGA组和LIFU组绿色荧光均不明显,而IR780-PFP@PLGA+LIFU组细胞内绿色荧光明显增强(图6)。JC-1流式结果(图7)显示IR780-PFP@PLGA+LIFU组线粒体膜电位明显低于对照组、IR780-PFP@PLGA组及LIFU组(P均<0.05)。Calcein-AM/PI 双染结果显示IR780-PFP@PLGA+LIFU组大量细胞死亡,呈红色荧光;IR780@PLGA+LIFU组次之;其他各组均可见大量细胞存活,呈绿色荧光(图8)。CCK-8检测结果显示IR780-PFP@PLGA+LIFU组细胞存活率[(31.12%±3.93)%]低于IR780@PLGA+LIFU组[(55.65%±5.77)%](P<0.05),二者均低于对照组(P均<0.05),其余各组与对照组差异均无统计学意义(P均>0.05)。
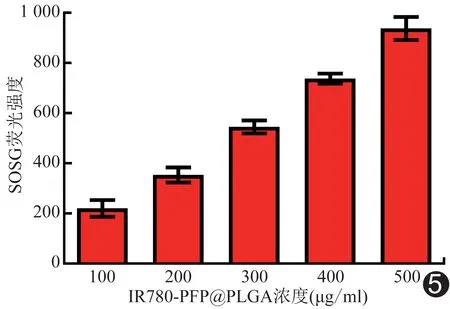
图5 不同浓度LIFU辐照后SOSG荧光强度变化
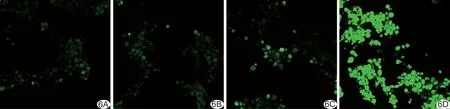
图6 不同治疗组LIFU辐照后细胞内DCFH-DA荧光激光共聚焦图(×400) A.对照组; B.IR780-PFP@PLGA组; C.LIFU组; D.IR780-PFP@PLGA+LIFU组
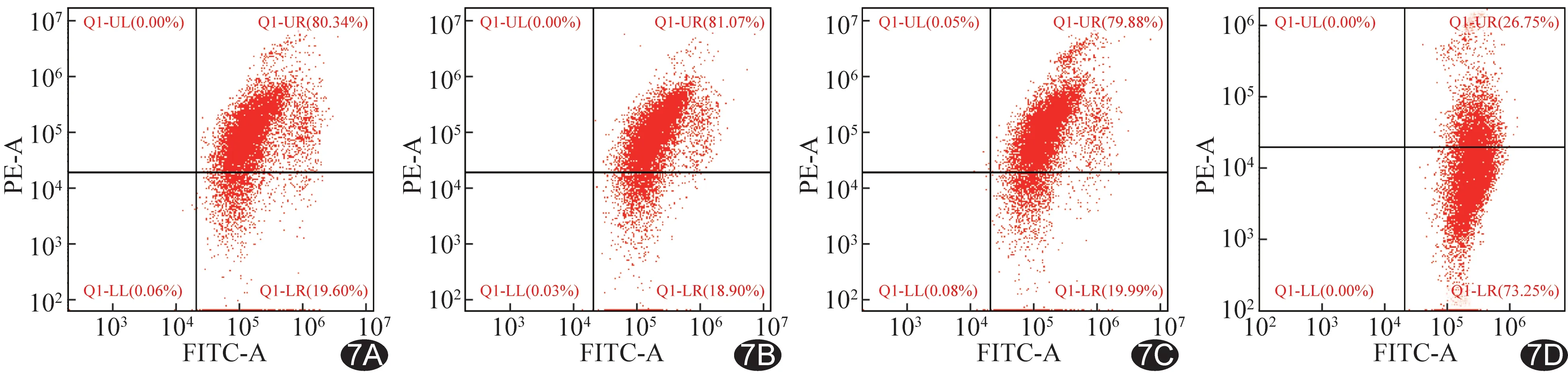
图7 不同治疗组流式JC-1分析 A.对照组; B.IR780-PFP@PLGA组; C.LIFU组; D.IR780-PFP@PLGA+LIFU组
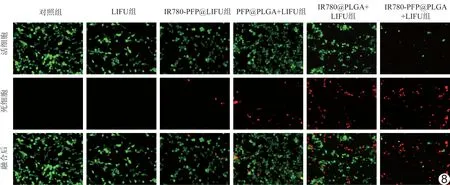
图8 不同治疗组Calcein-AM/PI双染荧光显微镜图(×200)
3 讨论
SDT利用US触发声敏剂,通过诱导单线态氧和羟基自由基等高毒性ROS生成,进而产生直接杀伤肿瘤细胞和间接诱导肿瘤细胞凋亡等一系列抗肿瘤作用,以治疗肿瘤[11]。超声波能量可高度聚焦,并传递到大脑深处区域[12],使SDT用于治疗胶质瘤具有巨大潜能。为提高针对颅内病变的药物输送效率,近年来探索通过超声靶向微泡破坏(ultrasound-targeted microbubble destruction, UTMD)技术可逆性开放BBB[13-14]而提高疗效。
作为一种声敏剂,IR780在近红外区的吸收较强,可用于PA和FL显像[15];同时,作为一种亲脂性阳离子,IR780可通过肿瘤细胞线粒体膜电位和有机阴离子转运肽等介导,在不添加任何特异性配体的前提下选择性聚集于肿瘤部位[16]。PFP经超声辐照可发生声致相变,按需生产微泡,不仅可增强US成像,且其声致相变(acoustic droplet vaporization, ADV)有利于纳米粒渗透到肿瘤深部以增强疗效。ADV发生在BBB时,BBB通过UTMD技术而被可逆性打开,有利于药物跨越BBB。
本研究利用兼具肿瘤细胞靶向能力和多模态显像的声敏剂IR780及相变材料PFP,制备的IR780-PFP@PLGA大小均匀,分散性好。PFP电子密度较低,透射电镜显示纳米粒中心颜色较淡;共聚焦显微镜下其呈红色颗粒,紫外吸收光谱显示IR780-PFP@PLGA保留了IR780的特征吸收峰,提示IR780成功包载于PLGA内。共聚焦显微镜观察结果显示,与PFP@PLGA相比,IR780-PFP@PLGA能更多、更快地聚集于U87细胞,提示其具有较强的U87细胞靶向性。US显像中,经LIFU辐照后,随时间延长,回声强度先逐渐增强再减弱,表明纳米粒在LIFU辐照后逐渐发生液-气相变,使US显像增强;但辐照一定时间后产生的微泡逐渐破裂,导致回声强度减弱。
DCFH-DA染色显示IR780-PFP@PLGA+LIFU组绿色较其他组明显,表明细胞内产生了大量ROS。JC-1法检测显示IR780-PFP@PLGA+LIFU组细胞线粒体膜电位较其他组明显降低,提示大量细胞凋亡。Cacein-AM/PI染色及CCK-8检测中,LIFU组、IR780-PFP@PLGA组及PFP@PLGA+LIFU组与对照组差异均无统计学意义,表明单独LIFU、纳米粒及ADV效应对细胞存活无明显影响;而IR780-PFP@PLGA+LIFU组较IR780@PLGA+LIFU组细胞死亡数量明显增加,提示PFP所致AVD效应可增强SDT杀伤效果。
总之,本研究成功构建的靶向诊疗一体化IR780-PFP@PLGA可用于PA/US/FL多模态显像,具有较强胶质瘤细胞靶向能力和良好的增效SDT效果,有望用于多模态显像指导下早期诊断、靶向精准治疗脑胶质瘤和评估疗效。但本实验对ADV增效SDT具体机制及UTMD技术对BBB的作用研究不足,有待进一步探讨。
