18F-AlF-NOTA-octreotide联合18F-FDG PET/CT显像用于神经内分泌瘤
2021-05-31冯洪波宫晓艳杜雪梅
陈 博,冯洪波,宫晓艳,杜雪梅
(大连医科大学附属第一医院核医学科,辽宁 大连 116011)
神经内分泌瘤(neuroendocrine tumors, NET)是一组起源于肽能神经元和神经内分泌细胞的肿瘤,以往认为其发病率仅为1/100 000,但最新流行病学调查显示,近20年来NET发病率上升了7倍[1]。18F-FDG显像可作为NET治疗前评估的基础。大部分NET细胞表面表达生长抑素受体(somatostatin receptor, SSTR),利用PET/CT进行功能成像,可同时实现瘤内STTR靶向分子成像。68Ga标记生长抑素类物PET/CT显像已成为NET诊疗指南性准则[2],但68Ge/68Ga发生器产量低,同时受运输、权限等制约,其临床应用受限。18F是目前PET显像最常用的放射性核素,其半衰期相对较长,空间分辨率较高,辐射能量较低,比活度较高,是68Ga的最佳替代。18F-AlF-NOTA-octreotide(18F-OCT)和68Ga-生长抑素类似物显像具有良好的一致性[3]。本研究观察18F-OCT和18F-FDG PET/CT联合显像用于NET的临床价值。
1 资料与方法
1.1 一般资料 回顾性收集2017年9月—2020年2月21例于大连医科大学附属第一医院同期接受18F-OCT和18F-FDG PET/CT显像的NET患者,男10例、女11例,年龄34~72岁,平均(57.5±10.7)岁;均经手术或穿刺病理学证实诊断。排除检查前1~3个月内接受放射、化学治疗及其他生物学治疗者。
1.2 合成18F-OCT 利用Siemens Eclipse RD回旋加速器和Trasis Allinone化学模块,首先将18F和前体混合溶液(包含1 ml乙腈、100 μl 2 mg/ml NOTA-octreotide溶液、280 μl pH 4醋酸缓冲液和20 μl 1 μg/μl三氧化二铝)依次置于反应瓶中加热至100℃,反应14 min后转移至HLB柱进行纯化,依次以无菌水冲洗、50%乙醇溶液洗脱、抗坏血酸钠溶液冲洗,最后将洗脱液通过0.22 μm无菌过滤器收入接收瓶。所得产品外观无色澄明,pH 4~6,放射化学纯度>95%,细菌内毒素检测合格。
1.3 PET/CT成像 检查前嘱患者禁食、禁水4~6 h,控制其空腹血糖<11.1 mmol/L;经静脉注射18F-FDG 0.15 mCi/kg,待患者静卧休息60 min后行18F-FDG显像。间隔1~12(3.35±2.96)天,检查前准备如前,经静脉注射18F-OCT 5 mCi后,待患者静卧45 min后行18F-OCT显像。均采用Siemens Biograph 64层PET/CT扫描仪,扫描范围自颅顶至大腿中上部,分别采集CT及PET图像,每个床位1.5~2.0 min,采用有序子集最大期望值法进行PET图像重建。
1.4 图像分析 由具有8年及15年以上工作经验的核医学医师各1名独立阅读PET/CT图像,有分歧时与多名高年资医师协商并达成一致。PET/CT显像判定肿瘤阳性标准:①CT示明确病变,同机PET相应部位摄取异常增高;②CT无明显形态或密度改变,同机PET摄取异常增高且高于肝脏[4]。判定转移灶标准:PET扫描出现原发灶之外的非生理性摄取,经手术、穿刺活检病理证实,或由影像学检查证实为新发病灶,以及随访3~6个月病灶明显增大或经规律抗肿瘤治疗后明显缩小。于后处理工作站选取病灶最长径作为病灶大小;手动勾画病灶3D ROI,自动获得ROI内最大标准摄取值(maximum standard uptake value, SUVmax)。
1.5 统计学分析 采用SPSS 26.0统计分析软件。以±s表示符合正态分布的计量资料,以中位数(上下四分位数)表示不符合者;采用Pearson相关分析评价病灶大小与SUVmax的相关性:│r│≥0.8高度相关性,0.5≤│r│<0.8中度相关性,0.3≤│r│<0.5低度相关性,0<│r│<0.3弱相关。以Wilcoxon秩和检验方法组内分析病灶摄取2种显像剂的差异。P<0.05为差异有统计学意义。
2 结果
21例NET中,胰腺14例,胃NET 3例,卵巢及喉NET各1例,2例原发灶不明;其中7例已接受原发瘤根治性切除术。根据2010年WHO分级标准,将12例明确存在原发瘤者分为中/低级别组9例、高级别组3例;转移灶主要分布于肝脏、骨骼、淋巴结、脑、肺、腹膜及皮下等部位。
2.1 NET原发肿瘤PET/CT显像 原发肿瘤病灶大小与18F-FDG的SUVmax呈中度正相关(r=0.731,P=0.007),与18F-OCT的SUVmax无明显相关(r=0.311,P=0.325),见图1。中/低级别组9例原发瘤中,8例18F-OCT显像阳性、7例18F-FDG显像阳性;18F-OCT 的SUVmax中位数33.80(6.10,56.55),高于18F-FDG的3.80(1.40,8.80)(Z=-2.345,P=0.019)。高级别组3例原发瘤中,18F-FDG检出3例,18F-OCT 2例。
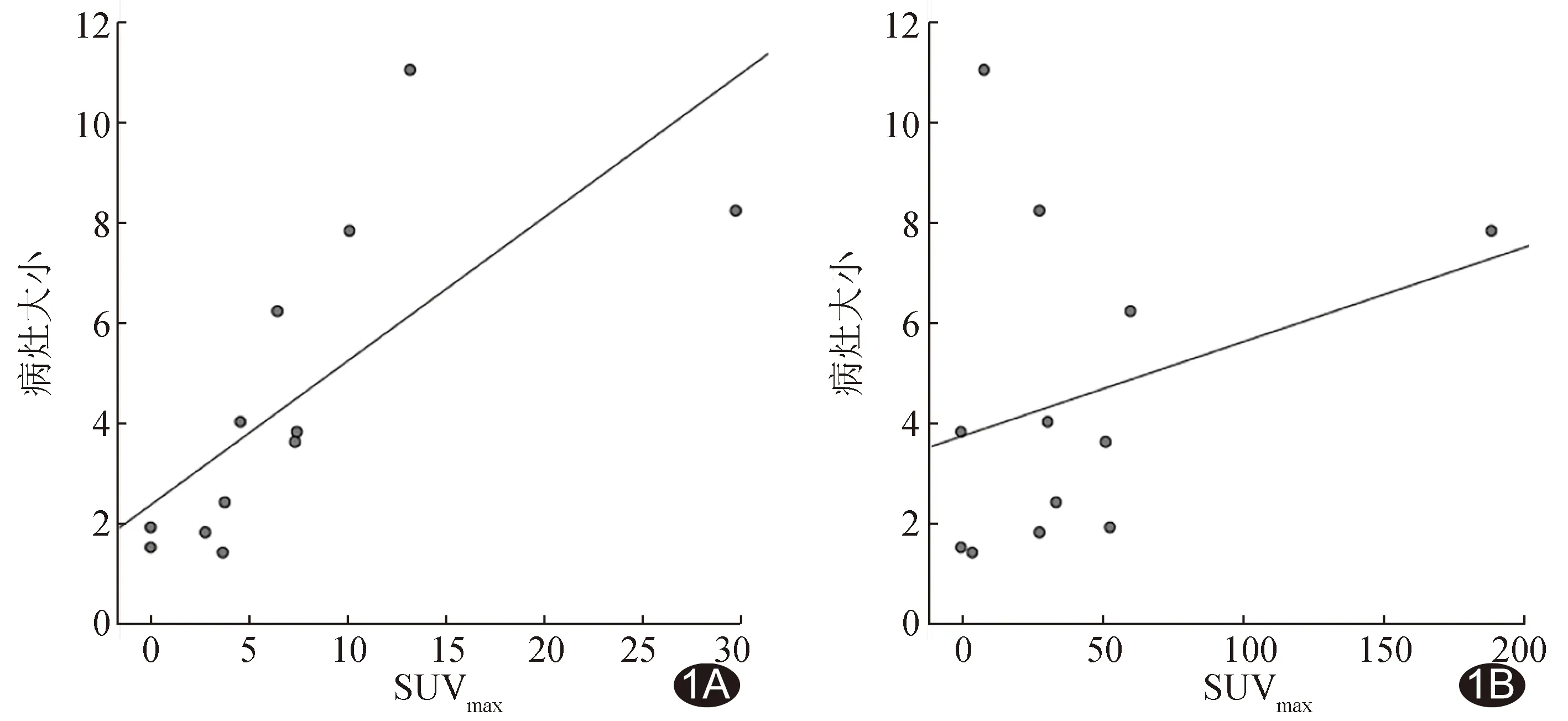
图1 NET原发灶病灶大小与SUVmax相关性的散点图 A.18F-FDG; B.18F-OCT
2.2 NET转移灶PET/CT显像18F-FDG与18F-OCT联合检出247个转移灶,位于肝脏167个、骨骼48个、淋巴结18个、皮下6个、肺5个、脑2个及腹膜种植1个;单独18F-FDG PET/CT、单独18F-OCT PET/CT显像分别检出117个、226个转移灶,对其中89个转移灶诊断一致。3例NET转移灶可见“趋异性分化”现象,即转移灶对2种显像剂摄取不完全趋同于原发肿瘤而呈现出不同程度亲和力,见图2。3例发生骨转移,均以成骨性转移为主,其在18F-OCT显像中的阳性率(48/48,100%)明显高于18F-FDG(25/48,52.08%)。1例脑转移灶和1例腹膜转移灶仅18F-OCT阳性;1例全身皮下多发转移灶,18F-FDG均为阳性(6/6,100%)而18F-OCT仅部分阳性(3/6,50%),见图3、4。
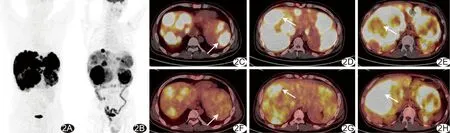
图2 患者男,34岁,18F-OCT及18F-FDG显像示胰腺G2级NET伴肝内多发占位 A.18F-OCT全身最大密度投影图; B.18F-FDG全身最大密度投影图; C、F.病灶18F-OCT明显高摄取(SUVmax为24.4,C,箭)、18F-FDG无摄取(F,箭); D、G.18F-OCT(SUVmax为25.4,D)和18F-FDG(SUVmax为6.2,G)均摄取增高(箭); E、H.18F-OCT无摄取(E,箭)而18F-FDG明显高摄取(SUVmax为24.7,H,箭)
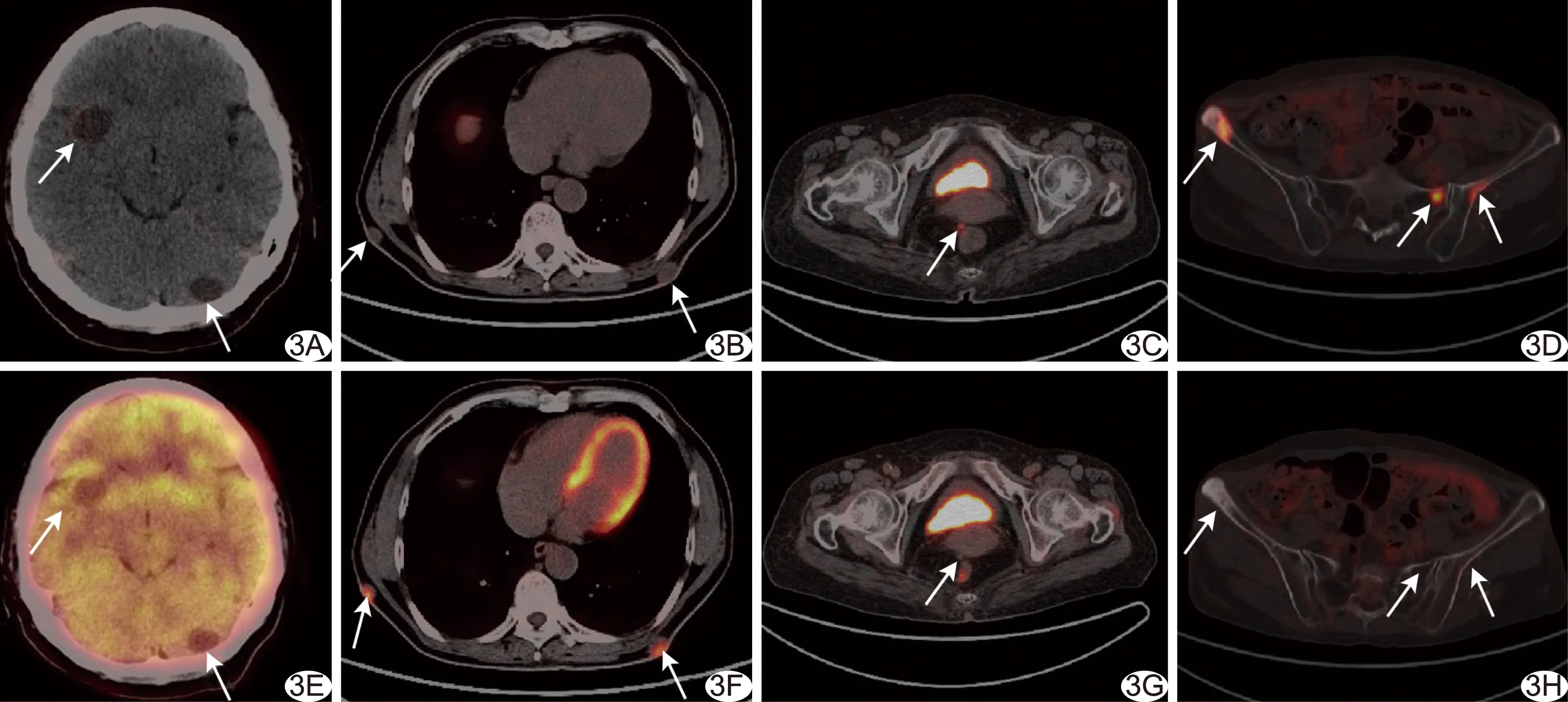
图3 18F-OCT及18F-FDG显像示NET转移灶 A、E.患者女,49岁,右侧颞叶及左侧小脑半球病灶长径分别为2.4 cm和1.7 cm,18F-OCT摄取增高(SUVmax分别为2.5和2.6,A,箭),18F-FDG无摄取(E,箭); B、F.患者男,62岁,后胸壁皮下结节,18F-OCT无摄取(B,箭)而18F-FDG明显高摄取(SUVmax为12.8,F,箭); C、G.患者女,72岁,盆腔底部转移灶长径约0.8 cm,18F-OCT摄取增高(SUVmax为11.0,C,箭)而18F-FDG无摄取(G,箭); D、H.患者男,62岁,成骨性转移灶,18F-OCT摄取增高(SUVmax为15.4,D,箭)、18F-FDG无摄取(H,箭)
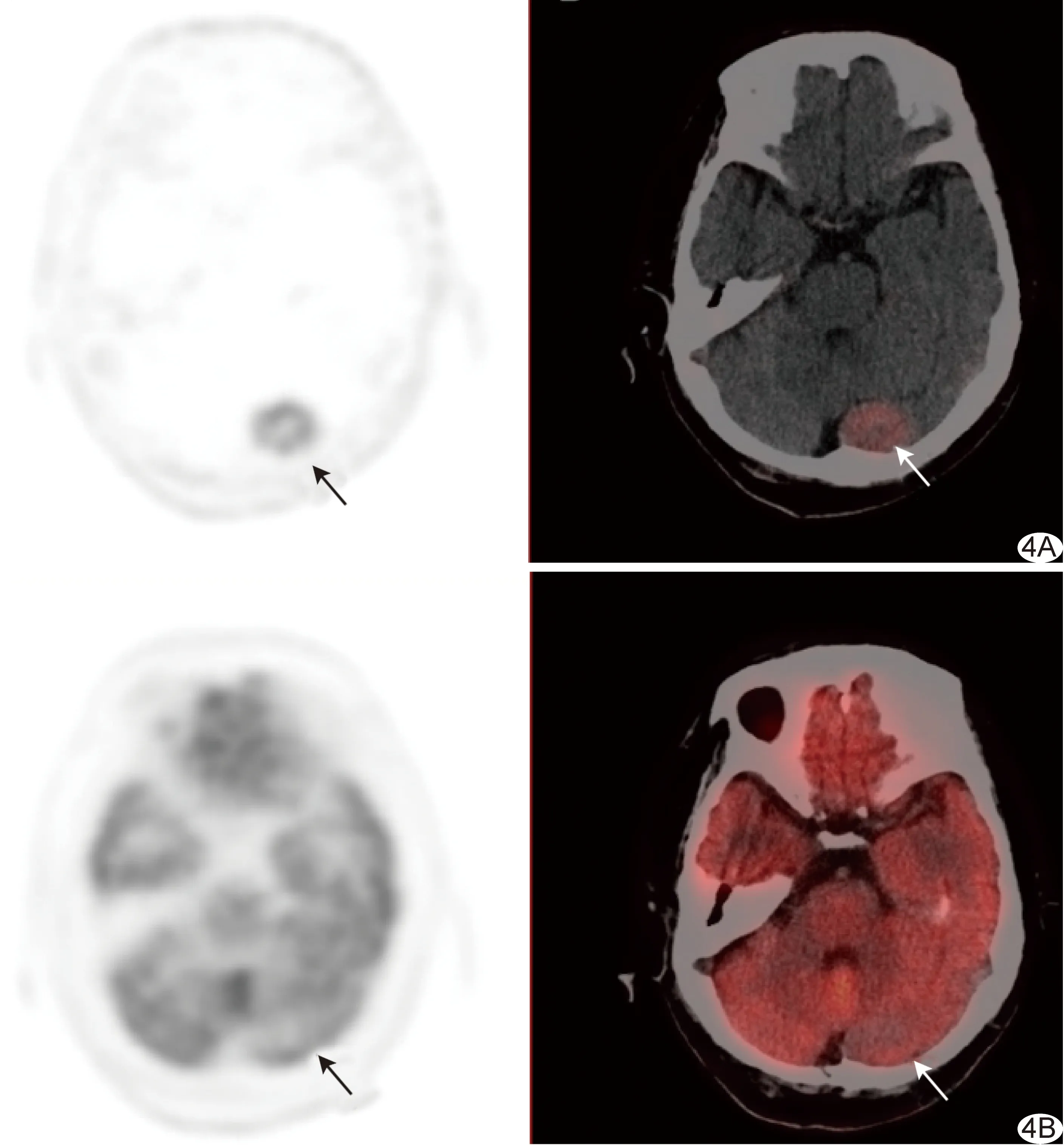
图4 患者女,72岁,脑膜瘤,18F-OCT及18F-FDG显像 左侧枕叶2.7 cm稍高密度结节,18F-OCT摄取增高(SUVmax为6.7,A,箭),18F-FDG无摄取(B,箭)
2.3 奥曲肽治疗前后PET/CT显像 1例胰腺NET术后10年,18F-OCT及18F-FDG联合显像提示肝脏多发占位,1个肝右叶病灶18F-FDG高摄取而18F-OCT无摄取,其余病灶均呈现18F-OCT明显高摄取而18F-FDG中/高摄取;经10个疗程(每个疗程28天,每日30 mg)奥曲肽治疗后,肝右叶摄取18F-FDG病灶较前进展,其余病灶代谢活性均较前减低或消失,见图5。
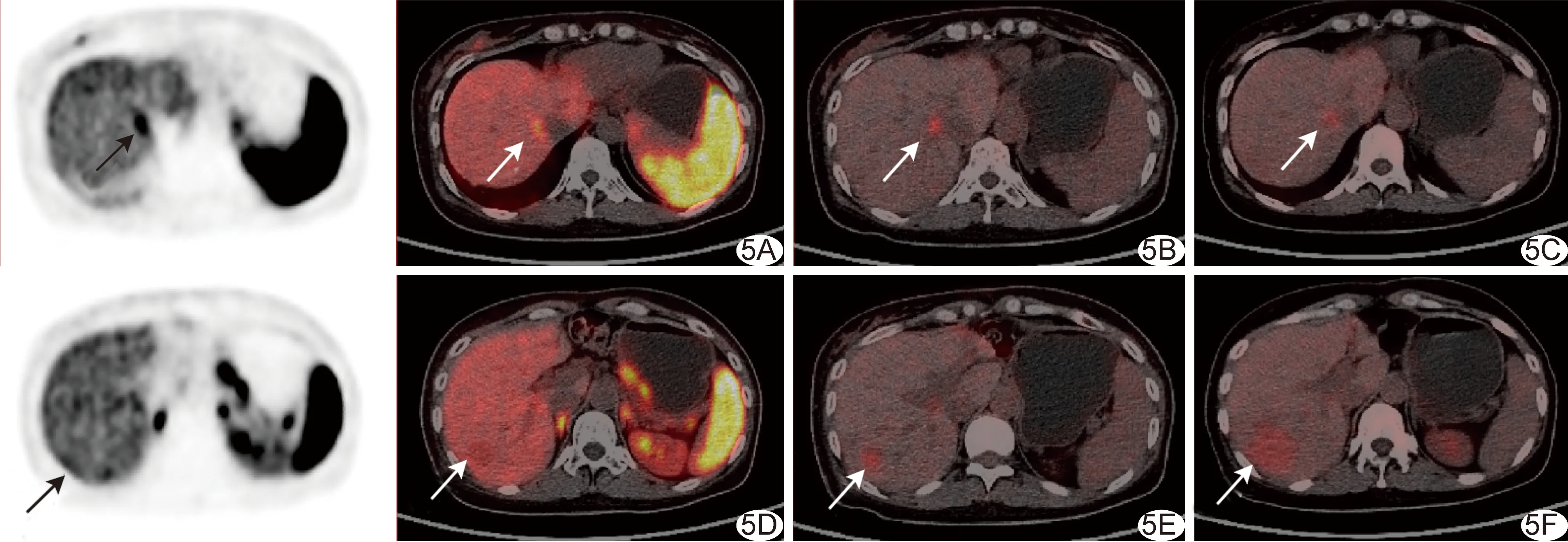
图5 患者女,50岁,胰腺NET多发转移,奥曲肽治疗前后18F-OCT及18F-FDG显像 A~C.肝顶部2.0 cm结节,18F-OCT摄取增高(SUVmax为13.1,A,箭)、18F-FDG摄取增高(SUVmax为8.4,B,箭),治疗后18F-FDG显像病灶变小(1.1 cm)、摄取下降(SUVmax为5.3,C箭); D~F.肝右叶1.7 cm结节,18F-OCT摄取未见增高(D,箭),18F-FDG摄取稍增高(SUVmax为7.1,E,箭),治疗后18F-FDG显像病灶变大(3.9 cm,18F-FDG SUVmax为6.3,F,箭)
3 讨论
NET是一类具有高度异质性肿瘤,单独18F-FDG PET/CT显像常导致漏、误诊。近年有学者利用NET细胞表面高表达SSTR的特性,通过Al18F标记将螯合剂耦联奥曲肽,制备出的18F-OCT具有产量高、半衰期适中、允许集中生产和分配等优势,是目前获得广泛认可的生长抑素类似物示踪剂[5]。由于NET发病率较低,目前仅LONG等[6]研究表明18F-OCT和18F-FDG联合显像可提高NET原发瘤及转移灶的诊断准确性;本研究结果与之一致。
本研究12例NET原发灶中,相比18F-FDG ,18F-OCT检出的G1~G2级病灶较多,且其18F-OCT的SUVmax高于18F-FDG,而18F-FDG则对 G3级病灶较具优势。约80%的高分化NET细胞表面过表达SSTR2,对18F-OCT具有高亲和力,可高特异性结合,而高分化NET生长缓慢、能量消耗低,故葡萄糖代谢率低;低分化NET侵袭性更高,对18F-FDG摄取能力更强,但其细胞表面已经失去原有特征,SSTR表达量下降,对18F-OCT的靶向摄取能力较差[6-7]。此外,本研究发现病灶大小与18F-FDG的SUVmax呈中度相关,但与18F-OCT无明显相关,原因可能在于肿瘤对18F-FDG的摄取与细胞增殖速度有关,肿瘤增殖越快则能量消耗越多,葡萄糖摄取越多,而18F-OCT作为生长抑素类似物,其摄取与细胞分化程度相关度更高[8]。
本组NET转移灶分布于肝脏、骨骼、淋巴结、脑、肺、腹膜及皮下等部位,其中肝脏最常受累;18F-OCT和18F-FDG联合检测转移灶的准确率高于二者单一检查。18F-OCT对于诊断脑和成骨性转移瘤更有优势:受血脑屏障保护,18F-OCT显像脑部正常组织本底摄取水平极低,使脑内转移瘤靶本底比增高;成骨性转移瘤侵袭性较低,进展相对缓慢[9],葡萄糖代谢率相对较低,而SSTR表达增高。此外,随着肿瘤生长,大部分转移瘤与原发瘤的生物学趋势相同,少部分则呈现出趋异性分化[10],即肿瘤细胞分化程度、方向不一致或不完全一致,此时更需联合2种显像,以全面评估肿瘤全身分布的不均一性。
既往研究[11]表明,18F-FDG和68Ga-生长抑素类似物联合显像可改变59%患者的治疗决策。奥曲肽具备作用于SSTR2调控细胞增殖及凋亡而产生的直接抗肿瘤作用[12]。作为SSTR在体示踪技术,18F-OCT显像早期预测奥曲肽治疗NET效果可为实施个体化治疗方案提供临床前依据。本研究追踪观察1例胰腺NET多发转移患者,奥曲肽对其18F-OCT显像阳性病灶取得了良好治疗效果。
本组1例胰腺G1级NET受钩突部位18F-OCT高生理性摄取本底影响导致错误判断,并发现1例脑膜瘤病灶摄取18F-OCT,这是由于SSTR存在于正常软脑膜瘤中,SSTR2在脑膜瘤中高表达、在胶质瘤、垂体腺瘤等颅内肿瘤中亦有表达[13-14],炎症进程和成骨细胞代谢活性增加也亦可使SSTR表达增高[15]而导致18F-OCT误判,联合应用多模态检查有助于判断。
本研究的主要局限性在于样本量小,不足以支持对原发灶显像剂摄取进行分级分析;系回顾性研究,病理学资料不够完善。综上所述,18F-OCT与18F-FDG PET/CT联合显像能更准确地检测NET原发瘤及其转移灶,对临床选择治疗决策具有重要意义。
