山羊地方性鼻内肿瘤病毒SU蛋白的表达及其多克隆抗体的制备和特性分析
2021-05-31江锦秀张靖鹏林裕胜胡奇林
江锦秀,张靖鹏,林裕胜,游 伟,胡奇林
(福建省农业科学院畜牧兽医研究所,福建 福州 350013)
【研究意义】山羊地方性鼻内肿瘤(enzootic nasal tumor,ENT)是一种由山羊地方性鼻内肿瘤病毒(enzootic nasal tumor virus of goats, ENTV-2)引起的慢性接触性传染病,以患病山羊流鼻液,剖检可见鼻腔内的类似菜花状肿瘤为特征[1]。ENT在我国内蒙古、陕西、四川、重庆、福建等地均有报道[2−8]。【前人研究进展】多数学者认为由于山羊基因组中整合了内源性逆转录病毒使得山羊对ENTV-2病毒产生免疫耐受,导致无法在患病山羊血清内检测到抗体。ENTV-2是逆转录病毒,具有相互重叠的gag、pro、pol、env编码基因,以及长末端重复序列LTR。gag基因编码衣壳蛋白,是逆转录病毒属的群抗原。Pro基因编码蛋白酶,pol基因编码反转录酶和整合酶,env基因编码囊膜糖蛋白。囊膜蛋白被切割成跨膜蛋白(Transmembrane protein, TM)和位于ENTV囊膜表面的表面蛋白(Surface protein, SU)。【本研究切入点】SU含有众多的抗原位点,可诱导宿主产生中和抗体[9−10]。SU可以与宿主细胞的Hyal-2 受体结合,在ENTV感染宿主细胞的过程中起到重要作用[11]。表达ENTV-2FJ病毒株的SU蛋白将对了解ENTV-2的感染和致瘤机制以及建立诊断方法提供基础。【拟解决关键问题】本试验提取ENTV-2FJ病毒株的RNA,通过RT-PCR方法获得了编码SU蛋白的基因序列,克隆至原核表达质粒pET-32a(+),获得原核表达质粒pET-32a(+)-SU,在RosettagamiB中进行SU蛋白表达;将纯化的SU蛋白免疫小鼠,制备了小鼠抗SU蛋白的多克隆抗体,为进一步研究SU蛋白在ENTV-2感染中的作用以及建立检测方法提供材料。
1 材料与方法
1.1 试验材料
ECO RⅠ和Hin d Ⅲ内切酶购自NEB公司;Easypure Viral DNA/RNA Kit购自北京全式金生物技术有限公司;GoScriptTMReverse Transcription Mix, Oligo(dT)购自Promega;pMD-19T载体、PrimeSTAR Max DNA Polymerase、E. coli DH5α Competent Cells、DL2000 DNA marker、2ⅹprotein loading buffer、Protein MW Marker(Low)均购自宝日医生物技术有限公司;RosettagamiB(DE3)感 受 态 细 胞、IPTG、X-gal、WB BSA 封闭液体(1X in PBS)、辣根过氧化氢酶DAB显色试剂盒购自上海生工生物工程有限公司;Goat anti-mouse IgG(H+L), HRP conjugate, ELISA and WB购自Proteintech;弗氏完全佐剂和弗氏不完全佐剂购自Sigma公司;SPF级Balb/c小鼠购自福州吴氏动物;ENTV-2纯化病毒以及ENTV-2多克隆抗体由福建省农业科学院草食动物病研究室保存。
1.2 引物设计与合成
根据 GenBank 中收录的 ENTV-2FJ株(登录号:MK559457)的env基因序列,利用 Primer 6.0 软件设计用于扩增 ENTV-2FJ SU基因的引物,下划线处为酶切位点,预期扩增长度为 1 161 bp(表1)。引物由上海生工生物有限公司合成。
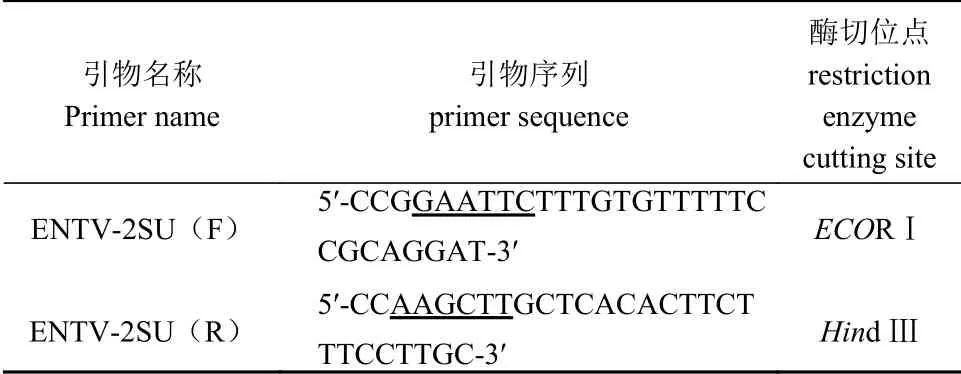
表 1 引物设计Table 1 Primer design
1.3 SU基因的克隆载体及原核表达载体的构建
利用 Easypure Viral DNA/RNA Kit试剂盒提取ENTV-2总 RNA,以RNA 为模板,用 RT-PCR 扩增 SU基因片段。反转录体系和程序参考GoScriptTMReverse Transcription Mix, Oligo(dT)试剂盒说明书。PCR体系参见宝日医生物技术有限公司的PrimeSTAR Max DNA Polymerase的说明书。PCR程序设置为98 ℃10 S,55 ℃ 5 S,72 ℃ 30 S,共30循环。将PCR胶回收产物加A尾后连接pMD-19T,测序正确的阳性质粒和pET-32a(+)表达载体分别用 EcoRⅠ和 Hind III 进行双酶切。酶切产物回收纯化后,用T4 DNA ligase连接以构建重组质粒。重组质粒经双酶切和测序分析验证后命名为 pET-32a(+)-SU。
1.4 重组蛋白ENTV-2FJ SU的诱导表达
pET-32a(+)-SU按 常 规 转 化 RosettagamiB(DE3)感受态细胞,对其IPTG诱导浓度(终浓度分别为0.2、0.4、0.6、0.8、1.0、1.2 mmol·L−1)及诱导时间(3 、4 、5 、6 h,过夜)和诱导温度(20 、25 、30 、37 ℃)进行优化。以pET-32a(+)空载转化RosettagamiB(DE3)感受态细胞作为对照。诱导表 达 蛋 白 样 品 经 过 处 理(12 000 r·min−1离 心,4 ℃离心10 min,弃上清,沉淀用PBS重悬,菌体沉淀加入PBS,冰浴超声20 min,破碎菌体。12 000 r·min−1,4 ℃离心10 min,分别收集上清和沉淀),后经SDS-PAGE(10%分离胶)分析。
1.5 重组蛋白 ENTV-2FJ SU的纯化
重组蛋白ENTV-2FJ SU大量诱导表达后,10 000 r·min−1,4 ℃离心10 min,弃上清,沉淀用PBS重悬,10 000 r·min−1,4 ℃离心10 min,弃上清,重复3次。菌体沉淀加入PBS,冰浴超声20 min,破碎菌体。12 000 r·min−1,4 ℃离心10 min,收集沉淀,用含2 mol·L−1尿素的PBS重悬,12 000 r·min−1,4 ℃离心10 min,弃上清,重复此步骤3次,沉淀加入含8 mol·L−1尿素的PBS重悬,冰浴超声,溶解包涵体。加入4ⅹ protein loading Buffer煮沸5 min,经SDS-PAGE电泳后切胶回收目的条带,研磨后浸泡于PBS中,4 ℃过夜,离心取上清。
1.6 动物免疫和多克隆抗体的制备
取纯化的 SU 蛋白以及ENTV-2FJ 纯化病毒分别与等量佐剂混合,超声乳化,皮下多点注射 Balb/c小鼠,第 1 次用弗氏完全佐剂,蛋白剂量为70 μg·只−1,之后2次免疫间隔时间均为2周,后2次免疫用弗氏不完全佐剂,蛋白剂量为100 μg·只−1;在第 3 次免疫后的第9 d,小鼠断尾采血,分离血清,检测抗体水平。待抗体水平达到要求时采血分离血清,保存于−20 ℃。
1.7 Western-blot 分析
对纯化的ENTV-2FJ病毒进行SDS-PAGE分析后,采用半干法转膜。将制备的小鼠抗SU蛋白多克隆抗体、小鼠抗ENTV-2多克隆抗体和正常对照小鼠血清分别作为一抗,Goat anti-mouse IgG(H+L),HRP conjugate,ELISA and WB为二抗(使用浓度1∶2 000),进Western-blot试验。
1.8 ELISA试验
分别以纯化SU重组蛋白、纯化ENTV-2病毒作为包被抗原,以鼠抗SU多克隆抗体以及鼠抗ENTV-2多克隆抗体为一抗(一抗以1∶4开始倍比稀释至1∶32),HRP标记的山羊抗鼠IgG为二抗(使用浓度1∶12 000),进行ELISA试验。
2 结果与分析
2.1 RT-PCR 扩增和重组质粒的鉴定
RT-PCR 扩增得到约1 161 bp 的目的片段,结果见图1。将目的片段连接pMD-19T,获得SU-19T质粒,送福州铂尚生物技术公司测序,测序结果与ENTV-2FJ株的SU基因序列对比,同源性高达100.0%,表明目的基因扩增正确。

图 1 SU基因RT-PCR扩增结果Fig. 1 RT-PCR amplification result of SU gene
2.2 原核表达载体的构建及鉴定
SU-19T质粒用 EcoRⅠ和 Hind III 进行双酶切,SU-19T质粒双酶切后分别获得约1 161 bp(目的条带)和2 692 bp(pMD-19T载体)的2条带(图2),与预期条带大小基本一致。pET-32a(+)空载也用EcoRⅠ和 Hind III 进行双酶切,获得约5 900 bp的条带(图3)。分别切胶回收目的片段和pET-32a(+)载体片段进行连接,连接后的重组质粒送福州铂尚生物技术公司测序验证。
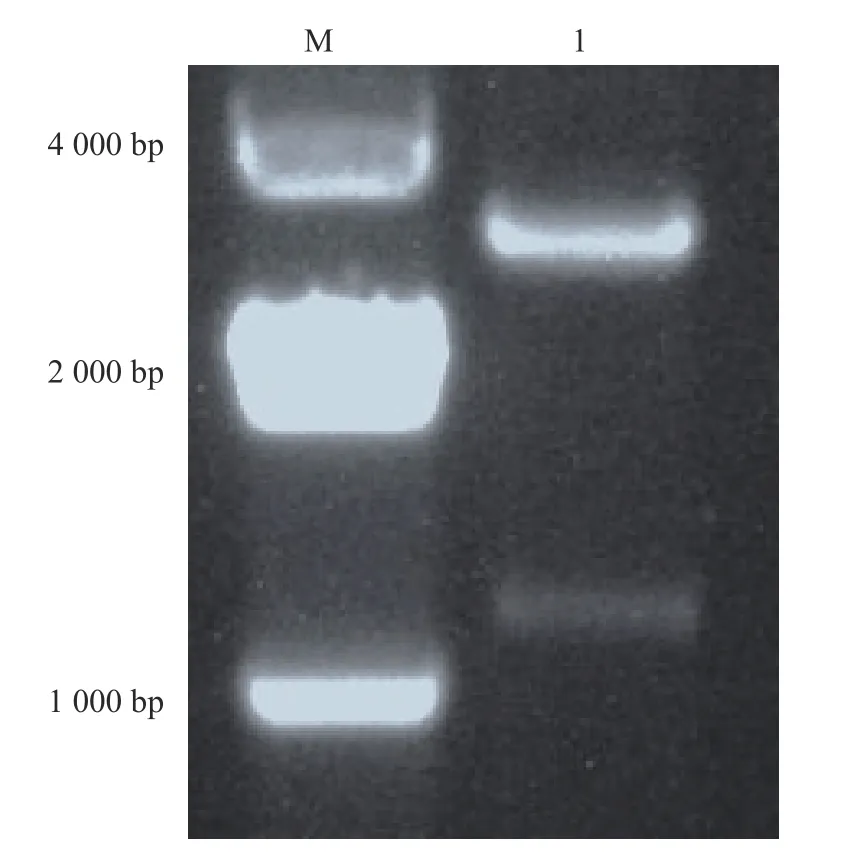
图 2 SU-19T质粒双酶切结果Fig. 2 Double digestion result of SU-19T plasmid

图 3 PET32 a(+)质粒双酶切结果Fig. 3 Double digestion result of PET32 a(+)
2.3 重组蛋白ENTV-2FJ SU诱导表达条件的优化
以不同浓度的 IPTG 对菌体诱导过夜,离心收集菌液,超声并制备样品,进行 SDS-PAGE 凝胶电泳。结果显示,当IPTG 终浓度为 0.4~1.2 mmol·L−1时,重组蛋白SU表达量大且无明显差异(图4)。IPTG的终浓度均为1.0 mmol·L−1时,设置不同的诱导时间, 结果发现诱导3 、4 、5 、6 h以及过夜诱导后重组SU蛋白的表达量相差不大(图5),使用20、25、30、37 ℃ 4种不同温度诱导,SU蛋白均以包涵体形式表达,菌液上清中有少量SU蛋白表达,而 pET-32a(+)空载体诱导对照组则没有重组蛋白的表达。

图 4 不同IPTG诱导浓度对SU重组蛋白诱导表达的影响Fig. 4 Effect of IPTG at different concentrations on the induced expression of SU recombinant protein

图 5 不同IPTG诱导时间对SU重组蛋白诱导表达的影响Fig. 5 Effect of different IPTG induction time on the expression of SU recombinant protein
2.4 重组蛋白ENTV-2FJ SU 的纯化
pET-32a(+)-SU诱导表达后的样品经过处理,经SDS-PAGE后显示目的蛋白大小约64 KD,切胶回收目的条带(图6)用于蛋白免疫。
2.5 Western-blot 分析结果
Western-blot分析结果显示,重组SU蛋白多克隆抗体能与ENTV-2FJ抗原发生特异性反应,出现大

图 6 SU重组蛋白纯化结果Fig. 6 The purification result of SU fusion protein
小为64 KD的条带(图7-C),ENTV-2FJ多克隆抗体与ENTV-2FJ抗原发生特异性反应(图7-B),条带与ENTV-2FJ病毒SDS-PAGE胶分析结果(另文报道[8])一致,ENTV-2病毒与正常小鼠的血清无特异性条带出现(图7-A)。

图 7 Western-blot 分析结果Fig. 7 The result of Western-blot analysis
2.6 ELISA结果
以纯化SU重组蛋白、纯化ENTV-2病毒作为包被抗原(病毒含量20 μg·L−1、100 μL·孔−1),以鼠抗SU多克隆抗体以及鼠抗ENTV-2多克隆抗体为一抗进行ELISA,结果如表2所示,SU蛋白抗原与鼠抗SU多克隆抗体以及鼠抗ENTV-2多克隆抗体均呈阳性反应;ENTV-2抗原与鼠抗ENTV-2多克隆抗体、鼠抗SU多克隆抗体(1∶4)呈阳性反应。

表 2 ELISA试验结果Table 2 ELISA result
3 讨论与结论
SU蛋白可以与宿主细胞的Hyal-2受体结合,并通过结合这一识别过程介导病毒对细胞的转化[11]。JSRV缺失SU的信号肽到SU与TM的连接区域也使env丧失转化能力,表明SU蛋白中可能有多个区域参与细胞转化[12]。而张月梅等[13−14]构建了SU蛋白缺失型真核表达载体, 转染293T细胞,运用激光共聚焦结合免疫共沉淀方法确定SU蛋白和Hya-2蛋白可能结合区域,结果表明SU基因所缺失区域238~867 bp对于SU蛋白与Hya-2蛋白的结合是必不可少的。研究SU蛋白对了解ENTV的免疫特性及致病机制具有重要意义。本研究成功表达了ENTV-2FJ 的SU蛋白,用纯化的重组SU蛋白免疫小鼠,获得了小鼠抗SU蛋白多克隆抗体;Western-blot分析结果显示获得的小鼠抗SU蛋白多克隆抗体可以与ENTV-2病毒抗原特异性结合,另外ELISA试验也显示不仅ENTV-2抗原可与抗SU多克隆抗体反应,SU抗原也可以与抗ENTV-2多克隆抗体反应,表明SU重组蛋白具有免疫原性。SU重组蛋白的表达为ENTV-2单克隆抗体的制备以及ELISA方法的建立奠定了基础。
本研究中,ENTV-2抗原与1:4鼠抗SU多克隆抗体反应呈阳性,而与1:8鼠抗SU多克隆抗体不反应,说明笔者制备的抗SU重组蛋白抗体与ENTV-2反应原性较弱,可能与该蛋白在纯化过程中变性后复性和重折叠不好,影响了蛋白的空间结构有关。下一步笔者将优化该SU重组蛋白的复性和重折叠方案,以改善其反应原性。
