黏质沙雷氏菌灵菌红素合成基因簇异源表达及其潜在的温度调控机制
2021-05-31刘方晨贾宪波吴良泉林俊杰陈龙军林陈强陈济琛
刘方晨,贾宪波 ,吴良泉,方 宇,赵 恪,林俊杰,陈龙军,张 慧,林陈强,陈济琛
(1. 福建农林大学资源与环境学院,福建 福州 350002;2. 福建省农业科学院土壤肥料研究所,福建 福州 350003;3. 福建农林大学生命科学学院,福建 福州 350002)
0 引言
【研究意义】灵菌红素类(Prodiginines)是微生物源的三吡啶类红色次生代谢产物,具有抗菌、除藻、抗植物病原体以及其他重要的生物活性[1−4],在医药、环境治理、纺织染料乃至化妆品等领域具有广阔的应用前景和市场价值。根据其烷基侧链的不同分为灵菌红素(prodigiosin,PG)、间环丙菌素(metacycloprodigiosin,MPG)、十一烷基灵菌红素(undecylprodigiosin,UPG)、壬烷基灵菌红素(nonylprodigiosin,NPG)、环丙烷灵菌红素(cycloprodigiosin,CPG)等。其中PG是该类色素的典型代表之一,主要出现在微生物生长的后期[5],是一种暗红色的粉末,不溶于水,易溶于甲醇、乙醇、丙酮等有机溶剂[6]。作为灵菌红素家族中的一员,PG主要是沙雷氏菌属、放线菌属、假单胞菌属、海洋类细菌等的次生代谢产物[7],其中黏质沙雷氏菌(Serratia marcescens)所产生的PG生物活性较好,因此被作为生产PG的模式菌株[8]。研究发现,该菌合成灵菌红素对温度有较为严格的要求,在温度高于37 ℃以及低于20 ℃时色素合成被完全抑制[9],28 ℃为其生产灵菌红素的最佳温度[10],但其受温度调控的机制尚不明确。【前人研究进展】黏质沙雷氏菌合成PG是由两个复杂的分叉途径共同完成的,而这两个分叉途径已被阐明。这两个分支合成了两个前体物质,分别是2-甲基-3-n-戊基吡咯(MAP)和4-甲氧基-2,2′-双吡咯-5-甲醛(MBC),再由MAP和MBC的缩合生成PG[11]。灵菌红素生物合成途径由pig基因簇基因共同参与,pig基因簇有pigA-pigN共14个编码基因,其中pigB、pigD和pigE参与了MAP的合成,而pigA、pigF、pigG、pigH、pigI、pigJ、pigK、pigL、pigM和pigN则参与了MBC的合成。PG合成的前体物质主要有脯氨酸、甲硫氨酸、丙氨酸、丝氨酸、组氨酸、二辛烯醛、丙二酰-CoA和乙酰- CoA[12]。灵菌红素合成基因簇不仅能够在黏质沙雷氏菌中合成灵菌红素,也能在其他菌株中异源合成灵菌红素,Thomson等[13]首次将黏质沙雷氏菌完整的PG生物合成基因簇克隆下来在欧文氏菌(Erwinia carotovora)中成功表达并合成目的产物。【本研究切入点】黏质沙雷氏菌合成灵菌红素受温度调控的机制目前尚未被阐明,其对温度的具体要求不明确,这对灵菌红素的规模化生产造成阻碍。因此,从分子水平研究其受温度调控的机制意义重大。本研究将灵菌红素合成基因簇与不同类型启动子相连接后于大肠杆菌中异源表达,探究更换启动子是否能够令其在相对高温(37 ℃)合成色素。【拟解决的关键问题】本研究供试菌株黏质沙雷氏菌FZSF02为本课题组前期筛选保藏的灵菌红素高产菌株[14],为了探究其pig基因簇能否在大肠杆菌中表达并合成PG,并探究其在37 ℃不产灵菌红素的原因是其pig基因簇启动子在37 ℃不表达或表达量降低,还是pigA-N编码合成的灵菌红素前体所用的蛋白在37 ℃无活性。本研究通过构建3种包含不同启动子与pig基因簇的重组质粒,分别转入大肠杆菌中探究其能否在大肠杆菌中合成灵菌红素,并通过RTqPCR来检测37 ℃与28 ℃条件下培养的FZSF02菌株pigA、pigF、pigN基因的转录水平变化,进而验证其在37 ℃条件下不能合成PG究竟是在转录水平上的调控,还是因为受到合成PG所需要的酶的影响,抑或是受到两者的综合调控。
1 材料与方法
1.1 试验材料
1.1.1 菌株、质粒以及培养条件 本研究供试菌株和质粒详情见表1,如无特殊注明:大肠杆菌在37 ℃培养,黏质沙雷氏菌在28 ℃培养,使用LB培养基(酵母粉0.5% w/v、胰蛋白胨1% w/v、氯化钠1%w/v),固体培养基含2%琼脂。抗生素如无特殊注明则为:100 mg·L−1ampicillin(Amp),100 mg·L−1K anamycin(Kan)。
1.1.2 主要试剂及仪器 细菌DNA提取试剂盒(百泰克DP2001)PrimeSTAR®GXL DNA Polymerase(R050A)、PrimeSTAR®Max DNA Polymerase(R045A)、TaKaRa MiniBEST DNA Fragment Purification Kit Ver.4.0 DNA片段纯化试剂盒(9761)均购自宝日医生物技术(北京)有限公司;2X SanTaq PCR Mix(生工B532061)快速质粒小提试剂盒(DP105)、培养细胞/细菌总RNA提取试剂盒(DP430)均购自天根生化科技(北京)有限公司;TransScript®One-Step gDNA Removal and cDNA Synthesis SuperMix试剂盒(AT311-03)、PerfectStart Green qPCR SuperMix试剂盒(TG-AQ601-02)均购自北京全式金生物技术有限公司;PCR扩增仪(ABI-Veriti™ 96-Well);实时荧光定量PCR仪(ABI-QuantStudio™ 6 Flex);稳压稳流电泳仪(DYY-6 B)以及凝胶成像分析系统(uvitec-Essential V4)。

表 1 供试菌株和质粒Table 1 Bacterial strains and plasmids used in this study
1.2 试验方法
1.2.1 pig基因簇的克隆 利用细菌基因组DNA提取试剂盒从黏质沙雷氏菌FZSF02中提取其基因组DNA,并以提取的FZSF02基因组DNA为模板,以设计的ExpF和ExpR为引物,利用扩增长片段的高保真DNA聚合酶PrimeSTAR®GXL DNA Polymerase进行PCR扩增得到pig基因簇序列;PCR反应条件为:98 ℃变性10 s,68 ℃退火加延伸 10 min,共33个循环。
1.2.2 E.Coli DH5α(pTOPO-ppPig)重组菌株的构建及鉴定 利用零背景pTOPO-Blunt Simple平末端克隆试剂盒构建重组质粒pTOPO-ppPig,重组质粒的构建所用引物、菌株、质粒分别如表1和表2所示。利用DNA纯化试剂盒将上述克隆出的pig基因簇DNA进行纯化,根据pTOPO平末端克隆试剂盒说明书,构建10 μL的克隆反应体系:pTOPO-Blunt Simple Vctor(30 ng·μL−1)1 μL、10×Enhancer 1 μL、pig基因簇DNA纯化产物8 μL。室温反应20 min后,转入E. coli DH5α感受态细胞中,冰浴30 min,42 ℃热激45 s,冰上放置2 min后,加入0.89 mL LB液体培养基,37 ℃摇床孵育2 h;菌体均匀涂布于含有Amp的LB平板上,28 ℃培养过夜,挑取红色的单菌落,利用M13F和M13R引物进行PCR鉴定,产物送至上海博尚生物技术有限公司测序,利用NCBI B LAST对发回的结果进行比对分析。
1.2.3 E.coli DH5α(pTOPO-kpPig)重组菌株的构建及鉴定 以实验室保存的pTOPO-kan质粒利用KanproF2和KanproR2引物进行PCR扩增将质粒线性化,得到一条不含Kan抗性基因的线性化载体。使用无缝克隆试剂盒将纯化的pig基因簇DNA与纯化的线性化载体相连接,连接体系为10 μL:线性化载体3.5 μL、pig基因簇DNA3.5 μL、酶3 μL。37 ℃静置30 min后,再次转入E.coli DH5α感受态细胞,余下步骤与1.2.2相同。
1.2.4 E.coli BL21(pEASY-Pig)重组菌株的构建及诱导表达 利用pEASY®- Blunt E2 表达试剂盒构建重组质粒pEASY-Pig,克隆反应体系为:pig基因簇DNA 4 μL、pEASY®- Blunt E2 Expression Vctor 1 μL。室温反应5 min后,转入E.coli BL21感受态细胞中,转化操作与1.2.2相同,挑取数个长势良好的单菌落,接种入1.5 mL离心管,孵育至浑浊后,用T7P、T7T引物(见pEASY质粒说明书)进行PCR扩增验证,琼脂糖凝胶电泳后条带在21 000 bp左右的即为阳性克隆子,已验证为阳性的菌株取少量菌液划线于加入Amp和IPTG(0.5 mmol·L−1)的LB固体培养基,置于 28 ℃培养箱中过夜培养并诱导其合成灵菌红素。
1.2.5 比色法测定灵菌红素 取少量菌体,溶于5 mL酸性甲醇中,静置15 min后,10 000 r·min−1超速离心5 min,取上清液,利用紫外分光光度计测定其在535 nm吸光度(灵菌红素酸性条件下在535 nm处 有特征吸收)[14]。

表 2 供试引物Table 2 Primers used in this study
1.2.6 野生型FZSF02菌株在不同温度条件下(28 ℃/37 ℃)pigA、pigN和pigF基因转录水平的RT-qPCR测定 将野生型FZSF02菌株接种于LB液体培养基中,放置于28 ℃培养作为种子液,在OD600值达到1.0~1.5时进行转接,接种量为1%,37 ℃和28 ℃样品各设置3个试验重复共接种6瓶,接种后分别置于28 ℃与37 ℃条件进行培养,培养过夜后利用细菌总RNA提取试剂盒提取其总RNA,并反转录成cDNA作为RT-qPCR模板。设计FZSF02的16S rRNA基因引物,以及pigA、pigF和pigN基因引物(如表2所示),按照qPCR试剂盒说明书进行反映,检测各个基因的转录水平,以16S rRNA作为内参基因,以37 ℃的基因转录水平作为对照(CK),每个样品3次技术重复,计算28 ℃温度条件下各基因转录水平与其的倍数关系。
2 结果与分析
2.1 3种重组菌株的成功构建
通过构建3种不同启动子的pig基因簇重组菌株,研究启动子在温度调控PG合成的机制中的作用,利用表2中的引物,用长片段高保真DNA聚合酶分别PCR扩增出完整的pig基因簇、完整的pig基因簇和启动子,其中得到片段大小为20 984 bp、21 390 bp。琼脂糖凝胶电泳图如图1-A所示,1、2泳道依次为pig基因簇、pig基因簇和pig启动子。
按照方法中所述利用上述片段与相应载体连接构建出3种重组质粒(图2)并转入相应的感受态细胞中,在带有Amp的LB固体平板上,筛选出长势良好的重组菌株单菌落。分别利用T7引物与M13引物对pEASY质粒和两个pTOPO质粒所连接的片段进行PCR验证,产物进行琼脂糖凝胶电泳后如图1-B所示,pTOPO-ppPig、pTOPO-kpPig、pEASY-Pig重组质粒所连片段(泳道1、2、3),3个泳道的条带均在大于15 000 bp处有明显条带,与预期相符。将PCR验证正确的质粒送样测序,测序结果与NCBI中菌株FZSF02灵菌红素合成基因簇进行比对,发现其匹配度为100%,可知得到的质粒即为目的质粒,测序 阳性质粒按照上述的质粒名称进行命名。
2.2 pig基因簇在3种重组菌株中均成功表达
经验证为阳性的单菌落扩大培养,将其再次划线于Amp抗性LB平板上,其中pTOPO-ppPig和pTOPOkpPig重组菌株启动子为组成型启动子,不需诱导即可启动基因表达,将其分别在28 ℃与37 ℃条件下培养48 h,观察转入重组质粒后的大肠杆菌能否在对应条件下合成灵菌红素,结果如图3所示,经48 h的培养后,28 ℃培养条件下琼脂平板上菌株变成红色,但与野生型FZSF02的产量仍有差距,而37 ℃培养条件下的重组菌株无色素合成。而pEASY-Pig重组菌株经鉴定后划线于带有Amp抗性和IPTG的LB固体平板上,IPTG可以诱导T7强启动子表达,该菌株在28 ℃和37 ℃培养条件下均能够合成PG。通过比色法测定灵菌红素结果如表3所示,pTOPOppPig和pTOPO-kpPig重组菌株在37 ℃培养条件下535 nm吸光度几乎为0,pEASY-Pig重组菌株在37 ℃培养条件下535 nm吸光度为0.026,虽然吸光度较小但可以确定该菌株在37 ℃有合成灵菌红素,且远小于该菌株28 ℃灵菌红素合成量。
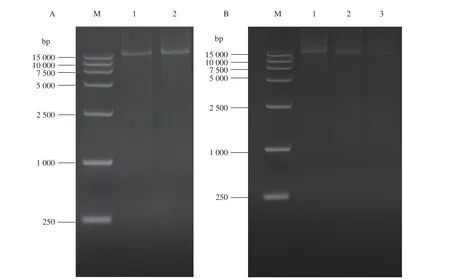
图 1 pig基因簇、pig基因簇和pig启动子序列以及3种重组质粒所连片段的验证PCR扩增结果Fig. 1 PCR amplification results on pig gene cluster, pig gene cluster and pig promoter, and validation on sequences of 3 recombinant plasmid segments
试验结果表明黏质沙雷氏菌FZSF02的pig基因簇能够在不同启动子的作用下在大肠杆菌中转录,并合成目的产物灵菌红素。然而只有携带T7启动子的重组菌株在37 ℃合成少量的灵菌红素。
2.3 RT-qPCR的检测
对pigA、pigF、pigN等基因在不同温度发酵后转录水平的变化进行RT-qPCR检测,以16S rDNA作为内参基因,利用SYBR®Green法实时定量分析在不同培养温度下(28 ℃与37 ℃)的基因转录水平,并用2−∆∆CT的方法计算37 ℃培养条件与28 ℃培养条件下的基因转录水平的倍数关系(图4)。结果显示,与28 ℃培养条件下相比,37 ℃培养条件下各基因的转录水平呈下调趋势,pigA、pigF和pigN基因分别下调了2倍、3倍、2倍以上。推测在37 ℃培养条件下野生型黏质沙雷氏菌FZSF02不合成PG是因为其pig基因簇中的编码基因转录水平下调,导致其编码合成的蛋白(酶)的数量下降,进而影响PG的合成。
3 讨论与结论
黏质沙雷氏菌合成PG有严苛的温度要求,一般在24~30 ℃,最适温度为28 ℃,在37 ℃培养条件下PG的合成受到抑制[15],高温抑制灵菌红素合成的机制尚不明了[16]。有可能是调控PG合成的pig基因簇及其操纵子在37 ℃转录表达水平下调或不表达,也可能是参与PG前体MAP和MBC合成的某种或几种酶失去活性。有研究表明,温度对OmpR家族的CpxR双组分调控系统以及pig基因簇启动子有调控作用并影响PG的合成[17]。ERIC等[18]发现PG生物合成操纵子在37 ℃的转录低于30 ℃,并能够调控色素的合成。Andrea等证明[19]黏质沙雷氏菌调控色素合成的pig基因簇能够在恶臭假单胞菌KT2440中异源表达,并高效的合成灵菌红素。本研究应用异源表达和pig基因转录水平两种方案探讨黏质沙雷氏菌合成灵菌红素的温度依赖性的内在机制。
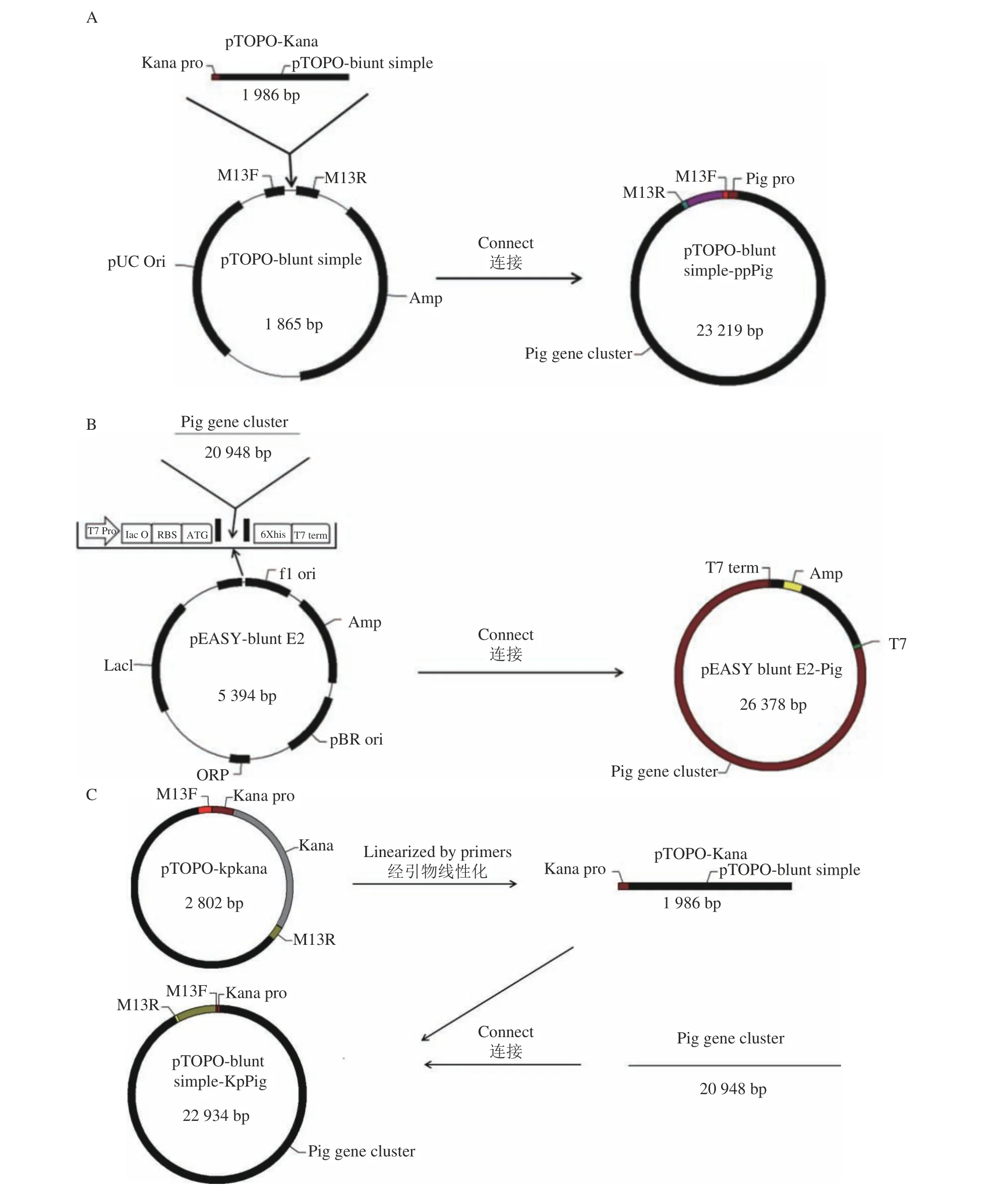
图 2 3种重组质粒的构建过程Fig. 2 Construction of 3 recombinant plasmids
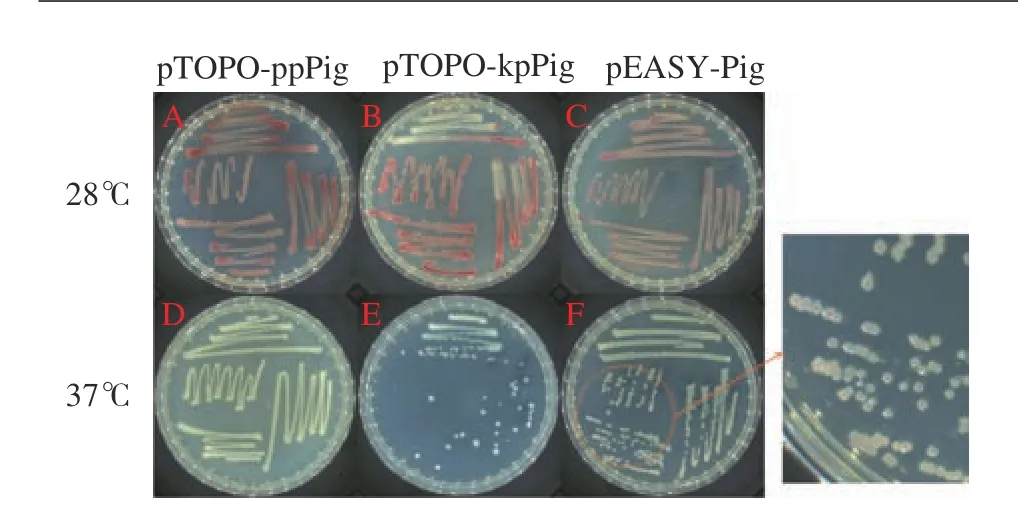
图 3 3种重组菌株在28 ℃和37 ℃培养条件下灵菌红素的合成情况Fig. 3 Prodigiosin synthesis of 3 recombinant strains cultured at 28 ℃ and 37 ℃
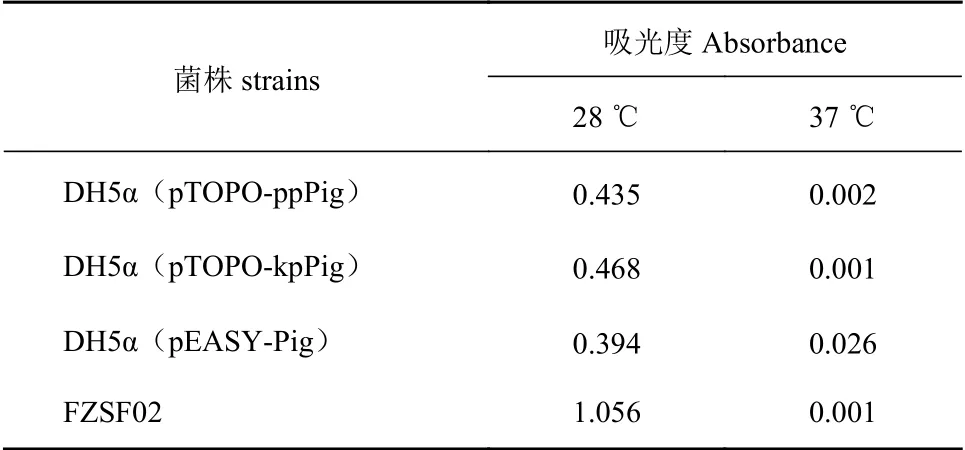
表 3 菌株在535 nm下的吸光度Table 3 Absorbance at 535 nm of recombinant strains
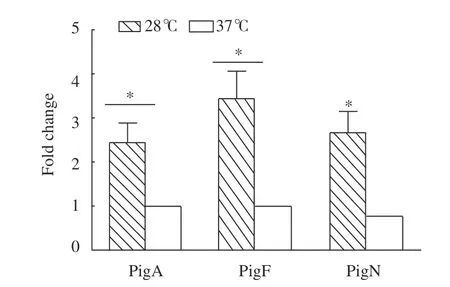
图 4 粘质沙雷氏菌在不同温度条件下所选基因的转录水平倍数变化Fig. 4 Expressions of selected genes of S. marcecens at different temperatures
通过构建不受温度影响的启动子与pig基因簇连接的重组质粒并在大肠杆菌中异源表达,进而验证启动子在温度调控中的影响,并进一步探究温度调控PG生物合成可能的机制。首先将FZSF02中的pig基因簇本身的启动子和pig基因簇一同转入大肠杆菌,观察pig基因簇在本身启动子的作用下能否在大肠杆菌中的表达,结果显示pig基因簇可以在其本身启动子的启动下在大肠杆菌中转录表达。随后利用不受温度影响的T7启动子和通用型启动子(可在37 ℃表达)在大肠杆菌中启动pig基因簇合成PG,结果显示3种重组菌株都可以在28 ℃合成PG。其中只有携带T7启动子的重组菌株在37 ℃合成少量的PG,推测是由于T7强启动子的表达量要远远大于pig基因簇本身启动子和通用型启动子,这意味着该菌株可以编码合成更多灵菌红素前体合成所需要的蛋白(酶),这些蛋白(酶)在37 ℃并不是完全失活,而是活性大大降低了,所以拥有超量蛋白(酶)的pEASY-Pig重组菌株才能在37 ℃合成少量灵菌红素。而另外两种菌株则因为合成MAP与MBC的蛋白(酶)在37 ℃条件下失去活性或活性大幅降低而无法合成PG。所以,该试验证明黏质沙雷氏菌菌株只在低温下合成灵菌红素与pig基因簇所编码的蛋白在37 ℃高温下活性降低或失活有关。
pigF与pigN基因参与了MBC合成的关键步骤,编码直接或间接参与MBC合成的蛋白(酶):氧甲基转移酶(PigF)和氧化还原酶(PigN),PigA也参与合成MBC前体物质;它们的转录水平反映了MBC的合成水平[9]。本研究利用RT-qPCR分析了FZSF02菌株pig基因簇中的pigA、pigF和pigN基因在37 ℃与28 ℃的转录水平差异,发现在37 ℃培养条件下上述3种基因的转录水平相对于28 ℃出现不同程度的下调,这与徐红等[20]的研究是一致的。上述3个基因转录水平分别下调了约59%、69.8%以及61.8%,导致其编码合成参与灵菌红素前体合成的蛋白(酶)减少,进而MBC的合成量减少,最终导致灵菌红素合成量减少。且FZSF02菌株在28 ℃培养条件下色素产量较高,37 ℃培养条件下几乎没有色素合成(表3)。该试验说明在黏质沙雷氏菌FZSF02菌株中pig基因簇上的相关基因除其翻译的蛋白活性受温度影响外,基因簇本身的转录水平也受温度控制,即低温有利于启动子启动该基因簇的转录。
综上,初步推测黏质沙雷氏菌FZSF02不能在37 ℃合成PG,一方面是由于pig基因簇在37 ℃转录水平下调,导致其编码的合成MBC与MAP所需要的酶量减少;另一方面是因为37 ℃严重影响相关酶的活性。所以,温度影响黏质沙雷氏菌合成PG的内在机制是综合性的。
本研究通过重组菌株成功异源表达pig基因簇并合成灵菌红素,给出了黏质沙雷氏菌FZSF02在37 ℃合成PG受到抑制的原因及相关证据,增进了对黏质沙雷菌合成PG的认识,为规模化发酵生产PG提供了一定理论依据。
