柚木心材和边材的LC-MS代谢组学比较
2021-05-31刘李花刘云尹加笔哏玉响宝李北屏韩会俊赵平
刘李花,刘云,尹加笔,哏玉响宝,李北屏,韩会俊,赵平*
(1. 西南林业大学西南地区林业生物质资源高效利用国家林业和草原局重点实验室, 昆明 650233;2. 德宏州林业和草原局, 云南 芒市 678400; 3. 瑞丽市林业和草原局, 云南 畹町 678500)
大多数树木均有心材和边材之分,心材是树木中靠近树心颜色较深的部分,其耐腐性较强,在树木的生长过程中起支撑作用,同时也是体现树木质量和价值的主体[1]。木材的形成源自树木维管形成层的细胞分裂活动,伴随着细胞壁初级代谢和次生代谢各化学组分的生物合成及其空间结构的自我组装[2-3]。木材的颜色作为木材销售过程中的一个重要商品属性,其颜色的形成主要与木材中黄酮类、酚类等呈色次生代谢产物的合成和积累有关,并受遗传背景、树龄、环境等多种因素的影响[4-6]。因此,阐明木材形成中代谢物的种类、分布规律及其代谢途径,有助于揭示木材的细胞壁构建及其呈色机制,并为木材的材性改良提供理论基础。
柚木(Tectonagrandis)为马鞭草科柚木属的落叶、半落叶乔木树种,是季节性热带地区种植较广泛的一种珍贵木材树种,目前种植面积大约600万hm2。因其天然的耐久性、良好的尺寸稳定性和表面装饰性等特性,柚木已被许多热带国家列入木材生产再造林计划,并广泛应用于游艇、家具和建筑材料等制造行业[7]。柚木心材和边材的颜色区别明显,具有从边材到心材的明显颜色过渡。连彩萍等[8]研究了柚木光变色规律及机理,发现引起柚木光变色的因素主要为木素的降解及提取物中不饱和键断裂生成的发色基团。Moya等[7,9]发现树龄、产地、环境条件和营林技术等因素可能会影响柚木心材抽提物含量和颜色的变化。Qiu等[10]推测酚类、醌类和酮类等次生代谢物可能是引起柚木边心材颜色差异明显的主要原因。邱竑韫等[11]研究了柚木石油醚抽提物成分及其对心边材颜色的影响,但导致边心材之间颜色差异的原因至今不明。代谢组学是以组群指标分析为基础,以高通量检测和数据处理为手段,以信息建模与系统整合为目标的系统生物学的一个重要分支,能够提供无创、快速、准确和高通量的分析,近年来被广泛应用于植物学、林学、农学、营养学、药理学等诸多研究领域中[12-13]。
笔者以柚木心材和边材为研究对象,采用液质联用(LC-MS)代谢组学技术对柚木次生代谢物进行系统分析,阐明心材和边材的差异代谢物,探讨这些代谢物的代谢途径,以期为进一步揭示柚木心材颜色形成机理等提供依据。
1 材料与方法
1.1 试验材料与试剂
柚木样品于2019年8月取自云南省德宏州盈江县国有林场(97°31′E,24°24′N),随机选取1995年种植的6株胸径基本一致的柚木树,用生长锥在量取胸径处分别取心材和边材样本各1 g于5 mL冻存管后置入液氮中保存备用。C代表边材,6份边材样本编号为C1~C6;F代表心材,6份心材样本编号为F1~F6。
LC-MS使用的甲醇、乙腈、甲酸、2-丙醇和超纯水,购自美国Fisher Chemical公司。
1.2 主要仪器与设备
New Classic MF MS105DU型电子天平,德国Mettler Toledo公司;Centrifuge 5424 R型和5430 R型冷冻离心机,德国Eppendorf公司;SBL-10DT型超声波清洗机,宁波新芝生物科技股份有限公司;Wonbo-96c型高通量组织破碎仪,上海万柏生物科技有限公司;LNG-T88型台式快速离心浓缩干燥器,太仓市华美生化仪器厂;JXDC-20型氮气吹扫仪,上海净信实业发展有限公司;ExionLC AD System型液相色谱系统和ABSCIEX-Triple TOF 5600型质谱仪,美国应用生物系统公司。
1.3 试验方法
1.3.1 样品制备
精确称取 50 mg柚木各样品加入2 mL加厚离心管中,加入直径6 mm钢珠一枚,在离心管中依次加入0.3 mg/mL用L-2-氯-苯丙氨酸和乙腈配制的内标溶液20 μL、V(甲醇)∶V(水)=4∶1提取液400 μL,在-20 ℃低温下用高通量组织破碎仪在50 Hz条件下破碎6 min,之后在5 ℃下涡旋30 s使样品混匀,在40 kHz下超声萃取 30 min。将样品于-20 ℃条件下静置30 min沉淀蛋白质后,在4 ℃、13 000×g条件下离心15 min,取上清液并抽干;再用V(乙腈)∶V(水)=1∶3的溶液100 μL复溶后进行上机分析。心边材各6个重复,同时本次所有检测样品的混合样本作为质控样本(QC),用于判断分析系统的稳定性。
1.3.2 LC-MS分析条件
色谱条件:色谱柱为美国Waters 公司的BEH C18柱(长×直径为100 mm×2.1 mm, 填充料直径1.7 μm),流动相A为含质量分数0.1%甲酸的水溶液,流动相B为含质量分数0.1%甲酸的乙腈/异丙醇(体积比1∶1)溶液,流速为0.40 mL/min,进样量为10 μL,柱温为40 ℃。流动相梯度洗脱的条件为:体积分数5%~20%B(0~3.0 min),20%~95%B(3.0~9.0 min),95%B(9.0~13.0 min),95%~5%B(13.0~13.1 min),5% B(13.1~16.0 min)。
质谱条件:质量扫描范围50~1 000 m/z,喷雾气0.34 MPa,辅助加热气0.34 MPa,气帘气0.20 MPa,离子源加热温度500 ℃,离子化正极电压5 000 V,离子化负极电压4 000 V,去簇电压80 V,碰撞能的起伏电压20~60 V。
1.3.3 代谢物鉴定
经超高效液相色谱联用质谱(UPLC-Triple-TOF-MS)分析后,原始数据导入代谢组学处理软件Progenesis QI(美国Waters 公司)进行基线过滤、峰识别、积分、保留时间校正、峰对齐,最终得到一个保留时间、质荷比和峰强度的数据矩阵。然后进行数据预处理,主要包括:保留至少一组样品中非零值80%以上的变量;对原始数据进行缺失值填充;对总峰进行归一化处理,并删除QC 样本相对标准偏差(RSD)≥30%的变量;对数据进行log转换得到最终用于后续分析的数据矩阵。利用精确的质谱、质谱片段谱和同位素比值差在人体代谢组数据库(HMDB)和串联代谢产物数据库(METLIN)等数据库中进行搜索鉴定。
1.3.4 差异代谢物通路分析
将差异代谢物映射到京都基因和基因组百科全书数据库(KEGG),获得差异代谢物的代谢途径和富集情况。
1.3.5 统计分析
采用主成分分析方法(PCA)观察各样品之间的总体分布和组间的离散程度,采用正交-偏最小二乘法分析(OPLS-DA)以区分各组间代谢轮廓的总体差异,筛选组间的差异代谢物。
2 结果与分析
2.1 心边材代谢物的鉴定
12个柚木样品数据经LC-MS数据分析软件分析处理,并在HMDB和METLIN等数据库中进行搜库,在正负两个离子模式下,共定性得到705个代谢物。其中,代谢物中包括脂类和类脂180个、含氧有机物120个、苯丙素和聚酮类101个、有机杂环化合物82个、有机酸及其衍生物58个、苯环衍生物49个、核苷/核苷酸和类似物14个、含氮有机物5个、木脂素/新木脂素及相关化合物4个、生物碱及其衍生物3个、含卤素有机物1个和其他化合物88个(表1)。从表1中可以看出,脂类和类脂分子的占比最高(25.53%),其次为含氧有机物(17.02%)、苯丙素和聚酮类(14.33%)。
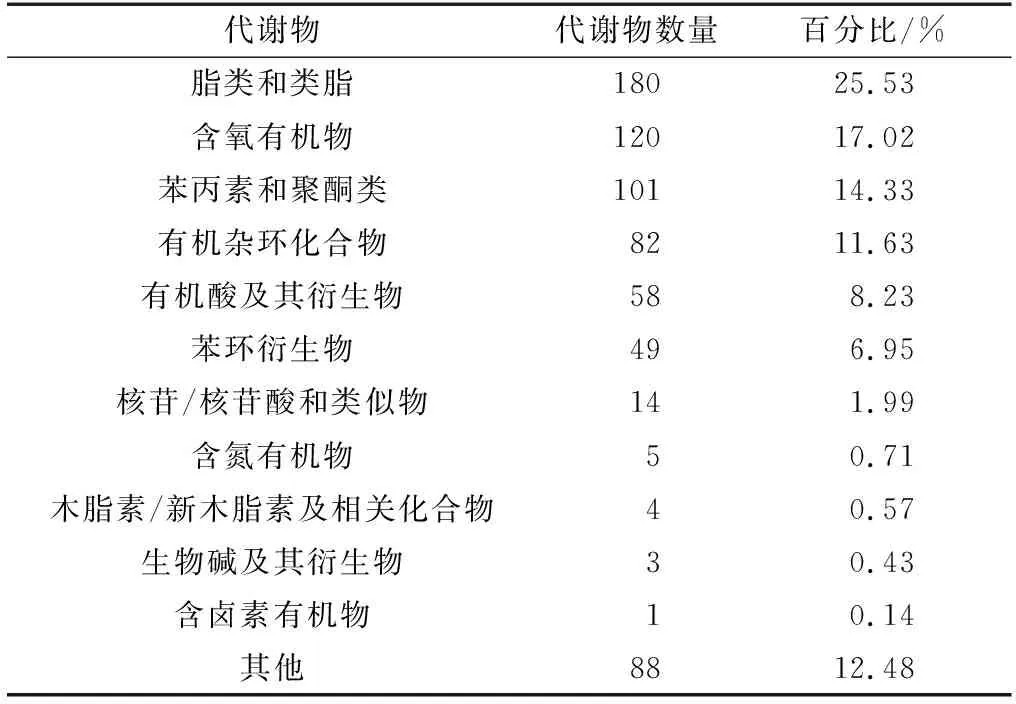
表1 基于HMDB的柚木代谢物分类Table 1 Classification of teak metabolites by HMDB
进一步分析发现,柚木边材中含量在前10位的代谢物为4-羟基-5-(3′,4′-二羟基苯基)-戊酸-O-甲基-O-葡萄糖醛酸苷(图1)、磷脂酰乙醇胺(PE)[15∶0/18∶3 (6Z, 9Z, 12Z)]、螺内酯D、奎宁酸、油酰胺、PE[(14∶1 (9Z)/18∶3 (9Z, 12Z, 15Z)]、亚油酰胺、积雪草皂苷B、西番莲苷VI和葡糖鞘氨醇;心材中含量在前10位的代谢物为kanokoside A(图1)、PE[15∶0/18∶3(6Z, 9Z, 12Z)]、银杏内酯C、螺内酯D、奎尼酸、西番莲苷VI、PE[14∶1 (9Z)/18∶3 (9Z, 12Z, 15Z)]、葡糖鞘氨醇、紫胶烯C和6-(2-羧乙基)-7-羟基-2,2-二甲基-4-苯并二氢吡喃酮葡萄糖苷。

图1 4-羟基-5-(3′,4′-二羟基苯基)-戊酸-O-甲基-O-葡萄糖醛酸苷(a)和kanokoside A (b)的化学结构Fig. 1 Chemical structures of 4-hydroxy-5-(3′,4′-dihydroxyphenyl)-valeric acid-O-methyl-O-glucuronide (a) and kanokoside A (b)
2.2 心边材代谢物的相关性分析
依据代谢物在不同样本间的表达情况,对样本进行PCA和相关性热图分析,结果见图2,可判断组内样本的相似性和组间样本的差异性。图2a 中每个格子表示两个样本之间的相关性,不同颜色代表样本间相关系数的相对大小,聚类树枝的长度表示样本间相对距离的远近,同一枝上的样本相似性更接近。由图2a可以看出,柚木心材与边材之间的相关性较小,而心材与心材之间、边材与边材之间的相关性较大。由样本PCA得分(图2b)可以看出,QC样本聚在一起,说明样本间的重复性良好,在分析过程中分析系统稳定,所得的实验数据可信度高。主成分1和主成分2对模型的累积差异解释率为0.568(>0.5),说明PCA模型效果较好。此外,心材和边材的样本点均在置信椭圆内,说明组间重复性较好,边材和心材的置信椭圆离得较远,说明柚木边材和心材代谢物存在显著差异。从整体上看PCA得分图,心材之间的聚集性大于边材之间的聚集性,说明心材样本中所含代谢物的组成和浓度比边材样本更为接近。
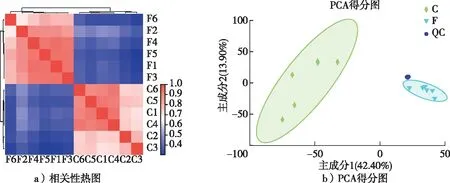
图2 柚木代谢物的相关性热图和PCA得分图Fig. 2 Correlation heat map and PCA score plot of T. grandis metabolites
2.3 心边材代谢物的正交-偏最小二乘法分析
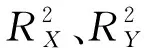

表2 OPLS-DA模型参数Table 2 OPLS-DA parameters

R2=(0,0.7247), Q2=(0,-0.1536)。图3 OPLS-DA置换检测Fig. 3 OPLS-DA permutation test
2.4 心边材显著性差异代谢物的分析
柚木心边材显著性差异代谢物的分析结果见聚类热图(图4a)和火山图(图4b)。图4a中每列表示一个样本,每行表示一个代谢物,图中的颜色表示代谢物在该组样本中相对表达量的大小。图左侧为代谢物的树状聚类,右侧为代谢物名称,两个代谢物分支离得越近,说明它们的表达量越接近;图上方为样本的树状聚类,下方为样本名称,两个样本分支离得越近,说明这两个样本代谢物的表达量变化趋势越接近。从图4a可以看出,同一化合物在心材之间、边材之间的表达量差异较小,而心材与边材之间的表达量差异较大,说明柚木心材和边材之间代谢物存在显著差异。

图4 柚木心边材差异代谢物的聚类热图和火山图Fig. 4 Cluster heat map and volcano map of different metabolites in the heartwood and sapwood of T. grandis
图4b中,红色点代表显著升高的代谢物,绿色点代表显著下降的代谢物,灰色点代表差异不显著的代谢物。经筛选鉴定发现供试柚木心材和边材中共分析出9 211个峰(定性到705个代谢物),其中差异峰有3 396个。从差异峰中共定性到328个显著差异的代谢物,包括脂质和类脂质分子69个、苯丙素和聚酮类57个、含氧有机物50个、有机杂环化合物41个、有机酸及其衍生物24个、苯环衍生物23个、核苷/核苷酸和类似物8个、含氮有机物2个、生物碱及其衍生物2个、木脂素/新木脂素及相关化合物1个和其他化合物51个。在这些显著差异代谢物中,与边材相比,有235个代谢物在心材中显著升高,上调代谢物占总代谢物的71.65%,有93个代谢物在心材中显著降低,下调代谢物占总代谢物的28.35%,进一步表明心材和边材代谢物存在明显差异。
2.5 心边材差异代谢物代谢途径和富集分析
柚木心材和边材差异代谢物的KEGG代谢通路和富集分析结果见图5。柚木心边材的差异代谢物被注释到代谢、遗传信息处理和环境信息处理等3个一级通路,28个差异代谢物被注释到膜运输、转运、氨基酸代谢、碳水化合物代谢、能量代谢、脂质代谢、辅助因子和维生素代谢、其他氨基酸代谢、萜类和聚酮化合物代谢、核苷酸代谢和其他次生代谢产物生物合成等11条二级代谢通路(图5a)。对被注释到的差异代谢物进行分析,发现在心材中上调的代谢物有13个。图5b显示了重要性得分前20的通路,其中半乳糖代谢、氨基糖及核苷酸糖代谢分别富集了4个代谢物,戊糖和葡萄糖醛酸的相互转化通路、精氨酸生物合成以及玉米素生物合成均富集了3个代谢物,D-精氨酸和D-鸟氨酸代谢、组氨酸代谢、淀粉和蔗糖代谢、精氨酸和脯氨酸代谢、谷胱甘肽代谢、异黄酮生物合成以及色氨酸代谢各富集了2个代谢物,碳青霉烯生物合成、花青素生物合成、生物素代谢、甘油酯代谢、赖氨酸生物合成、抗坏血酸和醛酸代谢、糖酵解/糖异生以及牛磺酸和低钙氨酸代谢各富集了1个代谢物。总体看来,柚木心边材差异代谢物参与氨基酸的合成较多。值得注意的是,黄酮类生物合成共富集了3个代谢物,其中异黄酮生物合成富集了2个代谢物,花青素生物合成富集了1个,心边材差异代谢物被富集到黄酮类化合物的生物合成中可能是造成柚木心材和边材颜色明显差异的原因之一。

图5 心材和边材差异代谢物的KEGG代谢通路和富集图Fig. 5 KEGG metabolic pathway and enrichment of different metabolites in heartwood and sapwood
2.6 心边材显著差异代谢物中相对含量前30代谢物的鉴定分析
木材形成是一个系统的代谢反应过程,伴随大量的前驱物、中间体、酶类等的共同参与。因此,阐明木材形成中的代谢物种类、分布规律及其代谢途径,将有助于揭示木材细胞壁的构建机制和木材呈色机制。木材抽提物中包含结构类型多样的不饱和和共轭的酚类结构(如黄酮类、醌类、苯丙素类等),在木材着色过程中发挥着重要的作用[15-16]。在心边材328个显著差异代谢物中筛选出相对含量前30的代谢物,按样本之间代谢物浓度的差异倍数(FC值)降序排列如表3所示。30个代谢物在心材中均受到上调,其中8-乙酰基埃格尔内酯、(all-E)-3,5,7-Tridecatriene-9,11-diyn-1-ol、谷胱甘肽异磺酰离子、1,2-脱水白色向日葵素和Yucalexin P-15等5个代谢物含有不饱和结构,其余25个代谢物均为含有共轭体系的芳香杂环或酚(苷)类衍生物,推测这些代谢物可能是造成心边材色差明显的主要原因之一。

表3 心边材显著差异代谢物中相对含量前30的代谢物Table 3 The top 30 significant different metabolites in heartwood and sapwood
3 结 论
本研究首次采用UPLC-Triple-TOF-MS分析手段,结合PCA和OPLS-DA等统计分析方法,对1995年栽种于云南省德宏州盈江县国有林场6株柚木树心边材中的次生代谢产物进行了分析比较。主要结论如下:
1)12个柚木样品数据经LC-MS数据分析软件分析处理,并在HMDB和METLIN等数据库中进行搜库,在正负两个离子模式下,共定性得到705个代谢物;其中脂类和类脂类分子最为丰富。
2)心边材中相对含量最高的代谢物分别为环烯醚萜苷kanokoside A和4-羟基-5-(3′,4′-二羟基苯基)-戊酸-O-甲基-O-葡萄糖醛酸苷。
3)柚木心材和边材的代谢物存在显著差异,从心边材中共鉴定出差异代谢物328个,与边材相比,心材中共有235个代谢物上调,93个代谢物下调。进一步分析发现大多数差异代谢物被富集到各类氨基酸代谢和黄酮类生物合成等代谢通路中。
4)心边材中相对含量前30的显著差异代谢物在心材中均得到上调,且均含有不饱和结构和共轭结构,推测这些代谢物可能与柚木心边材颜色明显差异有关。
