柏木醇及其乙酸酯的制备和抗植物病原菌活性研究
2021-05-31王思禹刘飞周倩徐曙黄申林罗金岳
王思禹,刘飞,周倩,徐曙,黄申林,罗金岳*
(1. 南京林业大学化学工程学院,南京 210037;2. 江苏省中国科学院植物研究所,南京 210014)
柏木油是从柏科或者松科植物中的根、枝干中提取的一种植物精油,具有清甜的柏木香韵[1-2]。我国是柏木油的主要产地之一,也是其主要出口国之一[3]。柏木油的主要成分包括柏木醇、α-柏木烯、β-柏木烯以及其他的一些单萜和倍半萜化合物[4-5]。
柏木醇是广泛存在于柏木油以及杉木油中的一种倍半萜醇[6-7]。近年来,陆续有文献报道了柏木醇及其衍生物的生物活性。Zhang等[8]研究发现,柏木醇对人体肺癌细胞具有良好的细胞毒活性,可引发肺癌细胞的自噬和凋亡。钟雄[9]发现在低浓度下柏木醇对许多微生物有很好的抑菌效果,对真菌类香菇、金针菇、真珠菇及灵芝等也有一定的抑制作用。此外,也有一些研究发现柏木醇具有解痉挛活性,镇静、调节心血管及促进毛发生长等作用[10-12]。乙酸柏木酯是柏木醇系列的一个重要衍生物,具有强烈的木香以及雪松气息,香气稳定持久[13]。
目前中国市场上的农药有80%是化学农药,其带来的环境问题和粮食安全问题越来越不容忽视。与传统的化学农药相比,植物源农药具有可自然降解、对环境污染少、对非靶标生物安全无害、不易产生抗药性等优点[14-15],是促进农业可持续发展以及发展有机农业的理想农药。
笔者研究柏木醇及其衍生物的抗植物病原真菌活性,探究它们作为植物源农药的开发潜力。先对柏木油进行初步鉴定,研究柏木醇的分离与结构确证;再通过3种方法(醋酸酐酰化法、二环己基碳二亚胺法和脲基偶联剂法)探讨乙酸柏木酯的合成,确定适宜的反应条件;进一步通过菌丝生长速率法,研究其对7种植物病原真菌的活性。
1 材料与方法
1.1 材料与仪器
柏木油(上海阿拉丁生化科技股份有限公司),N,N′-二环己基碳二亚胺(DCC,上海阿拉丁生化科技股份有限公司,99%),4-二甲氨基吡啶(DMAP,Sigma-Aldrich公司),(1-氰基-2-乙氧基-2-氧亚乙基氨基氧)二甲氨基-吗啉基-碳鎓六氟磷酸盐(COMU,Sigma-Aldrich公司,99.7%),7-甲基二元六胍(MTBD,Sigma-Aldrich公司,99.7%)。
液相-质谱联用仪(美国安捷伦公司,1260-6500 Q-TOF),核磁共振仪(瑞士布鲁克公司,300 MHz),红外光谱仪(KBr压片)(美国赛默飞公司,Nicolet 380 FT-IR)。
1.2 柏木油化学成分分析
液相色谱-高分辨质谱联用(HPLC-ESI-HRMS)对柏木油的化学成分进行分析。液相紫外检测波长为190~400 nm,色谱柱为Zorbax SB-C18,4.6 mm×100 mm×1.8 μm。流动相A为甲醇,流动相B为含0.1%甲酸的水溶液。洗脱条件:0~20 min,流动相A体积分数由60%到100%;20~40 min,保持流动相A体积分数100%。流速为0.3 mL/min,柱温35 ℃。质谱条件:电喷雾质谱(ESI+/MS),正离子模式;毛细管电压为4.0 kV,干燥气温度是350 ℃,雾化器压力为3.5×105Pa。
1.3 柏木醇的提取及结构鉴定
取柏木油500 g置于烧杯中,加入25 mL的95%乙醇,使用磁力搅拌器剧烈搅拌2 min,结束后在0 ℃下冷冻结晶12 h。抽滤,将结晶通过减压蒸馏纯化,收集150~156 ℃馏分(真空度1.1 kPa),得到柏木醇粗品。以乙醇溶解柏木醇粗品,再重结晶一次,提高产物纯度。通过HPLC-ESI-HRMS定性,以总离子流图定量(面积归一法),进一步通过核磁共振以及红外对所得产物进行结构确证。
1.4 乙酸柏木酯的合成及结构鉴定
以分离得到的柏木醇为原料合成乙酸柏木酯,结构见图1。由于柏木醇是一个三环大位阻叔醇,具有很大的空间位阻,反应比较困难,尝试了3种不同的方法进行合成,见图2。产物比移值为0.5薄层色谱展开剂为V(二氯甲烷)∶V(甲醇)=8∶1。

图1 柏木醇及乙酸柏木酯Fig. 1 Cedrol and cedryl acetate

a)醋酸酐酰化法; b)DCC法;c)脲基偶联剂法。图2 乙酸柏木酯的合成Fig. 2 The synthesis of cedryl acetate
对合成的乙酸柏木酯,通过HPLC-ESI-HRMS、核磁共振波谱以及红外光谱进行结构确证,以HPLC-ESI-HRMS总离子流图定量(面积归一法)。
1.4.1 醋酸酐酰化法
在三口烧瓶中加入1.3 g柏木醇以及0.7 g醋酸酐,使用二甲苯作为反应溶剂,磷酸作为催化剂,120 ℃下反应4 h。反应结束后,10% NaOH调节pH至中性。30 mL二氯甲烷萃取3次,合并有机相,以饱和食盐水洗涤有机相2次,每次20 mL。有机相以无水硫酸钠干燥过夜,干燥结束后抽滤、减压除去溶剂。最后以硅胶柱层析,洗脱剂为V(二氯甲烷)∶V(甲醇)=15∶1,分离纯化得到产物。
1.4.2 DCC法
在三口烧瓶中加入0.4 g醋酸,以无水二氯甲烷作为溶剂,氮气保护下,加入1.4 g DCC作为脱水剂,冰浴下反应5 min,加入DMAP为催化剂,冰浴反应30 min,加入1.3 g柏木醇后,冰浴继续反应5 min,进一步35 ℃反应6 h。反应结束后,加入10 mL水,以30 mL二氯甲烷萃取3次,合并有机相,以饱和食盐水洗涤有机相2次,每次20 mL。有机相以无水硫酸钠干燥过夜,后续过程同1.4.1。
1.4.3 脲基偶联剂法
在三口烧瓶中加入1.3 g柏木醇以及0.4 g醋酸,再加入2.6 g的脲基偶联剂COMU以及1.8 g的MTBD,10 mL无水N,N-二甲基甲酰胺(DMF)作为溶剂。打开搅拌以及冷凝装置,室温反应16 h。反应结束后,加入10 mL水,反应液用30 mL二氯甲烷萃取3次,合并有机相。使用饱和食盐水洗涤有机相,每次20 mL,重复操作2次。将有机相以无水硫酸钠干燥过夜,后续过程同1.4.1。
1.5 抗植物病原真菌活性测定
采用菌丝速率生长法对柏木醇以及乙酸柏木酯的抗植物病原真菌活性进行研究。柏木醇和乙酸柏木酯溶于二甲基亚砜(DMSO)制成10 mg/mL的母液,将马铃薯蔗糖琼脂(PSA)培养基加热融化后室温放置,当培养基冷却至55 ℃左右时,加入母液使其终质量浓度分别为25,50,100,150和200 μg/mL,倒入培养皿中制成含药平板。以含等体积DMSO的PSA平板为溶剂对照,PSA空白平板(不加溶剂或者药液)为空白对照(排除溶剂对病原菌生长的影响)。将真菌分别接种于PSA平板上,并在25 ℃生化培养箱中预培养。用打孔器在预培养生长旺盛的菌落边缘打取直径为5 mm的菌碟,接种于各浓度PSA平板上,25 ℃生化培养箱中培养至空白对照接近长满平板,十字交叉法测量菌落直径(扣除5 mm菌碟直径)。
每个处理重复3次,试验重复2次,测定的7种病原真菌分别是黄瓜灰霉病菌、油菜菌核病菌、小麦赤霉病菌、香蕉枯萎病菌、水稻纹枯病菌、稻瘟病菌以及枸杞炭疽病菌。
抑制率的计算见公式(1):

(1)
1.6 细胞毒活性测试实验
使用四甲基偶氮唑盐微量酶反应比色(MTT)法测试柏木醇以及乙酸柏木酯对人体正常细胞(HFL1)的毒性。将HFL1接种在96孔培养板上,接种密度为每孔100 μL,含有5 000个细胞,培养12 h后,将原培养液替换为含药培养液,于37 ℃、CO2体积分数为5%的培养箱中继续培养72 h后,向每个孔中加入10 μL噻唑蓝(5 mg/L,磷酸缓冲液),37 ℃孵育4 h。孵育结束后去除原细胞培养液,向每个孔中加入100 μL DMSO,振摇5 min,用酶标仪测定每个孔洞的吸光度并计算细胞生长抑制率(公式(2)),酶标仪的检测波长为570 nm。阳性对照为紫杉醇,浓度为0.1 mmol/L。设置5个质量浓度梯度1.25,2.50,5.00,10.00,20.00 mg/L。

(2)
IC50值的计算见公式(3):
IC50=lg-1[Xm-i(∑P- 0.5)]
(3)
式中:Xm表示实验设计的最大质量浓度的对数;i表示相邻两组质量浓度的对数;ΣP表示各组生长的抑制率之和;0.5是经验常数。
2 结果与分析
2.1 柏木醇的分离及鉴定结果
2.1.1 柏木油中柏木醇的初步鉴定结果
柏木油化学成分复杂,主要成分包括柏木醇、α-柏木烯、β-柏木烯、花侧柏木烯、长叶烯、罗汉柏木烯等。使用HPLC-ESI-HRMS对柏木油进行初步检测分析(总离子流图见图3),证实该方法可以应用于柏木油中主要成分柏木醇的鉴定,其中柏木醇保留时间为5.54 min(图3箭头所示化合物)。

图3 柏木油总离子流图Fig. 3 TIC of cedar wood oil
通过质谱对柏木油中的柏木醇进行鉴定,结果见图4。鉴定了以下的特征MS峰:基峰质荷比(m/z)205.196 9,为脱去一个水得到的[M—H2O+H]+峰;m/z为245.186 2的峰是其[M+Na]+峰。由图4可初步确证,柏木油中存在柏木醇。但由于柏木醇非常容易失水,所以质谱中的分子[M+H]+峰很小,难以被检测到。

图4 柏木醇质谱图Fig. 4 MS of cedrol
2.1.2 柏木油中提取的柏木醇及其结构
采用分馏以及重结晶的方法从柏木油中成功分离得到柏木醇37.5 g,收率为7.5%。通过HPLC-ESI-HRMS、核磁共振波谱以及红外光谱对所得产物进行结构确证,再与文献数据对比,证实产物为柏木醇。
柏木醇的理化、核磁和质谱数据如下:白色结晶,产物色谱纯度为98.0%;熔点为85~87 ℃;1H NMR(CDCl3,300 MHz),δ:0.83(3H,d,J=7.08 Hz,CCHCH3),0.99(3H,s,CHC(CH3)2),1.25(3H,s,CHC(CH3)2),1.34(3H,s,CH2CCH3),1.36~1.91(13H,m,CH或CH2),3.72(1H,q,OH);13C NMR(CDCl3,75 MHz),δ:15.06(C-12),24.86(C-15),27.13(C-4),28.41(C-13),29.70(C-14),31.12(C-10),34.88(C-9),36.52(C-3),40.99(C-2),41.50(C-11),42.91(C-6),53.61(C-1),56.06(C-5),60.58(C-7),74.59(C-8);质谱C15H26NaO [M+Na]+理论值m/z为245.187 6,实际值m/z为245.186 2,C15H25[M-H2O+H]+理论值m/z为205.195 1,实际值m/z为205.196 9。
1H NMR中,醇羟基上质子的化学位移出现在δ3.72。4个CH3化学位移δ分别为0.83(3H,d,J=7.08 Hz,CCHCH3),0.99(3H,s,CHC(CH3)2),1.25(3H,s,CHC(CH3)2),1.34(3H,s,CH2CCH3),与羟基靠近的CH3受到羟基的影响,化学位移向低场移动。在13C NMR中,各个碳的化学位移δ为15.06~74.59。在质谱数据中,目标化合物分子离子峰与理论值均吻合,理论值与实际值误差在0.5% 以内。
柏木醇的红外谱图见图5。由图5可知,3 340 cm-1处为醇羟基的伸缩振动吸收峰,2 958 cm-1处为甲基伸缩振动吸收峰,2 885 cm-1处为亚甲基伸缩振动吸收峰,1 340~1 465 cm-1处为甲基亚甲基弯曲振动吸收峰。
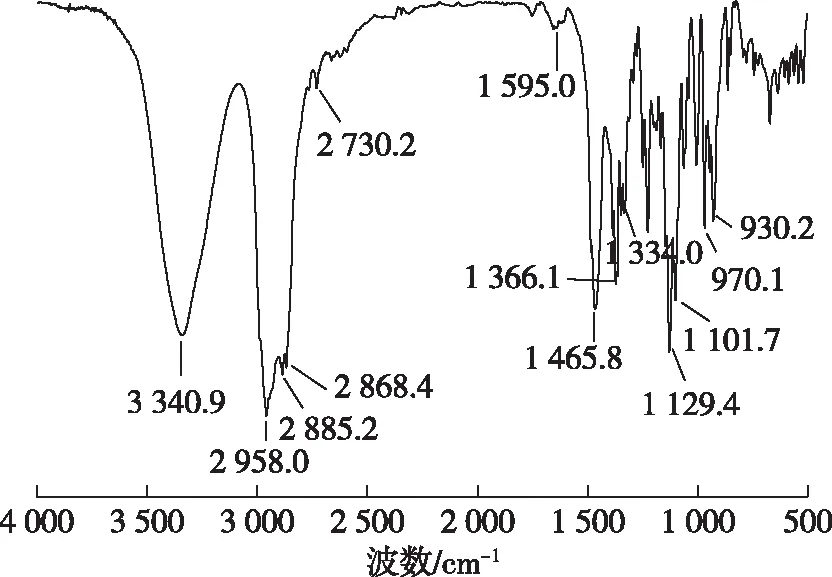
图5 柏木醇的红外谱图Fig. 5 FT-IR spectrum of cedrol
2.2 乙酸柏木酯的合成及结构鉴定结果
2.2.1 乙酸柏木酯的合成
柏木醇作为一个三环大位阻高级叔醇,其酯化是比较困难的,用传统的酯化方法通常无法反应或者产物产率较低。采用醋酸酐酰化法、DCC法以及脲基偶联剂法研究乙酸柏木酯的合成,发现脲基偶联剂能够在比较温和的条件下,对柏木醇进行酯化得到乙酸柏木酯,收率为93.0%。
3种方法中,醋酸酐酰化法需要较高的反应温度,并且收率较低,原因可能是在高温反应的过程中,柏木醇不稳定,失水成为柏木烯,降低了产物的收率(79.1%)。DCC法需要低温冰浴,且反应过程中容易生成副产物二环己基脲(DCU),后处理繁琐,影响了反应的收率(82.2%)。相比之下,脲基偶联剂法反应条件比较温和(室温反应),后处理相对比较简单。
2.2.2 乙酸柏木酯的结构
通过HPLC-ESI-HRMS、核磁共振波谱以及红外光谱对产物进行了结构确证。合成乙酸柏木酯与标准品对比HPLC-ESI-HRMS图谱见图6,乙酸柏木酯的红外谱图见图7。

图6 合成乙酸柏木酯与标准品对比HPLC-ESI-HRMS图谱Fig. 6 HPLC-ESI-HRMS spectrum of synthesized cedryl acetate compared with standard one
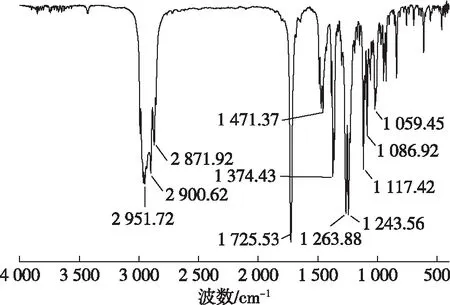
图7 乙酸柏木酯的红外谱图Fig. 7 FT-IR spectrum of cedryl acetate
乙酸柏木酯的理化、核磁和质谱数据如下:白色结晶,产物色谱纯度为98.0%;m.p.为43~45 ℃;1H NMR(CDCl3,300 MHz),δ:0.83(3H,d,J=7.08 Hz,CCHCH3),0.97(3H,s,CHC(CH3)2),1.17(3H,s,CHC(CH3)2),1.57(3H,s,CH2CCH3),1.94(3H,s,OCCH3)1.30~2.05(12H,m,CH or CH2),2.39(1H,d,OCCH);13C NMR(CDCl3,75 MHz),δ:14.96(C-12),22.23(C-14),24.78(C-17),25.33(C-15),26.43(C-4),27.95(C-13),30.74(C-10),32.71(C-9),36.46(C-3),40.48(C-2),40.85(C-11),42.86(C-6),53.47(C-1),56.25(C-5),56.42(C-7),85.74(C-8),169.76(C-16)。HRMS:C17H28NaO2[M+Na]+理论值m/z为287.198 2,实际值m/z为287.197 4;C34H56NaO4[2M+Na]+理论值m/z为551.407 1,实际值m/z为551.405 5。
由图7可知,2 990 cm-1为甲基伸缩振动吸收峰,2 900 cm-1为亚甲基伸缩振动吸收峰,2 871 cm-1为次甲基伸缩振动吸收峰,1 725 cm-1为羰基伸缩振动吸收峰,1 374~1 471 cm-1为甲基亚甲基弯曲伸缩振动吸收峰。乙酸柏木酯的1H NMR中,可以观察到乙酰基上的氢信号δH1.94。在13C NMR中,可以观察到乙酰基上的碳信号δC169.76。在质谱数据中,目标化合物分子离子峰与理论值均吻合,理论值与实际值误差在0.5% 以内。
2.3 抗植物病原真菌活性
采用菌丝生长速率法测定柏木醇和乙酸柏木酯的抗菌谱,结果见表1及表2。测定了5个质量浓度下的抗真菌活性,测定对象包括7种真菌,分别为黄瓜灰霉病菌、油菜菌核病菌、小麦赤霉病菌、香蕉枯萎病菌、水稻纹枯病菌、稻瘟病菌和枸杞炭疽病菌,活性较好的结果见图8。

表1 柏木醇对植物病原真菌的抑制率Table 1 Inhibition rate of cedrol on plant pathogenic fungi %

表2 乙酸柏木酯对植物病原真菌的抑制率Table 2 Inhibition rate of cedryl acetate on plant pathogenic fungi %

DMSO,从左至右样品质量浓度依次为25,50,100,150,200 μg/mL。a)柏木醇对黄瓜灰霉病活性;b)柏木醇对水稻纹枯病菌活性;c)乙酸柏木酯对水稻纹枯病菌活性。图8 化合物的抗植物病原菌活性Fig. 8 Antifungal activity of the compounds
实验结果显示:柏木醇和乙酸柏木酯对所测试的部分植物病原真菌显示了一定的抑制作用。
柏木醇对黄瓜灰霉病菌最高抑制率为70.39%(200 μg/mL),对水稻纹枯病菌最高抑制率为60.99%(200 μg/mL),对油菜菌核病菌及小麦赤霉病菌的最高抑制率也超过了50%,对枸杞炭疽病菌的活性最差,几乎没有活性。当柏木醇作用于黄瓜灰霉病菌时,在低浓度下也具有一定的活性,当浓度达到100 μg/mL时,进一步提高柏木醇的浓度其活性不会增加;柏木醇作用于水稻纹枯病菌时,在低浓度时活性不很明显,当质量浓度从50 μg/mL 提高到100 μg/mL时,活性显著提高。
与柏木醇相比,乙酸柏木酯对7种真菌的活性有所降低。对水稻纹枯病菌有一定的活性(其最高抑制率为46.70%),且随着用药浓度的增加,抑制率也逐步增加,有着较好的线性关系;对枸杞炭疽病菌及油菜菌核病菌几乎没有活性。说明,对于柏木醇而言,羟基是必要的活性基团,乙酰基的引入会造成活性的降低。
对于植物源化合物的抗植物病原菌活性,已经有很多相关的研究。如曹妍[16]发现小白菊内酯在10 μg/mL时,对油菜菌核病菌就有很好的抑制效果,抑制率可达72.6%。对于水稻纹枯病菌,小白菊内酯的抑制率也达到了33.6%。郭现翠等[17]发现吴茱萸次碱的衍生物对于植物病原真菌活性一般,但对细菌性病菌有一定的抑制作用,经过修饰的吴茱萸次碱可对水稻白叶枯病菌达到81.8% 的活性。与这些已经报道的同类型植物源化合物相比,柏木醇具有对于某些植物病原菌(如水稻纹枯病菌)更突出的活性,且具备一定的选择性。因此,该类化合物具备一定的开发前景以及探索价值,尤其是进一步对其结构进行衍生化。
2.4 细胞毒活性测试结果
细胞毒活性实验结果表明,柏木醇以及乙酸柏木酯对人体正常细胞的IC50大于80 μmol/L,证实柏木醇及乙酸柏木酯对人体正常细胞(HFL1)的细胞毒活性较低,即对人体正常细胞几乎没有毒性。该结果证实柏木醇以及乙酸柏木酯对于人畜以及其他非靶标生物产生影响的可能性较小,具有安全无害的优点,进一步证实了柏木醇以及乙酸柏木酯作为新型无害的植物源农药的潜力。
3 结 论
柏木油化学成分十分复杂,使用HPLC-ESI-HRMS对其中的主要成分之一柏木醇进行了初步鉴定,通过分馏以及重结晶的方法对柏木油中的柏木醇进行了分离,得到了纯度为98.0%的柏木醇。作为大位阻高级叔醇,柏木醇的酯化比较困难,笔者使用脲基偶联剂以较温和的条件成功地合成了乙酸柏木酯,采用HPLC-ESI-HRMS、核磁共振以及红外对产物进行了结构确证。
随着经济的发展,人们越来越重视环境安全问题,其中尤其引起人们关注的是化学农药的大量应用带来的环境问题。随着现代农业的飞速发展,对环境影响小的植物源农药迎来了难得的发展机遇。通过菌丝速率生长法测定了柏木醇以及乙酸柏木酯的抗菌活性,结果表明柏木醇具有较好的活性,对黄瓜灰霉病菌和水稻纹枯病菌抑制效果明显,乙酸柏木酯在对水稻纹枯病菌及稻瘟病菌也具有一定的抑制作用。本研究为柏木醇及其衍生物在植物源农药领域的开发利用提供了一定的依据。作为世界柏木油产量大国,我国柏木油的深加工利用具有广阔的市场前景,笔者还为柏木油高附加值系列产品的开发提供了一定的借鉴。
