不同饲喂水平对绵羊睾丸发育、睾酮合成相关基因及雄激素受体(AR)表达的影响
2021-05-28牛宏泽姚晓磊宋瑞高吕丽华张春香张建新任有蛇
石 磊,牛宏泽,姚晓磊,宋瑞高,吕丽华,张春香,张建新,任有蛇
(山西农业大学动物科学学院,太谷 030801)
动物的生长发育和正常代谢机能的维持都与饲料营养水平有密切的联系[1-2]。生殖机能同其他机体生理功能一样,都需要多种营养物质维持,机体通过为配子发生、受精、胚胎发育、妊娠等活动提供特定的营养元素来直接或间接调控动物的生殖机能[3-5]。研究表明,短期限饲不仅可以影响血液中氨基酸、葡萄糖含量和代谢相关酶类的水平,还能通过调控雌激素和睾酮水平抑制卵泡发生[4]。日粮营养水平能通过调控卵泡中促卵泡素受体(follicle stimu-lating hormone receptor,FSHR)和黄体生成素受体(luteinizing hormone receptor,LHR)的表达来影响卵泡的发育[6]。生产中也经常发现,体况差的雌性动物通常表现出不发情、不排卵和受胎率降低等一系列繁殖障碍。对于雄性动物,旺盛的性欲和良好的精液品质是保障母畜受胎率的关键,日粮营养就显得尤为重要。研究发现,营养水平可以影响动物睾丸的发育和精子发生,营养低下会降低公畜睾丸重量和精子细胞的数量,从而导致精子活力差、密度低和睾酮水平下降[7-8]。这说明营养水平不但能通过调控代谢机能影响动物的体况,还能通过下丘脑-垂体-性腺轴的相应受体作用于生殖系统,进而影响动物的生殖机能。
雄性动物生殖系统发育和正常生精机能的维持主要依靠雄激素,雄激素以睾丸间质细胞分泌的睾酮(testosterone,T)为主。睾酮是以胆固醇为原料,在类固醇合成急性调节蛋白(steroidogenic acute regulatory protein,StAR)的调控下经细胞色素P450家族成员11A1(cytochrome P450 family 11 subfamily A member 1,CYP11A1)裂解其侧链成为孕烯醇酮,然后由3β-羟基类固醇脱氢酶(3β-hydroxysteroid dehydrogenase,3β-HSD)转化为孕酮,孕酮在内质网由细胞色素P450单加氧酶(cytochrome P450 steroid 17-α-monooxygenase,CYP17A1)催化转变为脱氢表雄酮后代谢为睾酮[9]。与靶细胞内雄激素受体(androgen receptor,AR)的特异性结合是睾酮发挥其生物学效应的关键[10-11]。研究者对AR的结构、功能和定位进行了大量研究,但目前,AR在不同种类雄性动物生殖器官中的表达部位仍然存在较大争议[12-14]。与其他固醇类激素受体类似,AR是一种具有配体活性的转录因子,一旦被雄激素激活便能识别靶基因上的雄激素反应元件(androgen response element,ARE)并与之结合,ARE主要位于目的基因附近,通过结合目的基因的启动子或沉默子来增强或抑制靶基因转录,最终使细胞的功能发生改变[15]。目前,关于营养对动物繁殖性能影响的研究主要侧重于母畜发情[16-17]、胚胎发育[18]及初生仔畜成活率[19]等方面,对雄性动物繁殖性能的影响主要集中在精液品质方面[20-22],关于睾酮合成及其作用机理等方面的研究相对较少。
本试验以杜泊羊(♂)×晋中绵羊(♀)杂交F1代公羔为研究对象,通过采食量调控羔羊营养水平,研究不同饲喂水平对绵羊睾丸发育、T水平及T合成相关基因及AR表达的影响,同时对AR在绵羊睾丸组织中的定位进行了研究,以期为通过营养水平调控绵羊繁殖性能,充分发挥其生殖潜力提供科学依据。
1 材料与方法
1.1 试验设计与试验动物
本研究采用单因素完全随机设计,将18只体况良好和体重相近((35±0.5) kg)的杜泊羊(♂)×晋中绵羊(♀)F1代杂交4月龄公羔随机分为3组,每组6只。以平均日增重为目标,根据绵羊采食量的标准,分别按自由采食(AL组)、自由采食量的65%(AL65组)和自由采食量的40%(AL40组)3个饲喂水平投喂全混合颗粒饲料。AL40组为维持采食量组,其平均日增重为0 g·d-1,AL65组日增重维持在150 g·d-1,AL组日增重维持在300 g·d-1。当AL组任意1只绵羊的体重达到50 kg时全部进行屠宰。
1.2 主要试剂
Trizol、反转录试剂盒、荧光定量试剂盒均购自TaKaRa公司;Rabbit Anti-AR 和Rabbit Anti-β-actin多克隆一抗、HRP标记的Goat Aniti-Rabbit二抗,DAB、即用型SABC免疫组化试剂盒等均购自武汉博士徳公司;BSA、NC膜、SDS-PAGE制胶试剂盒、BCA蛋白定量试剂盒、Marker等均购自索莱宝公司;绵羊睾酮ELISA试剂盒购于上海蓝基生物公司;其他常用试剂为国产分析纯。
1.3 试验日粮
本研究的试验日粮配方参考NRC(2007)绵羊营养需要量配制全混合颗粒饲料。试验日粮的组成及营养水平见表1。

表1 试验日粮组成及营养水平(干物质基础)Table 1 Composition and nutrient levels of the experimental diet (DM basis) %
1.4 羔羊饲养管理
试验羊只采用全舍饲单栏饲养,预饲期10 d,正饲期55 d。预饲前打耳号、驱虫、免疫,使其适应试验日粮,进入正饲期后,严格按照配方要求提供颗粒饲料。掌握其采食情况,并适当调整体重,使其尽可能一致。根据预饲期的采食量确定AL组日饲喂量。每日记录个体采食量,并在晨饲前清除饲槽内剩料,记录剩料量,保证自由采食组剩料量约为饲喂量的10%,并根据AL组的采食量确定AL65组和AL40组的日饲喂量。每日于08:00和18:00两次饲喂,自由饮水,圈舍温度维持在合理的范围内。当AL组中任意1只绵羊体重达到50 kg时,饲喂试验结束。
1.5 睾丸样品采集
饲喂试验结束后,手术法摘取绵羊睾丸,分别测定睾丸的周径与长度;采集的睾丸组织分为两部分:一部分切成0.5 cm×0.5 cm×0.2 cm的组织块,4%多聚甲醛固定;另一部分用锡纸包好后放入冻存管,立即投入液氮保存,带回实验室后放入-80 ℃冰箱保存备用。
1.6 试验方法
1.6.1 睾丸组织切片观察 常规方法制作睾丸组织的石蜡切片,经过H-E染色后在显微镜(Olympus BX53,Japan)下观察,每个切片随机选取5个不同的视野,使用Image-Pro Plus 7.0软件测定曲精细管直径、生精上皮厚度和生精细胞与间质细胞密度。
1.6.2 实时定量PCR检测基因表达情况 使用Trizol法提取绵羊睾丸组织的总RNA,用核酸蛋白测定仪(ND-1000,NanoDrop)进行质检后反转录合成cDNA。根据NCBI提供的绵羊睾酮合成基因(STAR、3β-HSD、CYP11A1和CYP17A1)、AR和18S的mRNA序列,使用Primer Premier 5.0软件设计引物(表2),由上海生工生物工程公司合成。扩增操作按照SYBR Premix Ex TaqTM试剂盒建议的反应条件,构建反应体系,总体系为20 μL:SYBR Premix Ex TaqTM10 μL,正、反向引物各0.8 μL,cDNA模板1.0 μL,ddH2O 7.4 μL,每个样本3次重复。

表2 荧光定量PCR的引物Table 2 Primer sequences used for qRT-PCR in this study
1.6.3 酶联免疫吸附试验(ELISA)测定睾酮(T)水平 将不同处理的睾丸组织进行匀浆,严格按照试剂盒操作说明进行。通过测定6个浓度标准品的浓度值和对应的OD值,使用四参数Logistics曲线拟合法,横坐标为T浓度,纵坐标为OD值,拟合出标准曲线。使用此标准曲线的方程,结合各待测样品的OD值,计算出各个样品的T浓度。
1.6.4 蛋白免疫印迹法分析雄激素受体(AR)丰度 提取绵羊睾丸组织的总蛋白并测定蛋白浓度,然后进行Western blotting 检测。蛋白上样量为60 μg,SDS-PAGE电泳采用5%浓缩胶80 V 30 min,10%分离胶120 V 1.5 h,转膜条件为100 V 1.5 h,5%脱脂奶粉封闭1 h,孵育Rabbit Anti-AR(1∶200)和Rabbit Anti-β-actin(1∶400)多克隆一抗,4 ℃过夜,TBST洗3次,每次10 min,Goat Anti-Rabbit(1∶1 000) 二抗室温孵育1 h,TBST洗3次,每次10 min,ECL曝光后观察并拍照。
1.6.5 雄激素受体(AR)的免疫组织化学定位分析 取睾丸组织切片,常规方法脱蜡至水,滴加3% H2O2,37 ℃ 10 min;PBS冲洗3次,各3 min;柠檬酸缓冲液98 ℃抗原修复,待冷却至室温;5%BSA室温封闭 30 min;滴加Rabbit Anti-AR一抗(1∶200)4 ℃过夜后PBS洗3次,加HRP标记二抗37 ℃ 30 min;同时设置阴性对照,一抗用PBS代替。Olympus生物显微镜(BX53)观察,并使用Image-Pro plus 7.0软件拍照。
1.7 数据处理
qRT-PCR数据使用2-△△CT方法计算相对表达量。用Image J软件对免疫印迹条带的灰度值进行分析。数据结果采用SPSS统计软件使用单因素方差分析(one-way ANOVA),Duncan’s法进行多重比较,结果表示为“平均值±标准误(SEM)”。
2 结 果
2.1 不同饲喂水平对绵羊睾丸发育的影响
不同饲喂水平对绵羊睾丸发育的分析结果如表3所示,绵羊睾丸的周径与长度随着饲喂水平的提高而升高,其中,AL组显著(P<0.05)高于AL40组,但与AL65组间差异不显著(P>0.05)。对绵羊睾丸组织结构的观察发现(图1),AL组睾丸曲精细管生精上皮厚度显著高于限饲组(P<0.05),但AL40和AL65组间差异不显著(P>0.05),不同营养水平对绵羊睾丸曲精细管直径无明显影响(P>0.05)。曲精细管中均可观察到各级生精细胞和间质细胞,随着饲喂水平的提高,生精细胞和间质细胞的密度显著增加(P<0.05)。

表3 不同饲喂水平条件下绵羊睾丸发育的形态学和组织学参数Table 3 Testicular morphological and histological parameters of sheep under different feeding levels

A.AL40组;B.AL65组;C.AL组A.AL40 group;B.AL65 group;C.AL group图1 不同饲喂水平条件下绵羊睾丸组织H-E染色结果(400×)Fig.1 H-E staining results of testis in sheep under different feeding levels(400×)
2.2 不同饲喂水平对绵羊睾丸睾酮分泌和睾酮合成相关基因表达的影响
如图2所示,AL40组绵羊睾丸组织中T水平最低,随着饲喂水平的提高,睾丸组织中的T水平显著提高(P<0.05)。通过对睾丸组织T合成相关基因表达的分析(图3)发现,AL组中STAR和3β-HSD基因的相对表达量均显著高于限饲组(P<0.05),其表达情况与睾丸组织T水平的变化一致。AL组中CYP17A1和CYP11A1基因也均呈现高表达,且显著高于AL40组(P<0.05);AL65和AL40组间CYP17DA1和CYP11A1基因的表达量差异不显著(P>0.05)。
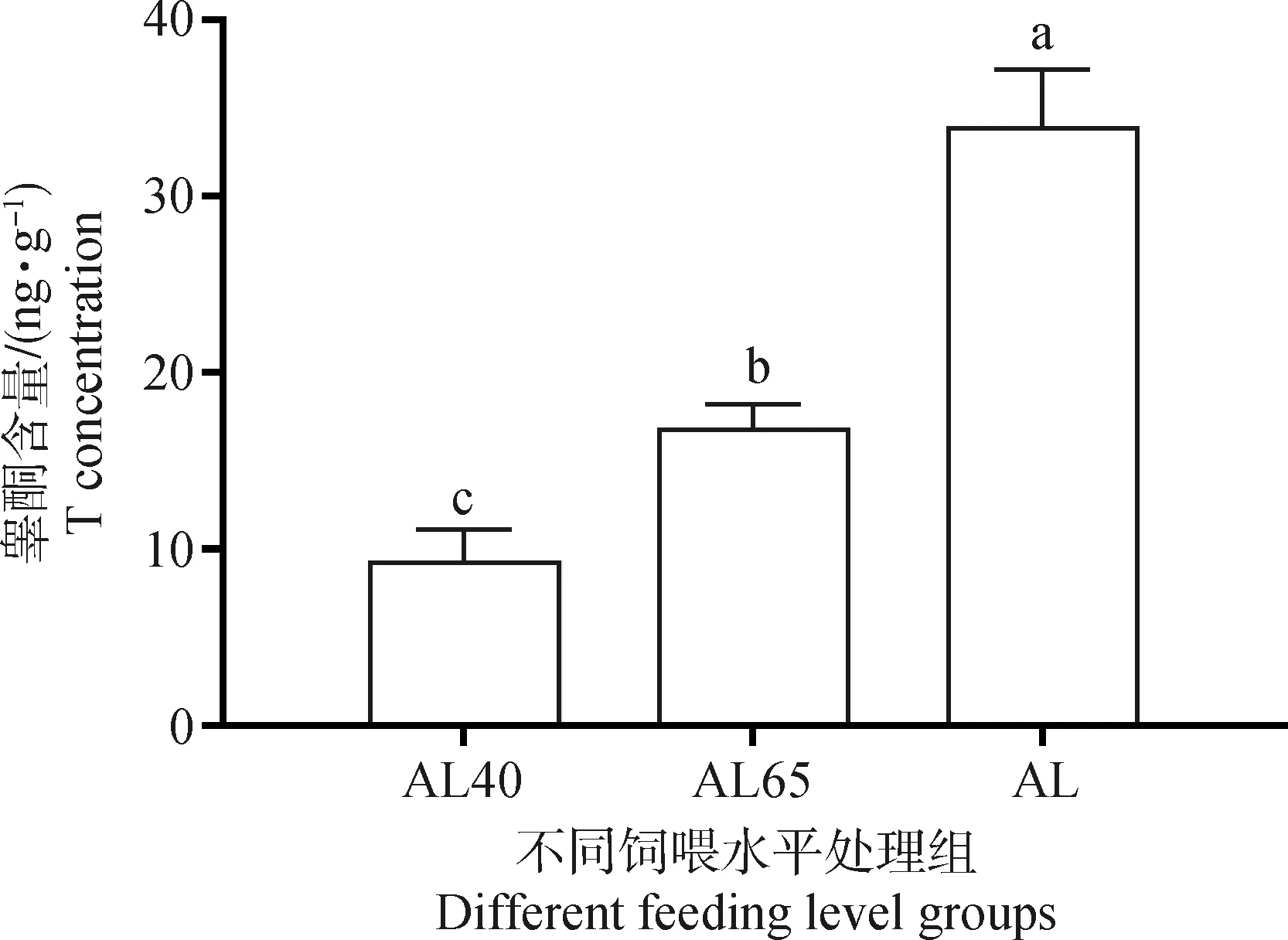
不同字母表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05),下同Different letters mean significant difference (P<0.05),same letter means no significant difference (P>0.05),the same as below图2 不同饲喂水平绵羊睾丸组织中的睾酮含量Fig.2 Testosterone content in testis of sheep under different feeding levels
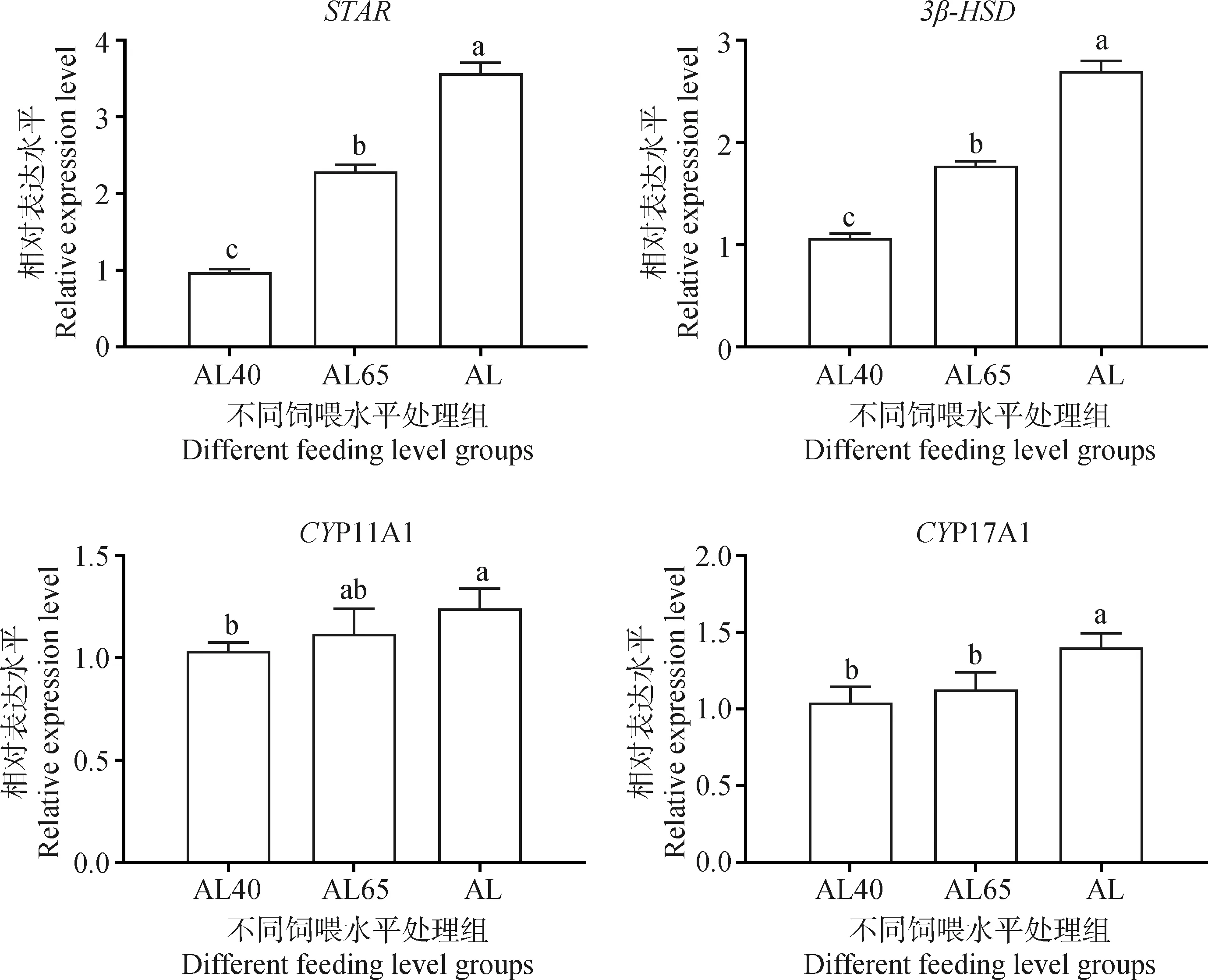
图3 不同饲喂水平下睾酮合成相关基因在绵羊睾丸中的相对表达量Fig.3 Relative expression level of T synthesis-related genes in the testis of sheep under different feeding levels
2.3 不同饲喂水平对绵羊睾丸组织AR mRNA和蛋白表达的影响
由图4可知,AL40组睾丸组织中ARmRNA的相对表达量(图4A)最低,随着饲喂水平的提高而显著提高(P<0.05)。AR蛋白丰度(图4B)与mRNA的表达情况基本一致,即AL组>AL65组>AL40组。

图4 不同饲喂水平下AR mRNA和蛋白在绵羊睾丸中表达量Fig.4 The expression of AR mRNA and protein in the testis of sheep under different feeding levels
2.4 绵羊睾丸中AR蛋白的定位
AR蛋白在绵羊睾丸组织中定位的结果如图5所示,曲精细管中部分精原细胞、初级精母细胞和精子细胞可以检测到阳性信号,睾丸间质细胞、管壁肌样细胞和血管平滑肌细胞均可检测到AR阳性信号。

A.间质细胞和曲精细管的生精细胞;B.间隙中的血管和曲精细管的生精上皮。Sg.精原细胞;PS.初级精母细胞;St.精子细胞;LC.间质细胞;PMC.曲精细管管周肌样细胞;BV.间质血管平滑肌细胞A.Leydig cells and spermatogenic cells;B.Interstitial blood vessel and the germinal epithelium of seminiferous tubule.Sg.Spermatogonia;PS.Primary spermatocytes;St.Spermatid;LC.Leydig cells;PMC.Peritubular myoid cells;BV.Smooth muscle cells of interstitial blood vessel图5 AR在绵羊睾丸组织中的免疫组化定位 (400×)Fig.5 Localization of AR in testis of sheep using immunohistochemistry (400×)
3 讨 论
生殖器官指数能够在一定程度上反映动物机体的生殖机能状况[23]。本试验首先检测了不同饲喂水平下羔羊睾丸的整体发育情况,发现AL组绵羊睾丸的周径与长度显著高于AL40组。由于所用试验动物初始体况基本一致,绵羊睾丸的周径和长度出现的差异应是由于不同营养水平导致的,这说明饲喂水平对羔羊睾丸的生长发育有一定的影响。Pang等[24]的研究也发现,30%的能量限制对绵羊睾丸的发育有明显影响,造成了睾丸重量和生精细胞数量下降。然而,在本研究中,AL65组和AL组绵羊睾丸的周径与长度差异不显著,这说明日粮饲喂水平在基本满足动物机体基本营养需要的情况下,继续提高营养水平并不能显著促进绵羊睾丸的生长发育,这与前人在绵羊上的研究结果基本一致[23-26]。此外,从睾丸组织形态学分析的结果可以看出,随着营养水平的降低,曲精细管生精上皮厚度明显下降,生精细胞的数量也逐渐减少,再次说明不同饲喂水平能影响动物睾丸的发育。然而,本试验中不同处理组间绵羊睾丸曲精细管的直径差异并不显著。Glass等[27]的研究发现,低蛋白日粮可造成大鼠睾丸和前列腺的重量下降,但曲精细管直径未发生明显改变。课题组前期在山羊上的研究也观察到,睾丸曲精细管的直径未受到日粮中添加微量元素的影响[28]。这说明曲精细管的直径可能与该物种本身有关。
在动物生殖器官的发育过程中,生殖激素起着最重要的作用。本研究发现,随着饲喂水平的提高,T的分泌量也逐渐增加。这说明饲喂水平能够影响生殖激素的分泌。李碧波等[8]发现,日粮营养水平对山羊血清中的睾酮含量影响极显著,提高能量水平能提高动物的射精量、精子密度和有效精子数。在绵羊上的研究还发现,提高能量水平可通过提高公羊促性腺激素LH和FSH的合成与释放促进睾酮的分泌,从而提高动物的精液品质和繁殖性能[29]。动物的睾酮主要是由睾丸的间质细胞合成和分泌,本研究中睾丸组织T水平的变化与间质细胞密度的分析结果一致,提示,日粮营养水平可以通过改变生殖内分泌来影响睾丸发育,而这可能与营养水平调控间质细胞的增殖有关,但也不能排除营养水平可以影响睾酮合成的可能性,因此,其确切机理还有待进一步研究。为此,本试验通过qRT-PCR方法对睾酮合成相关基因STAR、3β-HSD、CYP11A1和CYP17A1的表达量进行分析,发现AL组的高营养水平显著增强了这些基因的表达。这说明营养水平可以影响间质细胞中睾酮合成基因的表达,从而提高睾丸组织中的睾酮水平。这些结果表明,营养水平对于雄性生殖机能的调控是多方面的,营养物质在促进间质细胞增殖的同时,还促进睾酮合成基因的表达。这也从另外一方面体现了营养物质对动物机体发育和生理功能调控的复杂性。
雄激素与靶细胞上对应的雄激素受体特异性结合才能发挥其生物学效应[10-11]。马瑞等[30]通过在大鼠血管平滑肌细胞中添加不同浓度的T,发现一定浓度的T能够促进细胞的增殖,同时AR表达水平也得到了上调。最近,在山羊睾丸上皮细胞和小鼠支持细胞上的研究也发现,T能显著增强细胞中AR的表达[31-33]。提示,睾丸中T作用的发挥与AR的表达水平有着必然的联系。研究发现,T不仅可以影响AR的表达,还能通过结合AR激活下游信号通路中精子发生关键信号分子的表达,从而调控动物的生精机能[33]。可以推测,营养水平不同造成睾丸中T的差异势必会引起AR表达水平的变化,这样才能充分发挥睾酮的生殖调控功能。因此,本试验采用qRT-PCR和Western blotting的方法研究了AR mRNA和蛋白的表达情况,结果发现,AR蛋白表达规律与mRNA丰度趋势基本一致,随着饲喂水平的提高,其表达量也相应的提高。这说明,饲喂水平可能通过改变睾丸AR的表达,发挥T对睾丸生精上皮发育和精子发生过程的调节作用,从而影响动物的生殖机能。Genovese等[34]在大鼠上的研究发现,限饲能显著降低睾丸中AR的表达。另外,在卵巢上的研究也表明,饲喂水平通过改变LHR和FSHR的表达量促进FSH和LH对卵泡的发育调节作用[4,6,35]。这充分说明,饲喂水平能够调节生殖激素相关受体表达水平,从而影响动物配子发生与生殖器官发育。
目前,AR在不同种类雄性生殖器官中的表达部位仍然存在争议。本研究同时采用免疫组化的方法对绵羊睾丸中AR进行了定位分析,结果发现,AR在精原细胞、初级精母细胞、精子细胞、管周肌样细胞、血管平滑肌细胞和间质细胞均有表达。这与李振等[36]的研究结果一致。Ge等[37]的研究发现,AR在绵羊睾丸中呈现高表达,主要在附睾上皮、基膜、平滑肌、间质细胞和精子中检测到了AR阳性产物。在山羊上的研究也发现,AR在间质细胞中呈现高密度强阳性表达,在各级生精细胞中呈现中等强度的阳性表达[38]。这说明,AR对雄性动物生殖机能发育和精子发生具有重要作用。然而,通过对曲精细管生精上皮不同生精细胞的观察发现,有些生精细胞不表达AR或呈现弱阳性表达,这说明AR在生精细胞中的表达有一定阶段性,可能与精子发生过程中生精细胞所处的时期有关,生精细胞可能只有在增殖和分化的特定时期才会受到雄激素的调控,AR也在这一阶段丰度增加来结合雄激素,从而调控生精细胞的生理活动。当其没有表达AR或AR丰度太低时,说明这些细胞对T的敏感性较差,不具备增殖或向下一级生精细胞分化的条件,其中部分生精细胞可能会凋亡。AR在间质细胞表达,说明T对间质细胞的功能可能存在自反馈调节,AR在间质细胞中的表达对于确保间质细胞的增殖和T分泌功能是非常必要的[39-41]。AR的表达在曲精细管管壁肌样细胞和血管平滑肌细胞中并没有表现出阶段性,这些部位是血睾屏障的重要组成部分,AR的持续高水平表达可能与T的转运和释放有关。
此外,T的合成与分泌受下丘脑-垂体-睾丸轴调控,其中经典的分子信号通路是黄体生成素(LH)-黄体生成素受体(LHR)-环磷酸腺苷(cAMP)-蛋白激酶A(PKA)途径。因此,营养水平是如何通过影响T合成与分泌以及AR的表达来调控睾丸发育和精子的发生过程,仍然需要进一步研究。
4 结 论
较低的饲喂水平抑制了绵羊睾丸发育,降低了曲精细管生精上皮厚度、生精细胞和间质细胞密度。T合成相关基因和AR的表达量随饲喂水平的提高而增加,且与睾酮的变化趋势一致。AR在绵羊睾丸精原细胞、初级精母细胞、精子细胞、管周肌样细胞、血管平滑肌细胞和间质细胞中均有表达。
