红芪多糖对Hep G2细胞胰岛素抵抗模型糖代谢及胰岛素敏感性的影响和机制研究
2021-05-28贺映侠严凤琴明小燕武汉市中心医院全科医学科武汉430000
贺映侠 严凤琴 明小燕 朱 虹 (武汉市中心医院全科医学科,武汉430000)
血脂异常、糖代谢异常、中心性肥胖、动脉粥样硬化等是代谢综合征常见的临床症候群,其以胰岛素抵抗为中心,这些危险因素可以诱导2型糖尿病的发生[1]。肝脏是糖代谢的重要部位,肝细胞胰岛素抵抗发生时主要表现为肝糖原合成水平降低等[2]。HepG2细胞来源于肝癌细胞,其表型同肝细胞相似性极高,高浓度的胰岛素可以诱导HepG2细胞胰岛素抵抗,这也是体外常用的细胞胰岛素抵抗模型[3]。红芪多糖(hedysaryum polysaccharide)是提取自中药红芪中的活性成分,其含有鼠李糖、阿拉伯糖、木糖等多种复杂单糖,有降血压、抗氧化、降血脂、消炎等功效,红芪多糖对糖尿病、肿瘤等临床常见疾病具有明显的治疗作用[4]。研究显示,红芪多糖治疗后的糖尿病大鼠血糖明显降低,胰岛素敏感性增加[5]。PI3K/AKT是一个在人体内广泛存在的信号通路,参与肿瘤、心血管系统疾病等的发生[6-7]。研究表明,PI3K/AKT在肝脏胰岛素抵抗中激活水平下降,激活PI3K/AKT信号通路可以减轻肝细胞胰岛素抵抗水平[8]。现阶段对于红芪多糖在HepG2细胞胰岛素抵抗模型糖代谢以及胰岛素敏感性中的作用及机制尚不明确。本次实验用胰岛素诱导HepG2细胞,建立胰岛素抵抗模型,探讨红芪多糖的作用和机制,为红芪多糖治疗糖尿病提供理论资料。
1 材料与方法
1.1 材料 HepG2细胞购自深圳市百恩维生物科技有限公司;葡萄糖氧化酶试剂盒购自上海晶抗生物工程有限公司;p-PI3K抗体购自上海鑫乐生物科技有限公司;糖原含量检测试剂盒购自北京索莱宝科技有限公司;红芪多糖购自西安天瑞生物技术有限公司;引物由南京金斯瑞生物科技有限公司合成;p-AKT抗体购自上海晅科生物科技有限公司;PI3K/AKT信号抑制剂LY294002购自美国Sigma。
1.2 方法
1.2.1 MTT方法测定HepG2细胞活性 HepG2细胞用含有10%胎牛血清的DMEM细胞培养液培养,培养条件设置为:37℃,5%CO2、95%空气、饱和湿度的培养箱。将HepG2细胞按照每个孔内加2 000个细胞分别种植到96孔板内,过夜培养将孔内的上清去除,再加入含有红芪多糖(终浓度为0、10、20、40、80μg/ml)的细胞培养液继续培养24 h。取出培养板,依次添加15μl的MTT,结合4 h后,弃掉孔中液体,添加DMSO,振荡孵育10 min,经空白孔调零以后,在酶标仪上检测每个孔的OD值,以0μg/ml红芪多糖处理的细胞存活率为100%,分析其余各组细胞存活率变化。
1.2.2 细胞分组及构建HepG2细胞胰岛素抵抗模型 HepG2细胞胰岛素抵抗模型构建方法参照文献[9],HepG2细胞用含2×105mo/lL胰岛素的细胞培养液培养24 h,培养条件为:37℃,5%CO2培养箱。HepG2细胞分成Control、Model、HPS+Model、PIO+Model一共4组,Control组细胞为正常培养的空白对照细胞,Model组细胞按照HepG2细胞胰岛素抵抗模型构建方法处理,HPS+Model、PIO+Model组细胞分别在用胰岛素诱导液培养细胞的同时,在培养液中同时分别添加10μg/ml红芪多糖、50μmo/lL吡格列酮。细胞培养24 h后,进行后续实验检测。
1.2.3 葡萄糖检测试剂盒检测培养液上清中葡萄糖含量 收集Control、Model、HPS+Model、PIO+Model组细胞培养液上清,按照葡萄糖氧化酶试剂盒标准流程检测葡萄糖含量,以没有细胞的孔作为参照,计算细胞葡萄糖消耗量。
1.2.4 肝糖原检测试剂盒检测细胞内糖原合成量 收集Control、Model、HPS+Model、PIO+Model组细胞,采用蒽酮法检测细胞内糖原含量,步骤参照试剂盒说明进行。
1.2.5 qRT-PCR检测PPARγ、PEPCK mRNA表达 收集Control、Model、HPS+Model、PIO+Model组细胞,以GAPDH作为内参,用qRT-PCR方法检测PPARγ、PEPCK mRNA水平。首先用TRIzoi试剂提取各组细胞中的总RNA,配制逆转录体系反转录合成cDNA,体系包括:0.5μl的AMV Reverse Tran‐scriptase、2μl的5×RTbuffer、0.5μl的Oligo-dT、1μl的dNTPs、0.5μl的RNase inhibitor、2μl的RNA,补足DEPC水至10μl,在60℃孵育45 min,95℃孵育5 min,在冰上孵育5 min。取合成的cDNA,进行qP‐CR反应,体系包括:0.3μl的Cap Taq酶、0.6μl的Super Green染料、0.4μl的上游引物及0.4μl的下游引物、10μl的2×PCR Buffer for Super Green、2μl的cDNA,最后添加ddH2O至20μl。PCR仪设置程序为:94℃15 s,58℃15 s,72℃20 s,共40个循环。PCR引物为:PPARγforward 5′-AAAGAAGCCAA‐CACTAAACC-3′,reverse 5′-CTTCCTTACGGAGAGATCC-3′;PEPCK forward 5′-GCTCTGAGGAGGAGAATGG-3′,reverse 5′-TGCTCTTGGGTGACGATAAC-3′;GAPDH forward 5′-TGAACGGGAAGCTCACTGG-3′,reverse5′-TCCACCACCCTGTTGCTGTA-3′。
1.2.6 Western blot检测p-AKT、p-PI3K蛋白表达收集Control、Model、HPS+Model、PIO+Model组细胞,用0.25%的胰蛋白酶消化,在细胞中加入5倍体积的蛋白裂解试剂,冰上反应20 min。4℃,10 000 g离心15 min,吸取上清并分装到EP管中。蛋白浓度测定按照BCA常规方法进行。在每个蛋白样品中添加1/5体积的5×Loading Buffer溶液,放在100℃ 孵育5 min。SDS-PAGE电泳蛋白量为30μg,电压为100 V恒压。肉眼观察蓝色的染料进入到玻璃板的底部边缘以后,停止电泳。取出凝胶,在冰上转膜,转膜电压设置为80 V。转膜结束后,将NC膜取出,置于封闭液中,在室温条件下反应1.5 h;然后将NC膜放在含有一抗的抗体孵育袋中,4℃环境中过夜反应;最后把NC膜放在含有二抗的抗体孵育袋中,室温结合1.5 h。ECL试剂盒显色,根据条带的灰度值分析蛋白表达水平,内参设置为GAPDH。
1.2.7 PI3K/AKT信号抑制剂对红芪多糖的影响 HepG2细胞在用胰岛素诱导液培养细胞的同时,在培养液中同时添加10μg/ml红芪多糖和10μmo/lL PI3K/AKT信号抑制剂LY294002,设置为HPS+LY294002+Model组,以HPS+Model组为参照,分别检测细胞葡萄糖消耗量(步骤同1.2.3)、糖原合成量(步骤同1.2.4)以及细胞中PPARγ、PEPCK mRNA表达(步骤同1.2.5)和p-AKT、p-PI3K蛋白表达(步骤同1.2.6)。
1.3 统计学分析 SPSS21.0软件分析数据,用±s表示,两组间数据比较用t检验,多组差异比较用单因素方差,P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度的红芪多糖对HepG2细胞活性影响 20、40、80μg/ml的红芪多糖处理后的HepG2细胞存活率明显低于0μg/ml的红芪多糖处理组。10μg/ml红芪多糖处理后的HepG2细胞存活率与0μg/ml的红芪多糖处理组没有明显差异。见表1。选用对细胞活性没有影响的10μg/ml红芪多糖做后续实验。
2.2 红芪多糖对HepG2细胞胰岛素抵抗模型葡萄糖消耗量和糖原合成量的影响 与Control组比较,Model组细胞葡萄糖消耗量水平下降,糖原合成量减少。与Model组比较,HPS+Model、PIO+Model组细胞葡萄糖消耗量水平升高,糖原合成量增加。见表2。红芪多糖能够增加HepG2细胞葡萄糖消耗量,改善糖代谢。
2.3 红芪多糖对HepG2细胞胰岛素抵抗模型细胞中PPARγ、PEPCK mRNA表达的影响 与Control组比较,Model组细胞中PPARγmRNA表达水平降低,PEPCK mRNA表达水平升高。与Model组比较,HPS+Model、PIO+Model组细胞中PPARγmRNA表达水平升高,PEPCK mRNA表达水平降低。见表3。
2.4 红芪多糖对HepG2细胞胰岛素抵抗模型细胞中PI3K/AKT信号通路的影响 与Control组比较,Model组细胞中p-AKT、p-PI3K蛋白表达水平降低。与Model组比较,HPS+Model、PIO+Model组细胞中p-AKT、p-PI3K蛋白表达水平升高。见图1和表4。红芪多糖可以激活HepG2细胞胰岛素抵抗模型细胞中PI3K/AKT信号通路。
表1 不同浓度红芪多糖处理后的Hep G2细胞存活率比较(±s)Tab.1 Comparison of Hep G2 cell survival rate after treatment with different concentrations of hedys⁃aryum polysaccharide(±s)

表1 不同浓度红芪多糖处理后的Hep G2细胞存活率比较(±s)Tab.1 Comparison of Hep G2 cell survival rate after treatment with different concentrations of hedys⁃aryum polysaccharide(±s)
Note:Compared with 0μg/ml,1)P<0.05.
Concentrationsof hedysaryumCell survival polysaccharide(μg/ml)rate(%)0 100.00±8.61 1095.26±6.79 2083.14±7.191)4070.22±5.871)8052.36±6.121)F 69.30 P<0.001
2.5 PI3K/AKT信号抑制剂对红芪多糖处理的HepG2细胞胰岛素抵抗模型中PI3K/AKT信号通路的影响 与HPS+Model组比较,HPS+LY294002+Model组细胞p-AKT、p-PI3K蛋白表达水平下降。见图2和表5。PI3K/AKT信号抑制剂降低红芪多糖处理的HepG2细胞胰岛素抵抗模型中PI3K/AKT信号通路激活水平。
2.6 抑制PI3K/AKT信号通路对红芪多糖影响HepG2细胞模型葡萄糖消耗量、糖原合成量和PPARγ、PEPCK mRNA表达的影响 与HPS+Model组比较,HPS+LY294002+Model组细胞葡萄糖消耗量、糖原合成量均减少,PPARγmRNA水平降低,PEPCKmRNA水平升高。见表6。PI3K/AKT信号抑制剂减少红芪多糖处理的HepG2细胞胰岛素抵抗模型葡萄糖消耗量和糖原合成量,减少细胞中PPARγ mRNA表达,促进细胞中PEPCKmRNA表达。
表2 红芪多糖处理后的Hep G2细胞胰岛素抵抗模型细胞葡萄糖消耗量和糖原合成量比较(±s)Tab.2 Comparison of glucose consumption and glycogen synthesis in Hep G2 cells insulin-resistant model cellstreated with hedysaryum polysaccharide(±s)

表2 红芪多糖处理后的Hep G2细胞胰岛素抵抗模型细胞葡萄糖消耗量和糖原合成量比较(±s)Tab.2 Comparison of glucose consumption and glycogen synthesis in Hep G2 cells insulin-resistant model cellstreated with hedysaryum polysaccharide(±s)
Note:Compared with Control,1)P<0.05;compared with Model,2)P<0.05.
GroupsGlucoseGlycogen consumption(mmo/lL)synthesis(mg/g)Control2.14±0.1314.14±1.20 Model1.23±0.111)9.20±0.841)HPS+Model1.84±0.132)11.33±1.022)PIO+Model1.79±0.102)12.54±1.352)F 92.7831.16 P<0.001<0.001
表3 红芪多糖处理后的Hep G2细胞胰岛素抵抗模型细胞中PPARγ、PEPCK mRNA水平比较(±s)Tab.3 Comparison of PPARγand PEPCK mRNA levels in Hep G2 cells insulin resistance model cells treat⁃ed with hedysaryum polysaccharide(±s)

表3 红芪多糖处理后的Hep G2细胞胰岛素抵抗模型细胞中PPARγ、PEPCK mRNA水平比较(±s)Tab.3 Comparison of PPARγand PEPCK mRNA levels in Hep G2 cells insulin resistance model cells treat⁃ed with hedysaryum polysaccharide(±s)
Note:Compared with Control,1)P<0.05;compared with Model,2)P<0.05.
GroupsPPARγmRNAPEPCK mRNA Control1.00±0.101.00±0.09 Model0.52±0.051)1.89±0.131)HPS+Model0.76±0.072)1.20±0.132)PIO+Model0.80±0.062)1.17±0.102)F 66.51107.30 P<0.001<0.001

图1 Western blot检测红芪多糖处理后的Hep G2细胞胰岛素抵抗模型细胞中p-AKT、p-PI3K蛋白表达Fig.1 Western blot detection of p-AKT and p-PI3K pro⁃tein expression in Hep G2 cellsinsulin-resistant mod⁃el cellstreated with hedysaryum polysaccharide
表4 红芪多糖处理后的Hep G2细胞胰岛素抵抗模型细胞中p-AKT、p-PI3K蛋白水平比较(±s)Tab.4 Comparison of p-AKT and p-PI3K protein levels in insulin-resistant model cells of Hep G2 cells treated with hedysaryum polysaccharide(±s)

表4 红芪多糖处理后的Hep G2细胞胰岛素抵抗模型细胞中p-AKT、p-PI3K蛋白水平比较(±s)Tab.4 Comparison of p-AKT and p-PI3K protein levels in insulin-resistant model cells of Hep G2 cells treated with hedysaryum polysaccharide(±s)
Note:Compared with Control,1)P<0.05;compared with Model,2)P<0.05.
Groupsp-AKTAKTPI3Kp-PI3K Control0.40±0.040.92±0.090.99±0.110.56±0.05 Model0.20±0.021)0.91±0.101)1.02±0.121)0.23±0.031)HPS+Model0.29±0.032)0.93±0.082)1.00±0.092)0.53±0.042)PIO+Model0.31±0.042)0.92±0.112)1.03±0.102)0.52±0.062)F53.870.070.2799.63 P<0.0010.840.88<0.001
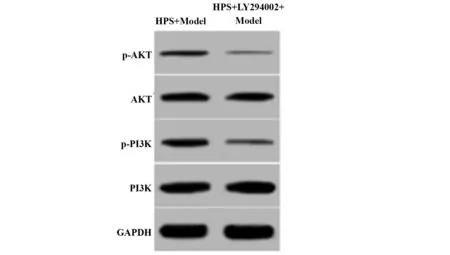
图2 Western blot检测红芪多糖和PI3K/AKT信号通路抑制剂LY294002处理后的Hep G2细胞胰岛素抵抗模型细胞中p-AKT、p-PI3K蛋白表达Fig.2 Western blot detect expressions of p-AKT and p-PI3K protein in Hep G2 cells insulin resistance mod⁃el cells treated with hedysaryum polysaccharide and PI3K/AKT signaling pathway inhibitor LY294002
表5 红芪多糖和PI3K/AKT信号通路抑制剂LY294002处理后的Hep G2细胞胰岛素抵抗模型细胞中p-AKT、p-PI3K蛋白表达水平比较(±s)Tab.5 Comparison of expression levels of p-AKT and p-PI3K proteins in Hep G2 cells insulin-resistant model cells treated with hedysaryum polysaccharide and PI3K/AKT signaling pathway inhibitor LY294002(±s)
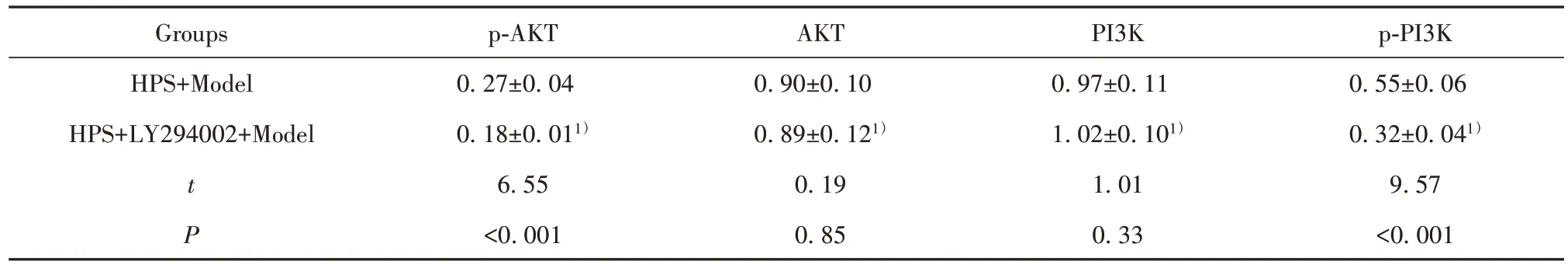
表5 红芪多糖和PI3K/AKT信号通路抑制剂LY294002处理后的Hep G2细胞胰岛素抵抗模型细胞中p-AKT、p-PI3K蛋白表达水平比较(±s)Tab.5 Comparison of expression levels of p-AKT and p-PI3K proteins in Hep G2 cells insulin-resistant model cells treated with hedysaryum polysaccharide and PI3K/AKT signaling pathway inhibitor LY294002(±s)
Note:Compared with HPS+Model,1)P<0.05.
Groupsp-AKTAKTPI3Kp-PI3K HPS+Model0.27±0.040.90±0.100.97±0.110.55±0.06 HPS+LY294002+Model0.18±0.011)0.89±0.121)1.02±0.101)0.32±0.041)t 6.550.191.019.57 P<0.0010.850.33<0.001
表6 红芪多糖和PI3K/AKT信号通路抑制剂LY294002处理后的Hep G2细胞胰岛素抵抗模型细胞葡萄糖消耗量、糖原合成量和细胞中PPARγ、PEPCK mRNA水平比较(±s)Tab.6 Comparison of glucose consumption,glycogen synthesis,and PPARγand PEPCK mRNA levels in insulin-resistant model cells of Hep G2 cells treated with hedysaryum polysaccharide and PI3K/AKT signaling pathway inhibitor LY294002(±s)

表6 红芪多糖和PI3K/AKT信号通路抑制剂LY294002处理后的Hep G2细胞胰岛素抵抗模型细胞葡萄糖消耗量、糖原合成量和细胞中PPARγ、PEPCK mRNA水平比较(±s)Tab.6 Comparison of glucose consumption,glycogen synthesis,and PPARγand PEPCK mRNA levels in insulin-resistant model cells of Hep G2 cells treated with hedysaryum polysaccharide and PI3K/AKT signaling pathway inhibitor LY294002(±s)
Note:Compared with HPS+Model,1)P<0.05.
GroupsGlucoseconsumptionGlycogenPPARγmRNAPEPCK mRNA(mmo/lL)synthesis(mg/g)HPS+Model1.85±0.1412.03±1.181.00±0.101.00±0.12 HPS+LY294002+Model1.35±0.111)8.67±0.961)0.63±0.071)1.56±0.131)t 8.436.639.099.50 P<0.001<0.001<0.001<0.001
3 讨论
2型糖尿病是一种非胰岛素依赖型的糖尿病,其以胰岛素抵抗为主要特征。肝脏作为糖代谢的主要场所,其在胰岛素抵抗中扮演关键角色[10]。HepG2细胞是常用的体外研究肝细胞胰岛素抵抗模型的细胞之一,其在高浓度的胰岛素作用下糖原合成水平下降,葡萄糖消耗水平降低[9]。红芪是我国传统中药,其是豆科植物多序岩黄芪的干燥根,含有多种活性成分,红芪具有利水、消肿、补气、止汗等功效[4]。红芪多糖是提取自红芪中的杂多糖,具有调节免疫、抗氧化、抗炎等功效,红芪多糖还有治疗糖尿病并发症、恶性肿瘤、心肌损伤等疾病的作用[11]。研究显示红芪多糖可以明显改善糖尿病大鼠胰岛素敏感性和血糖水平[5]。本次实验显示,高浓度的胰岛素处理后的HepG2细胞糖原合成量减少,葡萄糖消耗量减少,红芪多糖处理后的HepG2细胞胰岛素抵抗模型糖原合成量和葡萄糖消耗量均升高,提示红芪多糖能够改善HepG2细胞胰岛素抵抗模型糖代谢和胰岛素敏感性,这与上述研究结果相符合,提示红芪多糖有改善糖尿病的作用。
研究显示,PPAR具有抑制炎症、调节脂代谢等多种生物学作用,其属于核内受体转录因子成员,PPAR含有多个亚型,PPARγ在胰岛素抵抗中作用最为广泛[12]。PPARγ能够提高外周组织胰岛素敏感性,降低胰岛素抵抗因子的活性和胰岛素受体底物的磷酸化水平[13]。PEPCK是在肝脏中表达的蛋白酶,其是糖异生过程中的关键限速酶之一[14]。PEPCK是PPARγ的下游因子,PPARγ可以降低PEPCK表达水平[15]。本次实验表明,HepG2细胞胰岛素抵抗模型PPARγmRNA水平降低,PEPCK mRNA水平升高,红芪多糖可以提高HepG2细胞胰岛素抵抗模型PPARγmRNA表达水平,降低PEPCK mRNA表达水平,这与检测的细胞糖原合成量和葡萄糖消耗量结果相符,均说明红芪多糖能够改善HepG2细胞胰岛素抵抗模型糖代谢和胰岛素敏感性。
PI3K/AKT信号通路具有多种功能,其在人体内多种细胞生长、疾病发生、免疫调节等过程中作用广泛[16]。PI3K是一个存在于细胞内的磷脂酰肌醇酶,也是细胞内重要的第二信使[17]。AKT位于PI3K的下游,其可以被活化的PI3K磷酸化,进而调控诸多生理和病理过程[18]。目前在多种疾病如心肌缺血、肿瘤、神经损伤中均发现PI3K/AKT信号异常,干预PI3K/AKT信号可以调控疾病进程[19-21]。在糖尿病研究中发现,PI3K/AKT信号活化水平降低与胰岛素抵抗有关,高浓度的胰岛素可以降低HepG2细胞的胰岛素敏感性[22-23]。本次实验显示,HepG2细胞胰岛素抵抗模型中p-PI3K、p-AKT水平下降,而红芪多糖可提高细胞中p-PI3K、p-AKT水平,PI3K/AKT信号抑制剂可以逆转红芪多糖对HepG2细胞胰岛素抵抗模型的改善作用,这说明红芪多糖可以通过激活PI3K/AKT信号参与HepG2细胞胰岛素抵抗过程。
综上所述,红芪多糖具有改善HepG2细胞胰岛素抵抗模型糖代谢和胰岛素敏感性的作用,其机制与激活PI3K/AKT信号有关,这为研究红芪多糖治疗糖尿病的作用机制提供参考,为临床上红芪多糖治疗糖尿病提供了资料。本研究没有探讨红芪多糖通过影响PI3K/AKT信号发挥作用的下游靶向调控机制,在后续实验中将会继续此部分研究。
