再生障碍性贫血CD4+CD25+Foxp3+调节性T细胞(Treg)诊断价值的临床研究
2021-05-28刘娜姜丽波张淑英周虹曲延章姚宇宁许玲玲周畅
刘娜,姜丽波,张淑英,周虹,曲延章,姚宇宁,许玲玲,周畅
齐齐哈尔医学院附属第二医院血液科,黑龙江齐齐哈尔161000
再生障碍性贫血(aplastic anemia,AA)是一种骨髓造血衰竭综合征,以骨髓造血细胞增生减低和外周血全血细胞减少为特征,在临床上表现为不同程度的三系血细胞减少所致的贫血、出血和感染等[1-2]。有关AA的“免疫介导”发病机制,国内外均认为细胞免疫异常在其发病中起重要作用[3],因此AA实质上是以骨髓组织为靶器官的T细胞免疫异常介导的疾病[4-5]。早期研究发现CD4+CD25+调节性T细胞 (regulatory T cell,Tregs)持续表达在机体免疫抑制反应和免疫耐受状态方面起重要作用[6-7]。Foxp3是转录因子叉头样/翼状螺旋家族成员,是Treg最具有特征性的分子标志,对Treg细胞发育成熟和功能完善发挥重要作用,同时在维持免疫耐受中起重要作用[8-9]。因此,目前关于Treg细胞在AA诊断方面的研究报道很多[10-13],但是,针对Treg细胞在不同亚群AA之间的分布及差异的报道还不是很多。因此,该研究主要探讨2017年1月—2019年1月期间初诊的急性再生障碍性贫血(SAA)和慢性再生障碍性贫血(CAA)共40例患者外周血中CD4+、CD25+和Foxp3+Treg细胞亚群变化情况及相关基因表达情况,评价其在AA诊断中的应用价值。现报道如下。
1 资料与方法
1.1 一般资料
方便选取该院血液科收治的初发AA患者40例,平均年龄(55.42±22.7)岁;男性17例,女性23例。根据《中国再生障碍性贫血的诊断和治疗专家共识》(2017)诊断及分类标准将患者分为CAA患者18例,男8例,女10例。SAA患者22例,男9例,女13例。同时选择健康体检20名正常人作为对照组(CN),平均年龄为(58.36±17.2)岁;男8名,女12名。3组一般资料对比,差异无统计学意义(P>0.05),具有可比性。所有患者知情同意该次研究。
1.2 方法
所有受试者均清晨空腹收集血样。所有样本被放置在正常空白采血管内4℃条件下储存2~3 h,然后3 000 r/min离心20 min。收集血清样本,并在-80℃冷冻后进行进一步检测。该研究所有受试者均签署知情同意书并由齐齐哈尔医学院伦理委员会批准。
1.3 主要试剂及仪器
荧光标记的抗体:Anti-Human Foxp3 Staining Kit-Alexa Fluor 647,Foxp3(259D/C7),CD4(RPA-T4),CD25(M-A251),Human Foxp3 Buffer set(BD bioscience公司,USA);BD FACSCanto II型流式细胞仪(BD公司,USA);Hitachi 7600自动临床生化分析仪(Hitachi公司,日本)。PE标记的抗人CD4、PE-Cy5标记的抗人CD25及FITC标记的抗人Foxp3试剂盒(含配套的固定和透膜试剂)均购自EB ioscience公司;淋巴细胞分离液(上海哈灵生物科技有限公司,中国);RNA抽提试剂Trizol(Invitrogen);逆转录及荧光定量PCR试剂盒(Takara)。Nano Drop 2000分光光度计(Nano Drop Technologies,USA)。Stratagene MX4000TM荧光定量PCR仪(Agilent Technologies,USA)。
1.4 方法
将-80℃冻存的外周血清置于4℃下冻缓后取2 mL加入EDTA抗凝管,充分混匀;准备两根流式管,标明同型对照管和检测管,分别用1、2表示;取外周血清100μL分别加入两管,两管内均加入C D4-FITC/CD25-BC96各20μL,暗室室温避光孵育30 min后加入稀释的溶血素和破膜剂,反应后以破膜缓冲液洗涤并重悬,1号管加入I gG-PE 5μL,2号管加入Foxp3-PE 20μL,再次暗室室温避光孵育30 min;加入5 mL PBS缓冲液冲洗,1 200 r/min离心5 min去上清。加入400μL PBS缓冲液上机检测。
1.5 FCM检测
采用BD公司的FACSCantoII型流式细胞仪进行检测,结果分析用Cellquest软件。在FSC-SSC点图上选定淋巴细胞群,然后分析该群细胞中CD3+T细胞内CD4+细胞的表达情况。以CD4+和SSC设门,选择CD4+细胞分析其中CD25+和Foxp3表达,并按CD25+表达程度的不同设门进行分析其中Foxp3细胞所占比例。
1.6 荧光定量PCR检测
采用Trizol法常规提取细胞总RNA共10 uL,将提取得到的总RNA使用NanoDrop2000分光光度计(Nano Drop Technologies USA)检测浓度,分别取各样品RNA 500 ng进行反转录生成cDNA(Prime Script RT Reagent Kit with gDNA Eraser,Takara)。采 用Ace Q qPCR SYBR Green Master Mix(Vazyme)试剂盒在Stratagene MX4000TM(Agilent Technologies)荧光定量PCR系统上进行荧光定量PCR检测。荧光定量PCR的反应条件为:95°C预变性5 min,40个循环的95°C 10 s和60°C 30 s,最后是95°C 15 s、60°C 1 min和95°C 15 s来获得溶解曲线。所检测的各基因及β–ACTIN内参的引 物 为CD4-F:ATTG GGCTAGGCATCTTCTT;CD4-R:GGACACTGGCAGGTCTTCTT,CD25-F:AAGGTGCAAAT CAATGCGTAC;CD25-R:CCTCCAT CCCTTCTCCCTCT,Foxp3-F:TTTCTGTCAGTCCACTTCACCA;Foxp3-R:CCAGCAGGTCTGAGGCT TTG,β-ACTIN-F:TGGCACC CAGCACAATGAA;β-ACTIN-R:TAAGTCATAGTCCGCCTAGA AGCA。荧光定量PCR获得的各基因CT值用于计算相对表达量,计算公式为:相对表达量=2-ΔΔCt。分别测出CD4+、CD25+和Foxp3的相对表达量。
1.7 统计方法
采用SPSS 18.0统计学软件处理数据,计量资料以(±s)表示,组间比较采用t检验;多样本均数比较采用单因素方差分析,组间比较采用LSD法。P<0.05为差异有统计学意义。
2 结果
2.1 外周血中CD4+,CD4+CD25+和Foxp3+Treg细胞表达水平
SAA及CAA患者外周血中CD4+,CD4+CD25+和Foxp3 Treg细胞流式细胞检测,可以看出对于CN组,SAA及CAA患者患者Treg细胞比率显著减少,见图1;另通过Cellquest软件计算不同细胞系的细胞占比,相对于CN组,CAA组及SAA组外周血中的上述指标均显著下降,差异有统计学意义(P<0.05),这说明AA患者的外周血中CD4+细胞以及Foxp3 Treg细胞的表达均显著下降;另外,CAA及SAA组之间进行比较时也能看出类似的趋势,CAA组的Foxp3 Treg细胞检测值为(2.64±0.48)%,明显高于SAA组的(1.51±0.34)%,差异有统计学意义(P<0.05);同时对比CAA组的CD4+以及CD4+CD25+T细胞的表达比率均明显下降,差异有统计学意义(P<0.05)。见表1。
表1 3组研究对象外周血调节性T细胞及Foxp3的表达水平[(±s),%]

表1 3组研究对象外周血调节性T细胞及Foxp3的表达水平[(±s),%]
注:与对照组之间比较,*P<0.05,**P<0.01;与CAA组之间比较,ΔP<0.05
组别CD3+CD4+/CD3+CD3+CD4+CD25+/CD3+CD4+CD3+CD4+CD25+Foxp3+/CD3+CD4+CAA组SAA组CN组(33.36±13.87)*(31.61±13.27)**Δ(16.14±4.06)*(13.72±6.63)**Δ(2.64±0.48)**(1.51±0.34)**Δ 52.05±9.42 23.97±5.93 5.05±1.38
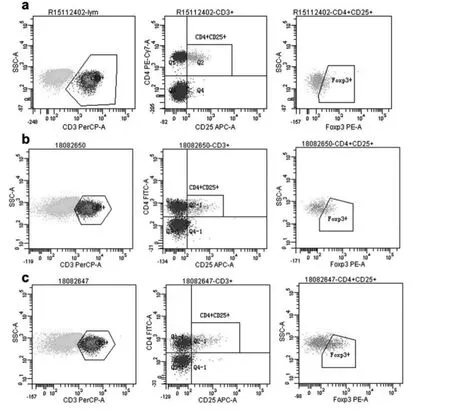
图1 外周血中表达CD4+,CD25+和Foxp3 T淋巴细胞检测结果
2.2 外周血中CD4+,CD4+CD25+和Foxp3 Treg细胞mRNA表达情况
SAA及CAA患者外周血中CD4+,CD4+CD25+和Foxp3 Treg细胞的mRNA表达情况,见图2。可以看出与CN组比较,SAA及CAA患者的Treg细胞mRNA表达显著减少;但与流式细胞检测结果不同的是,在CD4+CD25+Treg细胞水平CAA组(0.77±0.28)和SAA组(0.63±0.09)之间统计学比较,差异有统计学意义(P<0.05)。同时,SAA组与CAA组及CN组比较Foxp3 mRAN表达明显下降,差异有统计学意义(P<0.05)。见表2。
表2 3组研究对象外周血调节性T细胞及Foxp3 mRNA表达情况(±s)
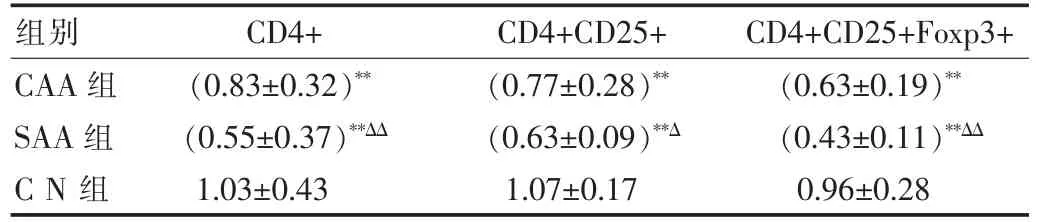
表2 3组研究对象外周血调节性T细胞及Foxp3 mRNA表达情况(±s)
注:与对照组之间比较*P<0.05,**P<0.01;与CAA组之间比较:ΔP<0.05,ΔΔP<0.01
组别CD4+CD4+CD25+ CD4+CD25+Foxp3+CAA组SAA组CN组(0.83±0.32)**(0.55±0.37)**ΔΔ(0.77±0.28)**(0.63±0.09)**Δ(0.63±0.19)**(0.43±0.11)**ΔΔ 1.03±0.43 1.07±0.17 0.96±0.28

图2 3组外周血中CD4+、CD4+CD25+和CD4+CD25+Foxp3+mRNA定量PCR检测表达情况
3 讨论
正常人外周血中的全血T淋巴细胞主要包括T辅助/诱导T淋巴细胞亚群(CD4+)和T抑制/细胞毒淋巴细胞亚群(CD8+),其中CD3+CD4+T淋巴细胞在辅助B淋巴细胞免疫应答、调节机体自身免疫等方面发挥着重要作用[14-15]。目前已经有足够的证据证实AA发病过程中存在Th淋巴细胞亚群异常[16],这其中以CD4+T细胞进入骨髓后能够分泌大量细胞因子并对骨髓干细胞起到破坏作用,是导致骨髓衰竭的主要环节[17]。在该研究中,发现SAA组及CAA组外周血中CD3+CD4+/CD3+比值较健康人显著降低(P<0.05),说明AA患者外周血中CD3+CD4+T淋巴细胞减少。早期研究[18]发现AA患者CD3+CD4+T淋巴细胞减少的同时,CD3+CD8+T淋巴细胞数量增多,导致Th细胞的不同亚群之间的平衡被打破,导致细胞功能亢进,进而也可以抑制造血干细胞的功能,这也是导致骨髓衰竭的原因,因此,这些外周血中T细胞亚群的变化最终会引起患者造血功能障碍的临床表现。再生障碍性贫血患者不仅具有异常的T细胞数量,而且在T细胞的分布,表型和功能方面也有显着变化。CD4+CD25+Treg细胞是在未活化的CD4+T细胞中新发现的T细胞亚群,具有免疫抑制性和免疫无能性。石秀珍等人[19]通过对46例AA患者与正常对照组比较,AA组外周血CD4+CD25+Treg细胞明显降低(t=2.738,P<0.01),且SAA组低于CAA组(t=1.986,P<0.01)。同时进行CD4+CD25+Treg和T细胞亚群免疫状态检测,阳性率分别为71.7%和60.9%,得出前者免疫状态异常的敏感性高于后者(χ2=4.290,P<0.05)。仅依靠T细胞亚群来反应AA患者的免疫紊乱尚不全面和准确。在监测AA患者免疫功能异常、评估病情及免疫抑制剂疗效时,CD4+CD25+Treg细胞优于经典T细胞亚群。该研究的实验显示AA患者CD4+CD25+T细胞的表达比率均明显低于CN组(P<0.05),且SAA组(13.72±6.63)%低于CAA组(16.14±4.06)%(P<0.05),同石秀珍等[19]研究结果。AA患者CD4+CD25+Treg细胞数量减 少 和 或 其 迁移功能、免疫抑制功能等受损,免疫抑制和免疫监视作用减弱,导致自身效应性T细胞过度活化增殖或不能抑制效应性T细胞功能[20]。Foxp3是Treg最具有特征性的分子标志,在AA的发病机制中起到重要作用。该研究中Foxp3 mRAN检测与流式细胞中Foxp3表达比率检测的结果相一致,均为SAA组与CAA组和CN组比较表达下降,且SAA组低于CAA组。与流式细胞检测中不一致的是下降差异更明显(P<0.01)。表明Foxp3 Treg细胞在AA患者中作为检测指标更敏感,且疾病严重程度导致了更低的Foxp3Treg细胞检测数值。该研究的结果说明AA患者T细胞亚群及调节性T细胞受损,SAA患者比CAA患者受损程度严重。这与徐金格等[21]研究显示AA患者CD4+CD25+Foxp3+Treg细胞百分比及Foxp3在CD4+CD25+T细胞表达百分比明显比正常人降低的结果相同。因此,CD4+CD25+Foxp3+Treg细胞比率能够作为一项指标来评估AA的严重程度。
Treg细胞主要通过细胞间接触途径杀伤细胞毒性细胞,抑制细胞毒性细胞产生白细胞介素-2(IL-2)等细胞因子,以及分泌抑制性细胞因子IL-10、转化生长因子-β(TGF-β)这3种途径发挥免疫耐受和免疫抑制作用[22],当Treg细胞疫抑制功能降低时,对自身免疫性T细胞活化增殖的抑制能力降低,异常激活效应性T淋巴细胞,发生自身免疫应答,影响造血细胞的生成,导致骨髓造血功能衰竭[23]。另外,Zou L等[24]发现骨髓是Treg细胞重要的储存池,Treg通过基质细胞衍生因子-1α/趋化因子受体CXCR4通路即SDF-1α/CXCR4信号通路迁徙至骨髓,从而发挥Treg细胞调控效应T细胞的机制。因此当AA患者的骨髓功能减退时,会间接导致Treg细胞功能障碍,进一步诱导并加重T细胞介导的自身免疫反应,加重AA患者的骨髓衰竭症状。在该研究中,发现SAA患者与CAA患者比较外周血中Treg细胞比值显著减少,且SAA患者的Treg细胞减少的程度要重于CAA,这说明在AA患者体内Treg细胞受损情况明显,且可反应疾病的严重程度;另外,实时定量PCR结果显示相应的Foxp3 mRNA基因表达与流式细胞结果得到类似趋势,也能够证实这一结果。
综上所述。尽管该研究还存在入选病例不足,但是该研究结显示AA患者外周血中CD4+CD25+和CD4+CD25+Foxp3+显著下降的结果说明了AA患者在发病过程中存在明确的Th淋巴细胞亚群异常,Treg调节T细胞系统受损。而SAA组的Treg细胞低于CAA组说明Treg细胞下降能够作为指标来帮助评估临床疾病的严重程度。
