浓缩血小板的制备和保存过程中血小板表面组织因子的表达
2021-05-28何博谭爱玲胡文娟陈小光黄小敏陈汉妹黄小琴
何博 谭爱玲 胡文娟 陈小光 黄小敏 陈汉妹 黄小琴
1广州血液中心(广州510095);2广州市医学重点实验室(血液安全重点实验室)(广州510095)
血小板数量减少或者功能异常患者需要输注大量血小板以预防或阻止出血[1]。这些以高浓缩血小板悬浮液的形式提供的血小板即血小板浓缩物(platelet concentrate,PC)[2]。PC输注成功的关键是血小板具有良好的止血潜力。而血小板减少症病患需要输注大量血小板以预防或阻止出血[3]。特别是输注PC治疗病患时,必须高效、及时的止血[4]。
由于多种原因,评估PC疗效并不容易。输注适应症存在异质性,病患从意外创伤到大手术再到血液肿瘤和遗传性或获得性血小板疾病等包括多种类型。对于每种适应症,均难以实现患者群体一致性,并且所有患者并非都出现(严重)出血。此外,缺乏标化的指标客观测量血小板在输血功效中的作用。既往PC活力等检测只反映浓缩方法的效率而并非血小板质量。组织因子(tissue factor,TF)是凝血级联反应的启动子,与血Ⅶ/Ⅶa结合形成复合物后,启动外源性凝血途径,并与血小板互作,形成纤维蛋白[5]。二者共同参与止凝血反应过程,并扮演重要角色。前期研究表明血小板表面存在TF[5]。此外,在实验条件控制良好的情况下,血小板颗粒和小管系统中含有活化的TF。然而,这种TF是血小板来源的,还是通过微粒介导的转移机制从白细胞中获得的,仍存在争议。并且目前未见评估献血员全血和输血用PC表面TF表达的研究[6]。流式细胞术是研究血小板表面组织因子表达模式的有力工具,能够反映血小板活化引起的变化。因此,本研究旨在探讨PC的制备和保存过程中血小板表面TF的表达变化以及变化程度,并预测该蛋白是否可以作为血小板止血潜力的指标。为了校准分析,使用多个血小板激活标记物,如P⁃选择素(CD62P)[7]、纤维蛋白原[8]和GPIIb(CD41)[9]。本研究还在病患基线资料基础上分析了献血员ABO血型对TF和其他止血标志物表达的影响。
1 材料与方法
1.1 血液采集和样品制备收集自我中心的189名献血员,男156例,女24例,包括O组(O型血)68例,A组(A型血)64例,B组(B型血)48例,AB组(AB型血)9例,全血共(452±53)mL置于CPD采血五联袋。献血员平均年龄(42.8±22.1)岁,血小板计数为(229.7±45.5)×109/L。在献血日(第0天),从每个血袋中取500 μL用于流式细胞术分析血小板表面抗原表达。
1.2 PC制备从采血(第1天)起24 h内,在我中心制备PC。采集后6 h内分别对以上三组五联袋采集的全血第一次离心(2 100 g×12 min);温度(22±2)℃,分出白膜层血小板,静置30 min后,再次离心(400 g×8 min),将血小板转移至血小板袋内,即为浓缩血小板[10]。在(22±2)℃环境下静置1~2 h,待其自然解聚后,轻轻摇动血袋,使其成均匀混悬液。全自动血细胞分析仪进行血小板计数。在同一天(第1天)和存储3 d(第4天)或4天(第5天)后进行流式细胞术。
1.3 流式细胞仪分析BD公司FACSCalibur流式细胞仪检测,CellQuest软件分析数据。通过常规方法,单抗免疫荧光标记测定平均荧光强度或特异性荧光抗体结合阳性血小板的百分率来检测血小板的活化情况。将5 μL献血员全血或PC样品添加到100 μL PBS中,分别加入饱和浓度的TF⁃FITC,CD62P⁃FITC,纤维蛋白原⁃FITC,CD41⁃FITC(均采购自Invitrogen流式细胞仪抗体,美国)。使用同型对照IgG⁃FITC抗体作为阴性对照。所有标记均在流式细胞仪试管中进行(Attune NxT,Invitrogen)。在室温20 min后,将样品稀释于600 μL PBS中,并立即通过流式细胞仪进行分析。对于每个标记,记录阳性血小板占血小板总数的百分比;数据同时分析为以任意单位表示的平均荧光强度(aver⁃age fluorescence intensity,MFI),荧光信号强度与抗原密度直接相关。并计算第4天或第5天与第1天的值之间的阳性血小板或MFI的百分比差异。
1.4 统计学方法使用SPSS 22.0统计软件包进行数据分析,根据检测变量的分布,采用t检验比较计量资料两组之间的差异。在P<0.05时,差异有统计学意义。
2 结果
2.1 PC制备对血小板TF的影响见图1,与献血员全血(非黑色柱)相比,PC(黑色柱)中的TF和其他标志物的表达明显高于全血(P<0.05)。其中TF增加48%[血小板阳性率(14.8±5.4)%],纤维蛋白原增加38.2%[血小板阳性率(23.9±10.2)%],CD62P增加150%[血小板阳性率(26.5±13)%]和CD41增加10.3%[MFI(9 920±2 761)单位],说明PC制备可促进TF活化。
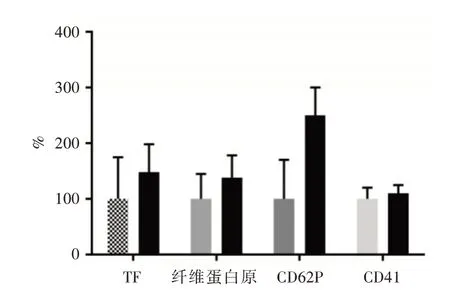
图1 PC(黑色柱)制备对血小板表面上的TF、纤维蛋白原、CD62P和CD41的表达影响Fig.1 Expression of TF,fibrinogen,CD62P,and CD41 on platelet surface in freshly prepared PC(black bars)
2.2 PC储存对血小板TF的影响在PC储存期间,从第1天到第5天,TF以及其他血小板标记物的水平持续增加(图2)。特别是在第5天,TF的阳性血小板百分比(平均升高)增加了32%(相对于第1天,P<0.05),纤连蛋白原的上升了31%(P<0.05),CD62P水平上升了148%,CD41随时间MFI逐渐上升,说明PC储存可促进TF活化。
2.3 各组献血员全血血小板中TF分析见图3。流式细胞仪分析的全部献血员及其ABO血型的全血血小板中TF的表达。TF阳性血小板的平均百分数为(10±6.7)%。与A组(9±5.2)%,B组(8.4±5.3)%和AB组(7.9±4.9)%献血员相比,O组的血液样本显示TF阳性的血小板百分比(11.7±4.8)%高于前两组(均P<0.05)。说明TF存在于各组献血员血小板表面,且O型血TF表达显著高于非O型血。
2.4 ABO血型组浓缩后与各指标关系根据ABO血型分析显示(表1),除TF抗原密度在A组血小板中最低,与其他血型组比较差异有统计学意义(P<0.05)外,其他评估指标差异均无统计学意义。说明除TF外,ABO血型对活化各指标无影响。
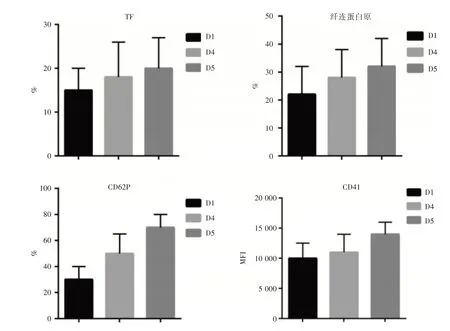
图2 PC储存对血小板止血指标的影响Fig.2 Effect of PC storage on platelet hemostatic markers
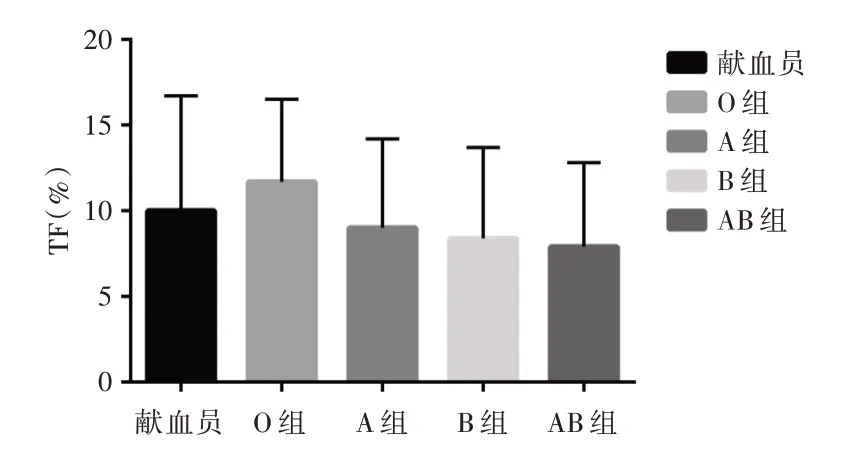
图3 健康献血员全血中血小板表面的TF表达Fig.3 TF expression on platelet surface in donor whole blood
3 讨论
血小板以高浓缩血小板悬浮液的形式提供,即所谓的PC,通过单采血液从单个献血员或合并多个随机献血员富含血小板的血浆中获得[11]。由于存在细菌污染风险和所谓的“血小板储存损伤”现象[12],一般建议尽快使用PC;在我国,通常是在准备PC后的5 d内使用[13]。关于凝血受体,一些研究表明血小板表面存在TF[14-15]。TF是一种膜糖蛋白,是血浆凝血因子Ⅶ的高亲和力受体。TF/FVIIa复合物触发外在途径,最终导致凝血酶生成和纤维蛋白形成[16]。此外,在良好控制的实验条件下,血小板在α颗粒和小管系统中含有功能性活性TF[17-19]。按以上结果表明,献血员全血血小板存在TF,在PC制备和保存过程中其表达得以保留。
表1 ABO血型各指标关系Tab.1 Relationship among indexes of ABO blood group system±s
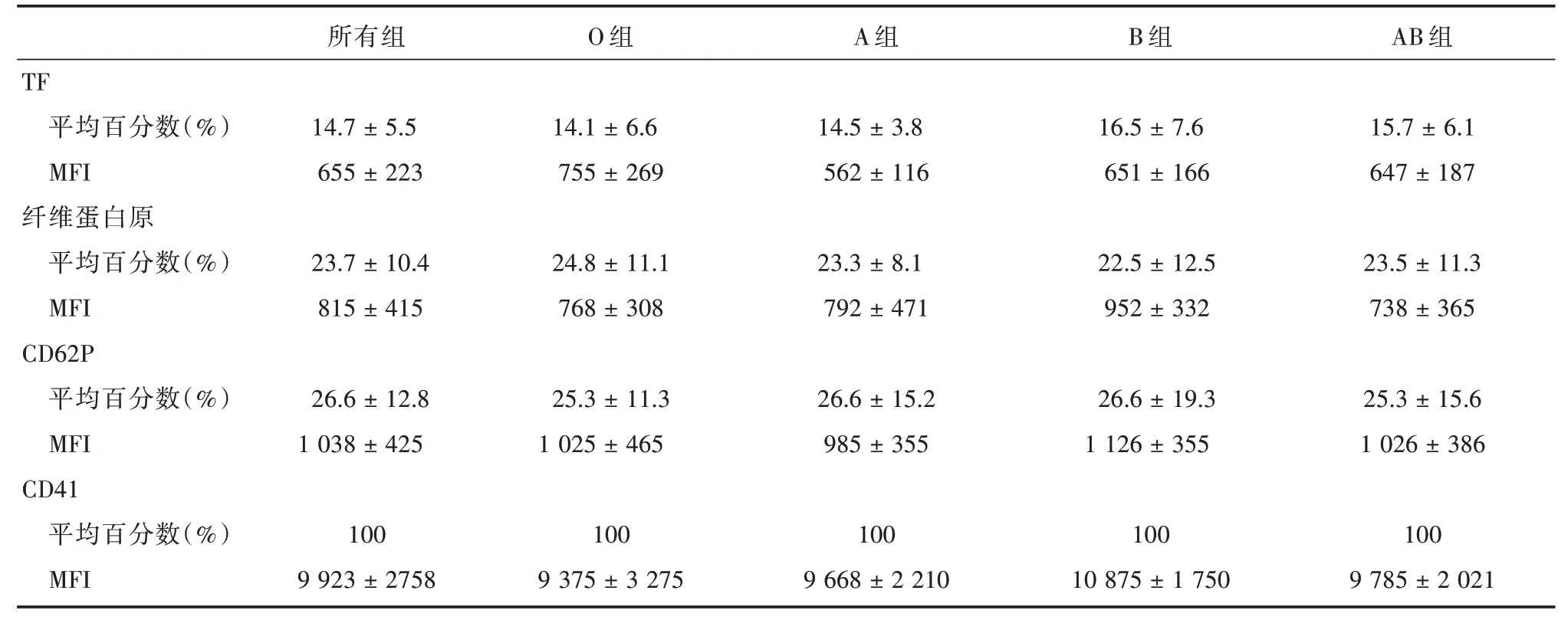
表1 ABO血型各指标关系Tab.1 Relationship among indexes of ABO blood group system±s
所有组O组A组B组AB组4.7±5.514.1±6.614.5±3.816.5±7.615.7±6.1 655±223755±269562±116651±166647±187 TF平均百分数(%)MFI纤维蛋白原平均百分数(%)MFI CD62P平均百分数(%)MFI CD41平均百分数(%)MFI 1 23.7±10.4 815±415 26.6±12.8 1 038±425 100 9 923±2758 24.8±11.1 768±308 25.3±11.3 1 025±465 100 9 375±3 275 23.3±8.1 792±471 26.6±15.2 985±355 100 9 668±2 210 22.5±12.5 952±332 26.6±19.3 1 126±355 100 10 875±1 750 23.5±11.3 738±365 25.3±15.6 1 026±386 100 9 785±2 021
PC输血成功的关键是血小板具有良好的止血潜力[20]。特别当给予PC来停止正在进行的出血事件时,血小板止血作用必须是有效且快速的。现在有大量研究支持以下证据[21-23]:血小板不仅通过形成血小板栓塞参与原发止血过程,而且还可以通过提供特定的高亲和力受体,蛋白酶,酶原和辅因子来积极促进凝血级联的传播,从而有助于将凝血酶的产生定位在血管损伤的部位[24]。不管血小板TF的来源如何,它的存在显著促进凝血作用。以上均强调PC保持TF表达的重要性,并本研究表明,PC制备和储存后,血小板表面的TF没有被去除,TF增加分别为48%、32%。在PC存储期间TF阳性血小板的百分比增多。P⁃选择素是测量血小板活化的经典标志物。本研究数据显示,在PC制备和储存过程中,标志物的表达均显著增加,这与以前的报道是一致的。P⁃选择素这被认为是最敏感的血小板活化标记,无论是从全血处理到PC和存储期间均呈现显著增加。在PC储存结束时,与全血相比,P⁃选择素阳性血小板的百分比增加了约150%。表明TF可能是另外一个有潜在标志物,并且,TF对于血小板活化的临床疗效,可能更具有直接意义。目前的工作还评估了ABO血型对血小板止血参数的影响,这一领域还在初步探索阶段。早期已证明ABO血型对血管性血友病因子(von willebrand factor,vWF)和凝血因子VIII有显著影响[25],这两种标记物的循环水平O组受试者比非O组受试者更低。笔者观察到,来自O组的血小板对TF的阳性率最高。但在PC制备后,在ABO血型之间的血小板止血标志物的差异消失了。结果显示血型并不会影响PC制备后止血标记物的表达。
本研究的局限性归纳为以下几点:首先,本研究仅纳入180名献血员。其次,仅利用流式细胞仪评估制备及储存对于血小板的影响。最后,依然是单中心研究。因此,进一步研究需要经多种类型的血液自动分析仪进行大规模的多中心分析,以验证本研究结果的可靠性。
总之,以上结果均表明,在PC制备过程中直至储藏期结束,血小板表面均有TF表达。当然,凝血分子机制极为复杂,研究仅局限在TF表达方面,并且临床医生及研究小组的科学能力会影响结果评估。血小板与TF表达之间有密切关系,血小板在止血、凝血及血栓性疾病发病方面起着其他重要的作用,因此在输血实践中,将进一步研究对接受受试者的止血平衡产生临床相关影响。
