肿瘤坏死因子-α诱导蛋白8样分子-2通过NF-κB信号通路影响LPS诱导的支气管上皮细胞分泌炎症因子①
2021-05-27穆亚敏宋志勇刘启明湘潭医卫职业技术学院湘潭410004
穆亚敏 宋志勇 刘启明 黄 希(湘潭医卫职业技术学院,湘潭 410004)
急性肺损伤是临床上常见的危重疾病,其分子发生机制十分复杂,目前仍然缺乏有效的防治手段[1]。研究表明,急性肺损伤的发生与炎症反应有关[2]。脂多糖(lipopolysaccharide,LPS)作为革兰氏阴性菌细胞外膜的主要成分,其可以引起支气管上皮细胞释放炎症因子,从而促进炎症反应,诱导肺组织损伤发生,因此,研究LPS条件下支气管上皮细胞炎症发生的分子机制是目前医学工作者研究的热点[3]。肿瘤坏死因子-α诱导蛋白8样分子-2(tu‑mor necrosis factor-αinduced protein 8 like 2,TIPE2)具有免疫负调控作用,在淋巴结等免疫器官以及炎症组织中广泛表达,能够维持免疫稳定[4]。TIPE2具有抗炎作用,其可以有效抑制动脉粥样硬化炎症产生,后续在脑缺血再灌注、心衰等疾病中同样证实TIPE2具有抑制炎症浸润的功效[5-6]。在类风湿性关节炎中的研究显示,TIPE2低表达可以激活NF-κB信号从而促进疾病进展[7]。文献报道表明,TIPE2在哮喘支气管上皮细胞炎症介质释放中发挥抑制作用[8]。本次实验探讨TIPE2在LPS诱导的支气管上皮细胞炎症反应中的作用和机制,以期为阐明急性肺损伤炎症损伤机制和基因治疗急性肺损伤提供资料。
1 材料与方法
1.1 材料 人支气管上皮细胞系(16HBE)购自上海美轩生物科技有限公司;LPS购自美国Sigma公司;IL-8含量检测试剂盒购自上海康朗生物科技有限公司;TIPE2过表达载体由云舟生物科技(广州)有限公司构建;PCR试剂购自大连TaKaRa公司;IL-1β含量检测试剂盒购自武汉艾美捷科技有限公司;Trizol试剂购自美国Thermo Fisher公 司;Lipo‑fectamine 2000购自美国Invitrogen公司;IL-6含量检测试剂盒购自深圳市金准生物医学工程有限公司;NF-κBp65抗体、p-ⅠκBαSer32抗体、TIPE2抗体购自美国Abcam公司;细胞核蛋白提取试剂盒购自美国Sigma公司。
1.2 方法
1.2.1 LPS对支气管上皮细胞中TIPE2表达影响检测 支气管上皮细胞分别用0和25µg/ml的LPS细胞培养液处理培养,分别记为Normal和LPS组,细胞培养刺激12 h后,收集细胞用下述RT-PCR和Western blot方法检测TIPE2表达变化。RT-PCR:收集细胞,以Trizol试剂常规方法提取总RNA,用紫外分光光度计测定RNA样品在260 nm和280 nm吸光度的比值,比值在1.8~2.0之间可用于后续实验。取1µl的RNA,添加1µl 10 mmol/L的dNTP和1µl oligo(dT)primer,以无菌水补足12µl,在65℃下反应5 min,然后冰浴10 min;再添加4µl 5×Reaction Buffer、2µl DTT、1µl RNA酶抑制剂,在37℃反应2 min,添加1µl的M-MLV RTase,37℃孵育50 min,70℃保温15 min,将制备的cDNA保存在-20℃。RT-PCR方法定量检测TIPE2 mRNA表达。以β-ac‑tin作为内参,引物序列为:TIPE2上游5′-TCAGAAACATCCAAGGCCAGAC-3′,下游5′-CG‑GACCGACCAGCCATTTTAC-3′;β-actin上 游5′-TGCGTGACATCAAAGAGAAG-3′,下游5′-TCCATACCCAAGAAGGAAGG-3′。RT-PCR体系为:上下游引物各0.5µl、12.5µl的SYBR Premix Ex TaqTM、1µl的cDNA,添加ddH2O至25µl,在PCR仪上反应,反应程序为:95℃孵育30 s,95℃孵育5 s,60℃孵育20 s,循环40次。结果用2-ΔΔCtCt法计算。
Western blot:收集细胞,用冰冷的PBS反复漂洗细胞3次,然后在细胞中添加蛋白抽提试剂,置于冰上裂解30 min,4℃12 000 r/min离心10 min,收集蛋白上清溶液。采用BCA方法测定蛋白浓度,步骤同试剂盒说明书。配制8%的SDS-PAGE凝胶。取蛋白样品,添加5×上样缓冲液混合,100℃煮沸5 min,加样,每孔添加50µg蛋白样品。采用8 V/cm电压观察染料到达分离胶边缘后,调整电压为15 V/cm继续电泳,染料进入到凝胶底部1 cm时,将电压关闭。在4℃条件下转膜,转膜条件为110 mA恒流。取出NC膜,在4℃条件下封闭过夜,封闭液用5%的BSA。用TBST洗涤3次,将NC膜放在TIPE2一抗(1:600)中,在37℃反应2 h。继续以TBST洗涤3次,把NC膜放在以1:3 000稀释后的辣根过氧化物酶标记的山羊抗鼠IgG中,室温孵育2 h。采用ECL方法显色,步骤同ECL显色试剂盒说明书。Image J分析条带的吸光度值,内参用β-actin,分析TIPE2蛋白表达变化。
1.2.2 细胞转染及过表达效果检测 收集人支气管上皮细胞,用Lipofectamine2000分别把TIPE2过表达载体(pcDNA3.1-TIPE2)和对照载体(pcDNA3.1)转染到细胞中,步骤完全按照转染试剂说明书操作,并且把转染后的支气管上皮细胞用25µg/ml的LPS细胞培养液培养,分别命名为LPS+TIPE2和LPS+vector组。细胞培养12 h后,用RT-PCR和Western blot方法检测TIPE2表达变化,步骤同1.2.1。
1.2.3 细胞分泌IL-6、IL-8、IL-1β水平检测 收集培养12 h后的Normal、LPS、LPS+vector、LPS+TIPE2组细胞培养液上清,用ELISA方法检测IL-6、IL-8、IL-1β含量,步骤均参照试剂盒说明书。
1.2.4 细胞中NF-κBp65、p-ⅠκBαSer32蛋白表达检测 收集培养12 h后的Normal、LPS、LPS+vector、LPS+TIPE2组细胞,用Western blot方法检测细胞中NF-κBp65、p-ⅠκBαSer32蛋白表达情况,步骤同1.2.1。同时提取培养12 h后的Normal、LPS、LPS+vector、LPS+TIPE2组细胞核蛋白,蛋白提取步骤参照细胞核蛋白提取试剂盒,用Western blot方法检测NF-κBp65蛋白表达。
1.2.5 NF-κB信号激活剂对过表达TIPE2影响支气管上皮细胞分泌炎症因子的作用 取1.2.2转染TIPE2过表达载体后的支气管上皮细胞,用含有1µmol/L的NF-κB激活剂PMA和25µg/ml的LPS细胞培养液培养记为LPS+TIPE2+PMA组,设置LPS+TIPE2组作为参照,培养12 h后,用ELISA方法测定上清中IL-6、IL-8、IL-1β含量,Western blot方法测定细胞中NF-κBp65、p-ⅠκBαSer32蛋白表达情况,步骤均同1.2.1。
1.3 统计学分析 采用SPSS21.0软件分析所得实验数据,数据均用±s表示,两组数据采用独立样本t检验,多组差异比较采用单因素方差分析,组间比较均采用LSD-t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 LPS对支气管上皮细胞TIPE2、IL-6、IL-8、IL-1β、NF-κBp65、p-ⅠκBα影响LPS处理后的支气管上皮细胞中TIPE2 mRNA以及蛋白水平均下降,IL-6、IL-8、IL-1β分泌水平升高,细胞核NF-κBp65蛋白表达增加(图1,表1)。

图1 Western blot方法测定LPS处理后支气管上皮细胞中TIPE2、NF-κBp65、p-ⅠκBαSer 32蛋白表达Fig.1 Western blot analysis of expression of TIPE2,NFκBp65,p-ⅠκBαSer 32protein in LPS treated bronchi-al epithelial cells
表1 LPS处理对支气管上皮细胞中TIPE2 mRNA、蛋白表达、分泌IL-6、IL-8、IL-1β和细胞中NF-κBp65、p-ⅠκBαSer 32蛋白表达影响(±s,pg/ml)Tab.1 Effects of LPS treatment on the expression of TIPE2 mRNA,protein,secretion of IL-6,IL-8,IL-1β,NF-κBp65and p-ⅠκBαSer 32 protein expression in bronchial epithelial cells(±s,pg/ml)

表1 LPS处理对支气管上皮细胞中TIPE2 mRNA、蛋白表达、分泌IL-6、IL-8、IL-1β和细胞中NF-κBp65、p-ⅠκBαSer 32蛋白表达影响(±s,pg/ml)Tab.1 Effects of LPS treatment on the expression of TIPE2 mRNA,protein,secretion of IL-6,IL-8,IL-1β,NF-κBp65and p-ⅠκBαSer 32 protein expression in bronchial epithelial cells(±s,pg/ml)
Note:Compared with normal group,1)P<0.05.
cell nucleus NF-κBp65 0.13±0.01 0.32±0.031)Groups TIPE2 mRNA TIPE2 protein IL-6 IL-8 IL-1β NF-κBp65 p-ⅠκBαSer 32 Normal LPS 1.00±0.11 0.36±0.021)0.62±0.03 0.21±0.041)145.24±12.02 384.61±32.841)12.35±1.21 72.91±6.171)76.58±6.32 357.16±33.271)0.24±0.03 0.55±0.061)0.20±0.02 0.57±0.041)
2.2 TIPE2过表达载体对LPS处理的支气管上皮细胞TIPE2、IL-6、IL-8、IL-1β、NF-κBp65、p-ⅠκBα影响 在支气管上皮细胞中转染TIPE2过表达载体,细胞中TIPE2 mRNA以及蛋白水平均升高,IL-6、IL-8、IL-1β水平降低,细胞中NF-κBp65、p-ⅠκBαSer32蛋白表达表达减少,细胞核NF-κBp65蛋白表达增加(图2,表2)。TIPE2过表达载体可明显提高LPS条件下支气管上皮细胞中TIPE2表达水平。

图2 Western blot方法测定TIPE2过表达载体转染后LPS条件下支气管上皮细胞中TIPE2、NF-κBp65、p-ⅠκBαSer 32蛋白表达Fig.2 Western blot analysis of the expression of TIPE2,NF-κBp65,p-ⅠκBαSer 32 protein in bronchial epi-thelial cells under LPS condition after transfection with TIPE2 overexpression vector
表2 TIPE2过表达载体对LPS条件下支气管上皮细胞中TIPE2 mRNA、蛋白表达、分泌IL-6、IL-8、IL-1β和细胞中NFκBp65、p-ⅠκBαSer 32蛋白表达影响(±s,pg/ml)Tab.2 Effect of TIPE2 over expression vector on the expression of TIPE2 mRNA,protein,secretion of IL-6,IL-8,IL-1β,NF-κBp65 and p-ⅠκBαSer 32 protein expression in bronchial epithelial cells under LPS condition(±s,pg/ml)

表2 TIPE2过表达载体对LPS条件下支气管上皮细胞中TIPE2 mRNA、蛋白表达、分泌IL-6、IL-8、IL-1β和细胞中NFκBp65、p-ⅠκBαSer 32蛋白表达影响(±s,pg/ml)Tab.2 Effect of TIPE2 over expression vector on the expression of TIPE2 mRNA,protein,secretion of IL-6,IL-8,IL-1β,NF-κBp65 and p-ⅠκBαSer 32 protein expression in bronchial epithelial cells under LPS condition(±s,pg/ml)
Note:Compared with LPS+vector group,1)P<0.05.
cell nucleus‑NF-κBp65 0.49±0.06 0.63±0.041)Groups TIPE2 mRNA TIPE2 protein IL-6 IL-8 IL-1β NF-κBp65 p-ⅠκBαSer 32 LPS+vector LPS+TIPE2 1.00±0.11 2.35±0.211)0.24±0.05 0.45±0.041)376.54±39.15 264.22±20.831)72.06±5.83 40.59±3.021)354.87±34.96 227.14±20.481)0.57±0.04 0.39±0.041)0.58±0.05 0.33±0.031)
2.3 NF-κB激活剂对过表达TIPE2的支气管上细胞中IL-6、IL-8、IL-1β、NF-κBp65、p-ⅠκBα的影响NF-κB激活剂PMA处理过表达TIPE2的支气管上细胞,经LPS处理,细胞中的NF-κBp65、p-ⅠκBαSer32蛋白水平升高,细胞分泌的IL-6、IL-8、IL-1β增多(表3,图3)。NF-κB激活剂逆转过表达TIPE2对LPS条件下支气管上细胞分泌炎症因子的影响。
表3 NF-κB激活剂对TIPE2过表达载体影响LPS条件下支气管上皮细胞中NF-κBp65、p-ⅠκBαSer 32蛋白表达和分泌IL-6、IL-8、IL-1β作用(±s,pg/ml)Tab.3 Effects of NF-κB activator on NF-κBp65,p-ⅠκBαSer 32expression and secretion of IL-6,IL-8 and IL-1βin LPS treated bronchial epithelial cells(±s,pg/ml)
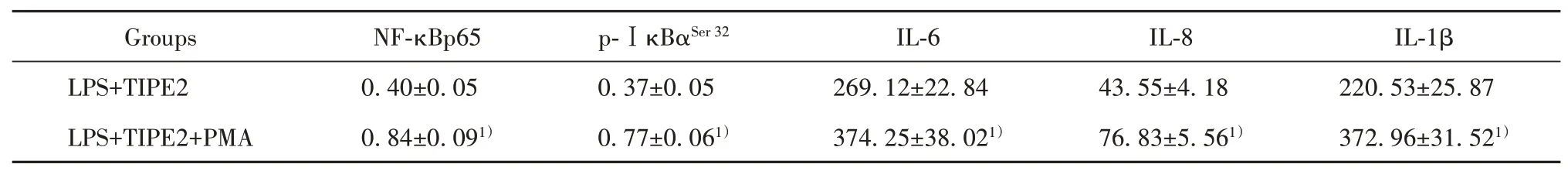
表3 NF-κB激活剂对TIPE2过表达载体影响LPS条件下支气管上皮细胞中NF-κBp65、p-ⅠκBαSer 32蛋白表达和分泌IL-6、IL-8、IL-1β作用(±s,pg/ml)Tab.3 Effects of NF-κB activator on NF-κBp65,p-ⅠκBαSer 32expression and secretion of IL-6,IL-8 and IL-1βin LPS treated bronchial epithelial cells(±s,pg/ml)
Note:Compared with LPS+TIPE2 group,1)P<0.05.
Groups LPS+TIPE2 LPS+TIPE2+PMA NF-κBp65 0.40±0.05 0.84±0.091)p-ⅠκBαSer 32 0.37±0.05 0.77±0.061)IL-1β 220.53±25.87 372.96±31.521)IL-6 269.12±22.84 374.25±38.021)IL-8 43.55±4.18 76.83±5.561)

图3 Western blot测定LPS条件下NF-κB激活剂处理后过表达TIPE2的支气管上皮细胞中NF-κBp65、p-ⅠκBαSer 32蛋白表达Fig.3 Western blot analysis of expression of NF-κBp65 and p-ⅠκBαSer 32in bronchial epithelial cells under LPS condition of overexpression of TIPE2 after treatment with NF-κB activator
3 讨论
呼吸道以及肺组织中失控炎症是急性肺损伤发生的主要原因之一,其炎症初期往往由革兰氏阴性菌感染导致[9]。LPS是革兰氏阴性菌细胞壁的主要成分,也是常见的诱导急性肺损伤发生的诱导因子[10]。LPS可以促进支气管上皮细胞产生炎症介质,从而加快急性肺损伤进程。IL-6、IL-8、IL-1β是常见的炎症因子,在炎症反应中发挥促进作用[11-12]。本次实验结果证实LPS处理后的支气管上皮细胞分泌的IL-6、IL-8、IL-1β含量升高,说明LPS诱导炎症反应,这与之前的研究报道结果一致,提示成功构建了支气管上皮细胞损伤模型。
TIPE2是目前为止研究最多的TNFAIP8家族成员,其是在探讨自身免疫脑脊髓炎过程中发现的,优先表达于炎症组织和免疫器官[13-14]。TIPE2表达下调常常与多种炎症相关疾病如糖尿病肾炎、哮喘、肝纤维化等有关[15-17]。TIPE2可以通过影响下游基因和信号通路的表达发挥抗炎功效[18]。研究表明,过表达TIPE2可以显著降低哮喘过程支气管上皮细胞相关炎症介质的释放,TIPE2对于肺组织炎症可能具有抑制作用[8]。本实验结果表明,LPS处理后的支气管上皮细胞中TIPE2表达下调,而过表达TIPE2可以明显抑制LPS诱导的支气管上皮细胞释放炎症因子,提示TIPE2在支气管上皮细胞炎症反应中发挥负调控作用。
目前对于TIPE2在炎症反应中的作用机制还不明确,已知其可以通过多种方式调控多种信号通路的激活水平,从而发挥多重生物学功效,进而参与疾病进展[19]。在缺血再灌注损伤研究过程中发现TIPE2可以抑制心肌炎症细胞浸润,抑制NF-κB信号通路的激活[20]。NF-κB是一个转录调节因子,其可以被多种因子刺激而激活,NF-κB是一个由Rel家族成员构建的二聚体蛋白,其中NF-κBp65和p-ⅠκBαSer32是NF-κB信号激活水平的标志蛋白[21]。NFκB信号与炎症反应有关,其激活后可促进炎症反应[22-23]。研究显示,LPS可以诱导支气管上皮细胞中NF-κB信号激活,NF-κB信号在急性肺损伤中发挥促进作用[24]。本实验表明,过表达TIPE2可以明显抑制LPS诱导的支气管上皮细胞中NF-κB信号激活,并且NF-κB信号激活剂能够逆转TIPE2的抗炎因子释放作用,这说明TIPE2在支气管上皮细胞释放炎症因子与NF-κB信号有关。
总而言之,TIPE2在急性肺损伤中可能发挥保护作用,TIPE2在LPS诱导的支气管上皮细胞炎症因子释放中发挥抑制作用,其作用机制与下调NFκB信号激活程度有关。本次实验结果为研究急性肺损伤发生机制及TIPE2作用机制提供参考及依据。在后期的实验中会继续研究TIPE2在急性肺损伤中的作用以及其对下游信号通路的影响。
