滋养层细胞表面抗原-2促进鼻咽癌细胞增殖、迁移和侵袭能力的实验研究△
2021-05-27蒋迪陈顺金于肖肖徐志鸿李刚黎润球毛志强叶贝华何锦添
蒋迪 陈顺金 于肖肖 徐志鸿 李刚 黎润球 毛志强 叶贝华 何锦添
(1.南方医科大学附属东莞医院耳鼻咽喉科 东莞 523000;2.南方医科大学附属珠江医院耳鼻喉科 广州 510280)
鼻咽癌具有独特的不均衡性地域分布特点,主要集中在中国南部及南亚地区[1]。由于鼻咽癌发生部位较为隐蔽,初发症状不明显,多数患者在确诊时已为疾病中、晚期且常伴有转移[2]。常规放射治疗(简称放疗)联合化学药物治疗(简称化疗)是鼻咽癌治疗的标准方案[3],而鼻咽癌治疗失败的主要原因为局部复发和远处转移[4]。因此有效预测鼻咽癌的侵袭、转移潜能,寻找潜在的分子靶点,对鼻咽癌的精准治疗及判断预后具有重要的意义。人滋养层细胞表面抗原-2(trophoblast cell-surface antigens-2, Trop2)在正常组织不表达或少量表达,却异常高表达于多种肿瘤,如胰腺癌、乳腺癌、结肠癌、胃癌、口腔鳞癌、卵巢癌等。Trop2可促进肿瘤细胞的增殖、侵袭和转移扩散,其高表达与肿瘤患者生存期缩短及不良预后密切相关[5-6]。Trop2已成为肿瘤临床治疗的靶分子之一,抗Trop2相关位点或通路药物的临床应用已使许多转移癌患者获益[5,7]。然而,Trop2在鼻咽癌中的表达情况及其可能的调控作用机制目前报道较少,还需要进一步深入的研究。
1 材料与方法
1.1 材料
1)组织标本。收集41例鼻咽癌和24例对照鼻咽组织标本,均来自东莞市人民医院耳鼻咽喉科。对照鼻咽组织标本来源于鼻咽磁共振成像提示鼻咽增厚,但临床无相关症状且鼻咽活检后病理排除肿瘤等相关病变的患者。该研究在东莞市人民医院伦理委员会的同意和监督下开展(伦理注册号:PJ201711-020-C1),并与患者及家属签署知情同意书,获得患者及家属的知情同意。
2)人源性鼻咽癌细胞株CNE-2购自上海中科院细胞库。3)主要试剂。Nanog、OCT4、Trop2、U6 qPCR引物(生工生物有限公司,上海);重组腺病毒载体(吉玛公司,上海); SYBR®Premix Ex Taq™ Ⅱ试剂(TaKaRa公司,日本);EdU细胞增殖检测试剂盒 (锐博生物技术公司,广州),鼠抗人Trop2、鼠抗 人E-cadherin、N-cadherin及GAPDH抗体(Abcam公司,美国)。
1.2 实验方法
1.2.1 石蜡切片免疫组织化学染色 切片脱蜡后抗原修复,清除过氧化物,一抗(Trop2兔单克隆抗体)孵育于4 ℃过夜,二抗(鼠抗兔抗体)孵育于37 ℃1 h,二甲基联苯胺(DAB)显影,苏木素复染,脱水,中性树胶封片后置显微镜下观察,染色结果判定参考相关文献[8]。
1.2.2 细胞株与细胞培养 鼻咽癌细胞株CNE-2以含10%胎牛血清培养基在5% CO2、37 ℃培养箱内常规培养,每2~3 d进行消化、传代,收集对数生长期的细胞进行实验。
1.2.3 病毒转染 取对数生长期的CNE-2细胞以5×105个/孔的密度接种于6孔板中,待细胞贴壁后将重组腺病毒载体按感染指数(MOⅠ)=50稀释后加入6孔板中,转染48 h后收集细胞进行实验。
1.2.4 EdU标记 EdU工作液重悬转染后的CNE-2鼻咽癌细胞,将各组生长良好的细胞以1×105个/孔的密度接种于96孔板中。在5% CO2的37 ℃培养箱内培养48 h后,4%多聚甲醛溶液中固定,EdU细胞增殖检测试剂盒进行检测。
1.2.5 MTT法 将转染后的CNE-2细胞以2×103个/孔的密度接种于96孔板中,在5%CO2的37 ℃培养箱内培养72 h后加入10 μL 四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)溶液(5 mg/mL),置培养箱内避光孵育4 h,酶标仪于450 nm计算吸光度(optical density,OD)值。
1.2.6 RNA提取及实时荧光定量聚合酶链反应 TRⅠzol裂解液提取细胞内总RNA,反转录cDNA合成试剂盒制备cDNA。按说明书使用CFX96实时荧光定量聚合酶链反应(real time polymerase chain reaction,RT-PCR)检测系统进行RT-PCR。引物具体序列如表1所示。

表1 相关基因的上、下游引物序列
1.2.7 Western印迹 RⅠPA蛋白裂解液试剂盒提取总蛋白,95 ℃变性处理5 min,取20 μg蛋白进行8%聚丙烯酰胺凝胶电泳,电转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜,奶粉封闭后分别加入Trop2一抗(1∶2 000)、E-cadherin一抗(1∶2 000) 、N-cadherin一 抗(1∶2 000)和GAPDH一 抗(1∶5 000),4 ℃孵育过夜后加入二抗(1∶5 000),孵育完成后用TBST(Tris-HC1缓冲盐溶液+Tween,Tween为一种非离子型去污剂)缓冲液洗膜3次,ECL化学发光法进行检测。
1.2.8 Transwell侵袭及迁移实验 Transwell侵袭实验小室铺好基质胶备用,无血清培养基重悬细胞,在上室中加入200 μL含5×104个细胞的细胞悬液,下室中加入600 μL含10% 胎牛血清的DMEM/F-12培养液,将小室放在37 ℃、5% CO2培养箱中培养,24 h后置显微镜下观察拍照并计数。Transwell迁移实验小室不铺基质胶,其余步骤与Transwell侵袭实验相同。
1.3 统计学处理 数据记录均采用均数±标准差表示,运用SPSS 17.0统计软件,采用独立样本t检验与配对t检验进行分析。Trop2的表达与临床病理特征之间的组间比较采取χ2检验确切概率法。以P<0.05为差异有统计学意义。
2 结果
2.1 Trop2在鼻咽癌肿瘤组织中的表达及与临床病理特征的关系 免疫组织化学染色显示Trop2主要分布于鼻咽癌组织的细胞膜上。鼻咽癌组织标本(图1B)与对照鼻咽上皮标本(图1A)相比,前者Trop2的表达明显高于后者。鼻咽癌组织中的Trop2阳性表达率明显高于对照鼻咽上皮,分别为(60.1±36.7)%和(11.9±18.4)%,差异有统计学意义(t=5.998,P<0.05),见图1C。平均OD值分析提示Trop2在鼻咽癌组织中的表达高于对照鼻咽上皮,分别为0.261±0.079和0.109±0.160,差异有统计学意义(t=4.339,P<0.05),见图1D。鼻咽癌组织中Trop2的表达水平与患者年龄及性别无明显相关性(P>0.05),与肿瘤病理分期及淋巴结转移显著相关,差异具有统计学意义(P<0.05),见表2。
2.2 Trop2与鼻咽癌细胞的细胞干性呈正相关 病毒转染构建Trop2低表达和高表达的鼻咽癌细胞,并通过RT-PCR(图2A)和Western印迹(图2B)验证,随后进行下一步实验。实时荧光定量PCR显示Trop2低表达组Nanog、OCT4mRNA的表达明显低于对照组,Trop2高表达组Nanog、OCT4mRNA的表达则明显高于Trop2对照组,差异均具有统计学意义(t=4.176,P<0.05;t=3.896,P<0.05),见图2C。EdU染色发现Trop2低表达组和对照组的EdU阳性细胞比例分别为(55.5±3.3)%和(63.6±3.7)%;Trop2高表达组和对照组的EdU阳性细胞比例分别为(67.0±2.7)%和(51.9±4.9)%,差异均具有统计学意义(t=6.078,P<0.05;t=-7.214,P<0.05)。 同时,MTT结果显示Trop2低表达组和对照组的72 hOD值分别为0.296±0.045和0.616±0.011,Trop2高表达组和对照组的72 hOD值分别为0.847±0.042和0.610±0.013(t=19.551,P<0.05;t=-15.076,P<0.001),差异均具有统计学意义(图3)。

图1 Trop2在鼻咽癌组织中表达明显高于对照鼻咽上皮 A.Trop2在对照鼻咽上皮中的表达情况(SP法×100);B.Trop2在鼻咽癌组织中的表达情况(SP法×100);C.阳性细胞计数;D.OD值检测。
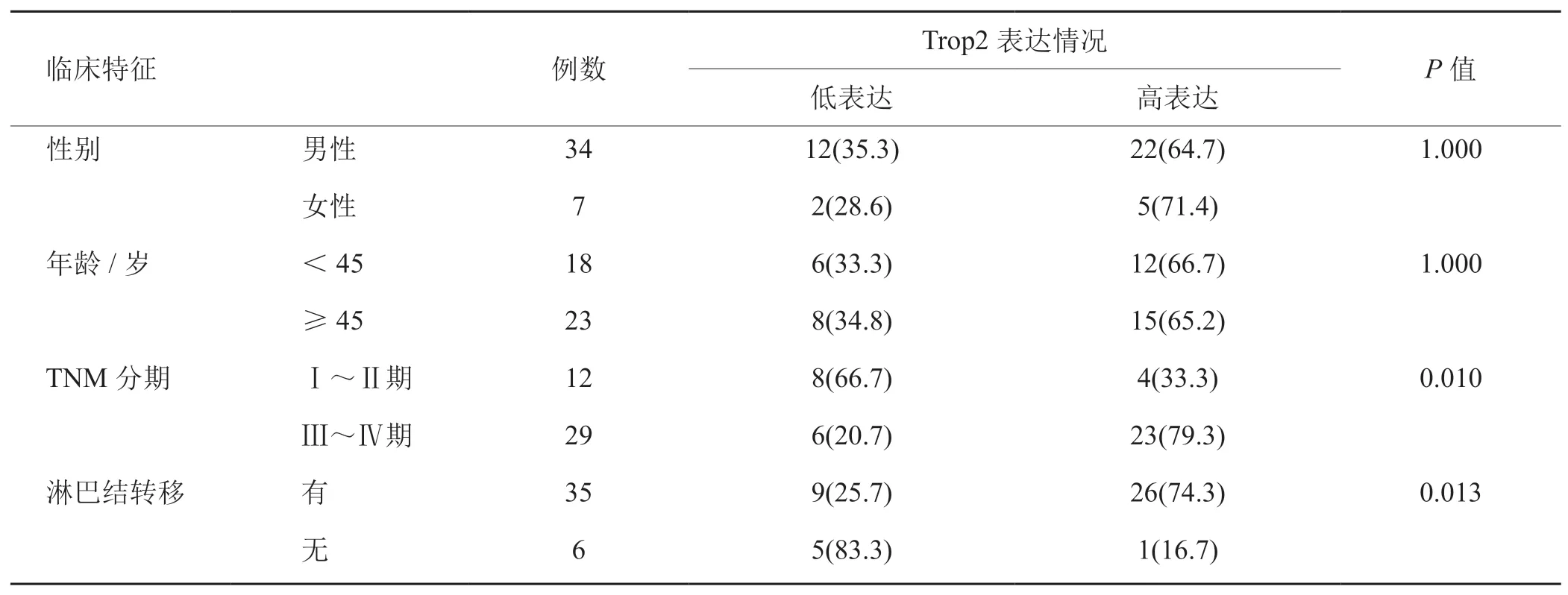
表2 Trop2在鼻咽癌组织中的表达情况[n(%)]
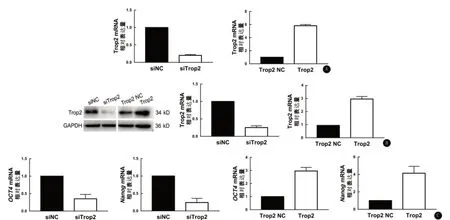
图2 Trop2与肿瘤细胞干性有关 A.RT-PCR检测病毒转染后各组Trop2 mRNA相对表达量;B. Western印迹检测病毒转染后各组Trop2的蛋白表达水平;C.RT-PCR检测病毒转染后各组Nanog、OCT4 mRNA相对表达量。NC为对照组。
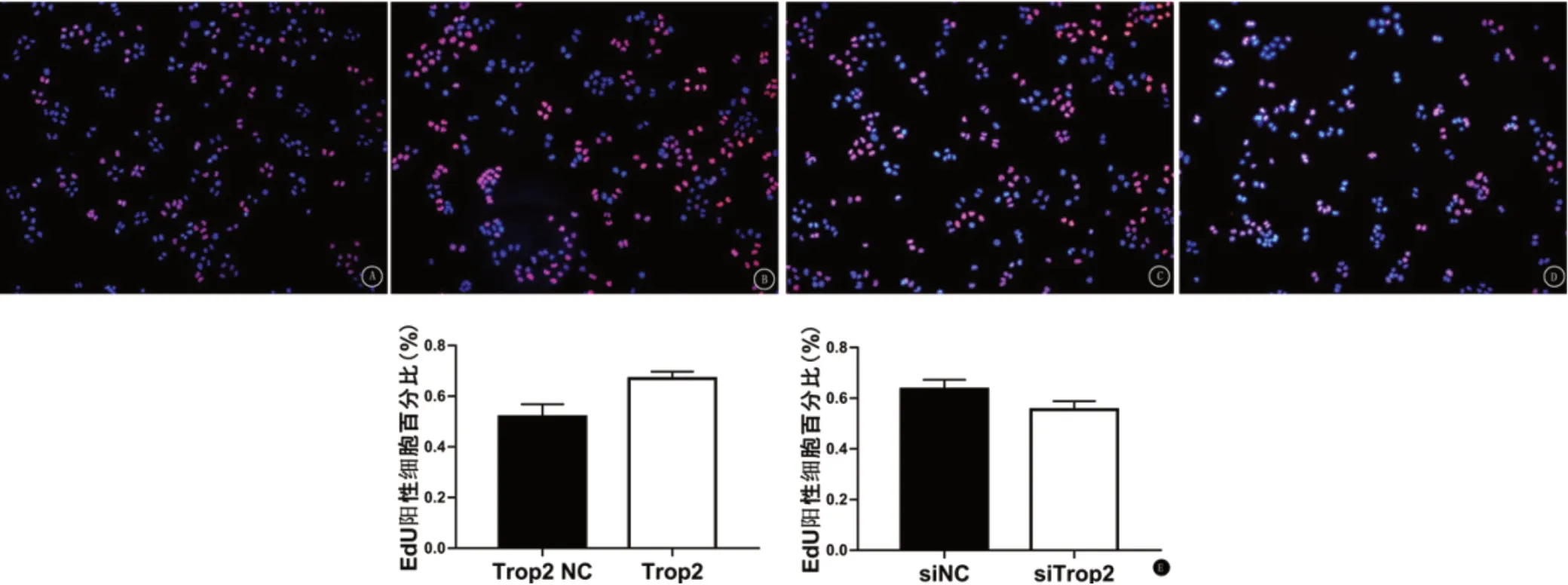
图3 Trop2与肿瘤细胞增殖能力有关 A.EdU染色Trop2过表达对照组;B.EdU染色Trop2过表达组;C.EdU染色Trop2沉默对照组;D.EdU染色Trop2沉默组;E.EdU实验的量化计数结果;F.MTT方法检测转染细胞的相对活性。NC为对照组。
2.3 Trop2可以促进鼻咽癌细胞的迁移和侵袭能力 在迁移实验中,CNE-2细胞株中Trop2低表达组、对照组中每视野下平均迁移细胞数目分别为(101.20±12.47)个、(157.70±29.31)个,Trop2高表达组、对照组中每视野下平均迁移细胞数目分别为(435.60±33.66)个、(277.10±20.96)个,差 异 均具 有 统 计 学 意义(t=5.609,P<0.05;t=5.609,P<0.05)。在侵袭实验中,CNE-2细胞株中Trop2低表达组、对照组中每视野下平均侵袭细胞数目分别为(98.33±8.25)个、(68.89±12.53)个,Trop2高 表达组、对照组中每视野下平均侵袭细胞数目分别为(274.00±22.58)个、(153.89±28.34个),差 异 均具有统计学意义(t=5.887,P<0.05;t=-9.944,P<0.05),详见图4。

图4 Trop2过表达可以促进鼻咽癌细胞的转移和侵袭能力 A.Transwell迁移实验Trop2过表达对照组;B.Transwell迁移实验Trop2过表达组;C.Transwell迁移实验Trop2沉默对照组;D.Transwell迁移实验Trop2沉默组;E.Transwell侵袭实验Trop2过表达对照组;F.Transwell侵袭实验Trop2过表达组;G.Transwell侵袭实验Trop2沉默对照组;H.Transwell侵袭实验Trop2沉默组;Ⅰ.Transwell迁移实验的量化计数结果;J.Transwell侵袭实验的量化计数结果。NC为对照组。
2.4 Trop2可以促进鼻咽癌细胞中上皮细胞-间充质 转 化(epithelial-mesenchymal transition,EMT)过程 Trop2低表达组E-cadherin蛋白较对照组显著升高,而N-cadherin蛋白较对照组显著降低;反之,Trop2高表达组的E-cadherin蛋白较对照组显著降低,而N-cadherin蛋白较对照组显著升高,见图5。

图5 Trop2可以促进鼻咽癌细胞中上皮组织向间充质细胞转型 Trop2对E-cadherin、N-cadherin蛋白表达的影响。NC为对照组。
3 讨论
Trop2是一种肿瘤相关抗原,又称为肿瘤相关钙离子信号转导子2(tumor-associated calcium signal transducer-2,TACSTD2)[7]。Trop2基因在多种恶性肿瘤中高表达并参与肿瘤的发生、发展及转移等恶性行为。本实验采用免疫组织化学方法检测41例鼻咽癌及24例对照鼻咽上皮中Trop2的表达,结果显示鼻咽癌组织中Trop2表达水平明显高于对照组,提示Trop2可能与鼻咽癌组织相关。进一步研究显示,Trop2表达水平在有淋巴结转移组高于无淋巴结转移组;在临床分期Ⅲ~Ⅳ期病例组高于Ⅰ ~Ⅱ期病例组,这些结果表明Trop2与鼻咽癌的发生、转移有关,可能在促进细胞恶性转化中发挥作用。
为研究Trop2基因的生物学功能,观察Trop2基因对人鼻咽癌CNE-2增殖、侵袭、迁移能力的影响,我们通过病毒转染成功构建Trop2低表达和高表达的鼻咽癌细胞株。EdU染色、MTT及RT-PCR证明Trop2可以促进鼻咽癌细胞的增殖能力和上调干细胞基因的表达。Transwell侵袭及迁移实验结果表明 Trop2能够增强鼻咽癌细胞的侵袭和迁移能力。本研究还检测了过表达Trop2 后鼻咽癌细胞EMT表面标志物的表达情况,发现过表达Trop2后能下调上皮细胞标志物E-cadherin,同时上调间皮细胞标志物N-cadherin,说明Trop2可以促进鼻咽癌细胞中EMT过程。EMT现象是指上皮细胞在正常生理和特定病理条件下发生向间充质细胞表型转化的现象[9]。在肿瘤转移起始过程中,肿瘤细胞为了适应微环境的变化,需要发生许多表型改变,正常上皮组织的多层细胞结构不利于恶性肿瘤细胞的迁移与浸润,为了获得运动能力,肿瘤细胞通过发生EMT现象丢失上皮表型,失去其基底细胞的极性及细胞与细胞之间的黏附性,而获得更易侵袭转移的间质细胞表型。因此EMT是多种上皮源性肿瘤中肿瘤侵袭及早期转移中起决定性作用的过程[10]。研究显示Trop2可以通过诱导胃癌、胆囊癌、宫颈癌等多种肿瘤中EMT过程从而促进肿瘤细胞的侵袭迁移能力[11-13],这与我们在鼻咽癌肿瘤细胞中的研究结果是相似的。
此外,EMT现象还能使肿瘤细胞重编程后具备干细胞样特性[14-15]。我们通过EdU染色、MTT、RT-PCR也发现Trop2可以上调鼻咽癌细胞的增殖能力和干细胞标记物的表达,提示Trop2与鼻咽癌细胞的干性细胞获得存在直接联系。Trop2不仅在胚胎干细胞增殖特性维持以及器官形成、发展过程中发挥重要作用[16-17],还具备调控成体干细胞生长的能力,可以促进干细胞和前体细胞的更新及组织修复[18-19]。因此我们提出Trop2可能是鼻咽癌肿瘤干细胞特征基因的猜想。肿瘤干细胞是肿瘤组织中的“种子细胞”,它与肿瘤的发生、发展、侵袭和转移密切相关,具有自我更新能力,能在特定的条件下进行分化[20-21]。同时可较长时间地处于休眠状态,通过多种耐药分子降低对放疗和化疗的敏感度,导致肿瘤的复发[22-23]。目前鼻咽癌肿瘤干细胞的研究已经引起了广泛关注,这为认识了解鼻咽癌的本质,实现鼻咽癌的靶向精准治疗奠定了基础。
综上所述,本研究揭示了Trop2在鼻咽癌组织中高表达,且与患者的淋巴结转移及肿瘤分期显著相关。Trop2可能是鼻咽癌肿瘤干细胞的特征基因,其可能通过诱导EMT过程促进鼻咽癌细胞的迁移和侵袭。这一结果可以为鼻咽癌的诊断和治疗提供新的思路及理论依据,但Trop2基因作为促进鼻咽癌发生、发展的重要因素,其在鼻咽癌肿瘤干细胞中的作用及具体机制尚有待深入研究。
