基于Ce-BDC的氧化物酶活性检测果汁中抗坏血酸的比色方法研究
2021-05-27刘光勤杨思龙艾雪莲梁秋红罗林频王建龙张文涛
杨 阳,刘光勤,杨思龙,艾雪莲,梁秋红, 罗林频,汪 蓉,王建龙,张文涛
(西北农林科技大学 食品科学与工程学院,陕西 杨凌 712100)
抗坏血酸(AA)又被称为维生素C(Vc),是一类具有烯二醇结构的还原性物质。抗坏血酸在维持人体正常生理机能中扮演着重要角色[1-2],适量的摄入抗坏血酸有利于增强机体抗应激能力和免疫力,促进钙、铁、叶酸等的吸收,预防癌症与心血管疾病等。此外,抗坏血酸作为一种抗氧化剂也被广泛用于医疗制药、食品加工和化妆品等领域[2]。但人体自身不能合成抗坏血酸,只能从外界摄取,因此检测食品和医药产品中的抗坏血酸含量是非常有必要的。目前常见的抗坏血酸检测方法有毛细管电泳法[3]、色谱法[4]、荧光法[5]以及电化学法[6]等,这些方法虽灵敏度高、特异性强,但其昂贵的仪器设备、复杂费时的操作过程限制了进一步应用。基于纳米酶的比色法因具有检测成本低、操作简单、无需专业人员的优点而备受关注。
天然酶大多是蛋白质和RNA,在高温、强酸、强碱等条件下易变性失活,失去催化活性,且天然酶不易提取或提取费用高。纳米酶具有合成简单、制备成本低、可回收利用、对极端反应条件耐受性强等优点,有望作为天然酶的替代品。尽管近年来纳米酶领域已取得了很大发展,但纳米酶的催化能力弱于天然酶,且特异性差[7],这些缺点限制了纳米酶在各个领域的发展,因此寻求具有优异催化性能的纳米材料是目前的研究热点。金属有机骨架(MOFs)也称多孔配位聚合物(PCPs),是一种新型晶态微孔材料,具有比表面积大、孔隙率高、孔道形状及尺寸可调等优点[8-9],已被广泛用于纳米酶的开发。迄今为止,大量的MOFs材料(如Fe-MOFs[10]、Cu-MOFs[11]、Co-MOFs[12]、Zn-MOFs[13]、Zr-MOFs[14]、Ce-MOFs[15]等)被开发作为纳米酶用于生物传感、生物医学、环境监测等领域。这些MOFs材料的活性催化中心高度依赖于具有氧化还原活性的多价态金属元素,因此以多金属或多价态金属作为活性中心是开发高性能纳米酶的一个可行策略。
本文以对苯二甲酸(H2BDC)为有机配体,Ce为活性金属中心合成了一种金属有机框架材料Ce-BDC。Ce-BDC可模拟氧化物酶活性并催化3,3,5,5-四甲基联苯胺(TMB)生成氧化反应产物oxTMB,溶液由无色变为蓝色并在652 nm处出现很强的紫外吸收峰。抗坏血酸的加入可以还原oxTMB,从而使溶液蓝色减弱且在652 nm处的紫外吸收值下降,本文基于此建立了一种检测成本低、操作简单、灵敏、迅速、选择性好的检测抗坏血酸的比色方法。
1 实验部分
1.1 仪器与试剂
傅里叶变换红外光谱仪、XRD粉末衍射仪(德国布鲁克公司);UV-2550紫外可见分光光度计(日本岛津公司);X射线光电子能谱仪(美国赛默飞世尔科技公司);高速冷冻离心机(北京仪诺科兴科技发展有限公司);电热恒温鼓风干燥箱(上海森信实验仪器有限公司);扫描电子显微镜(日本日立公司);pH计(美国梅特勒-托利多仪器公司);超声清洗器(昆山禾创超声仪器公司);分析天平(中国奥豪斯仪器公司)。
对苯二甲酸(H2BDC,99%)、抗坏血酸(AA,≥99.7%)、酒石酸(TA,≥99%)、柠檬酸(CA,≥99.5%)、谷氨酸(Glu,≥98.5%)、天冬氨酸(Asp,99%)、果糖(≥99%)、淀粉(≥99%)、蔗糖(≥99%)等均购于阿拉丁试剂(上海)有限公司。乙酸(≥99%)、醋酸钠(≥99%)、氢氧化钠(98%)、氯化钠(≥99.5%)、氯化钾(≥99.5%)、氯化钙(≥96%)、氯化铁(≥99%)、氯化镁(≥98%)、氯化镍(≥98%)、氯化铜(≥99%)、氯化锰(≥99%)、N,N-二甲基甲酰胺(DMF)、丙酮等均购于国药集团化学试剂有限公司。硝酸铈铵、3,3,5,5-四甲基联苯胺(TMB)购自西格玛奥德里奇贸易有限公司。复合果汁购自杨凌示范区当地超市。所有试剂均为分析纯,实验用水为蒸馏水。
1.2 实验方法
1.2.1 Ce-BDC的制备采用改进的水热法合成Ce-BDC:首先,将0.548 g硝酸铈铵溶于2 mL水中,0.166 g有机配体对苯二甲酸溶于6 mL DMF中,然后将硝酸铈铵溶液缓慢加入到盛有对苯二甲酸的烧杯中,加热至100 ℃并保持搅拌15 min,自然冷却至室温,离心得淡黄色沉淀。沉淀再用DMF洗涤3次,并用丙酮浸泡过夜,随后放入80 ℃真空干燥箱中干燥2 h,最后得到淡黄色Ce-BDC(产率约72.6%)。
1.2.2 Ce-BDC的氧化物酶活性研究分别进行实验组和对照组两组实验。其中实验组依次加入醋酸盐缓冲液(0.2 mol/L,pH 3.0),不同浓度的Ce-BDC和TMB(20 mmol/L);对照组中只加入TMB和缓冲液。两组均于室温下反应10 min后,分别用紫外分光光度计在时间-扫描模式下监测其光谱。
1.2.3 Ce-BDC的稳态动力学研究反应体系为加入一定体积缓冲液(pH 3.0)、10 μL 1 mg/mL的Ce-BDC和不同浓度TMB溶液,最终反应体系的总体积为200 μL,溶液混合均匀后,用紫外分光光度计在时间-扫描监测模式下检测溶液在652 nm处的吸光度值。动力学参数根据米氏方程V=Vmax[S]/(Km+[S]) 计算,其中V代表催化反应的初始速度;Vmax表示该反应的最大速度,[S]为底物浓度;Km表示米氏常数。
1.2.4 抗坏血酸的检测向反应体系中依次加入醋酸盐缓冲液(0.2 mol/L,pH 3.0)、Ce-BDC(90 μg/mL)、TMB(1 mmol/L)以及一系列不同浓度的抗坏血酸溶液,反应体系总体积为500 μL。将反应体系置于室温下孵育2 min,孵育结束后用紫外分光光度计扫描其在300~800 nm下的吸收光谱,取652 nm处的吸光度值与抗坏血酸浓度绘制曲线。
2 结果与讨论
2.1 Ce-BDC的结构表征
通过扫描电子显微镜(SEM)获得了制备的Ce-BDC尺寸大小和形貌(图1A),图中可见Ce-BDC呈较为均匀的纳米颗粒状,其直径约150~180 nm。再采用XRD表征材料的晶体结构(图1B),发现该材料具有明显的晶形结构,其出现的峰可与UIO-66(Zr-BDC)的标准图谱峰对应。进一步采用XPS分析Ce-BDC中Ce的化学价态组成(图1C),发现917.5、908.6、905.2、902.3 eV处的峰与Ce4+的特征峰对应,899.1、889.0、886.2、883.7 eV处的峰与Ce3+的特征峰对应[15]。由此表明,具有双价态金属活性中心的金属有机框架材料Ce-BDC已成功合成。

图1 Ce-BDC的结构表征Fig.1 Structural characterizations of the Ce-BDC A:SEM images(SEM图像),B:XRD patterns(XRD图谱),C:XPS spectra of the Ce 3D regions(Ce 3D区域的XPS谱图)
2.2 Ce-BDC氧化物酶的现象研究
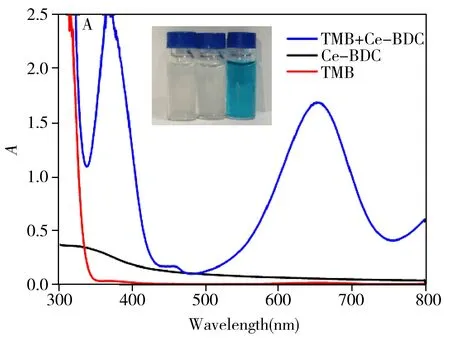
为研究Ce-BDC的氧化物酶催化活性,选择TMB为显色底物[16]。由图2A插图可知,Ce-BDC/TMB体系在652 nm处有一个明显的吸收峰且溶液呈蓝色,而单纯的TMB和Ce-BDC溶液在652 nm处则无吸收峰和相应的蓝色溶液,表明Ce-BDC催化无色的TMB生成了蓝色氧化态的TMB,即Ce-BDC具有氧化物酶的催化活性。
2.3 实验条件优化
2.3.1 反应时间的优化为了研究反应时间对反应体系的影响,监测了一系列浓度的Ce-BDC和TMB (1 mmol/L)混合溶液在652 nm处的吸光度值随着时间的变化情况(图2B)。结果显示,在相同时间点下,Ce-BDC浓度越大,652 nm处的吸光度值越大,说明催化剂浓度越大反应速率越大。在0~120 s范围内,652 nm处的吸光度随着时间的逐渐延长而增大,120 s后吸光度基本保持不变,这可能是因为底物TMB随着时间消耗的越来越多,并在120 s时达到平衡。因此选择最佳反应时间为120 s。
2.3.2 温度的优化为了研究温度对Ce-BDC氧化物酶活性的影响,监测了Ce-BDC(90 μg/mL)和TMB (1 mmol/L)混合溶液在不同温度下(20~80 ℃)反应2 min后在652 nm处的吸光度值(图2C)。结果显示,随着反应体系温度的升高,Ce-BDC的氧化物酶活性逐渐增强,当反应温度超过30 ℃时,Ce-BDC的氧化物酶活性开始下降。且在30~50 ℃温度范围内,氧化物酶活性的下降幅度较小,在60~80 ℃温度范围内,氧化物酶活性的下降幅度明显增大,因此选择最适的反应温度为30 ℃。

2.3.3 pH值的优化Ce-BDC的氧化物酶活性和其他基于纳米材料的酶模拟物一样,也受pH值的影响。pH值对Ce-BDC氧化物酶活性的影响可通过Ce-BDC(90 μg/mL)/TMB (1 mmol/L)体系在不同pH值缓冲液孵育2 min所测得的652 nm处的吸光度值来评估(图2D)。结果显示,pH值对Ce-BDC的氧化酶活性的影响较大。当pH值小于3.0时,随着pH值的增大,Ce-BDC的氧化酶活性缓慢上升;当pH值超过3.0时,Ce-BDC的氧化酶活性随着pH值的增大反而下降。因此选择反应体系的pH值为3.0。如无特殊说明,此实验均在最佳反应条件下进行。
2.4 Ce-BDC模拟酶活性的动力学研究
为进一步评估Ce-BDC的模拟氧化物酶活性,实验对其氧化物酶的米氏动力学进行研究(图3)。结果显示,Ce-BDC的酶催化活性遵循稳态动力学规律,经计算得Ce-BDC对底物TMB的Km和Vmax分别为0.393 89 mmol/L和1.8 μm·s-1,Ce-BDC材料表现出较低的Km值,Km越小,表明酶对该底物的亲和能力越大,有利于酶促反应进行。因此Ce-BDC对TMB具有较强亲和力,在代替天然氧化酶应用于食品、生物、医学等领域有着较大研究前景。
在已有研究中,以Ce为活性金属中心的纳米酶材料的氧化活性很有可能基于Ce3+/Ce4+两种价态间的相互转化[15,17]。当TMB显色剂加入反应体系后,TMB被氧化使溶液呈蓝色,Ce4+随后自身被还原为Ce3+,生成的Ce3+又自发被氧化成Ce4+。因而推测Ce-BDC的纳米酶活性可能是来自于Ce3+/Ce4+。

2.5 检测抗坏血酸的标准曲线
基于Ce-BDC的氧化物酶活性建立了检测抗坏血酸的比色方法(图4),结果显示,反应体系在652 nm处的吸光度值(A)随着抗坏血酸浓度(c,mol/L)的增大呈下降趋势,且在1.0~30 μmol/L范围内吸光度与抗坏血酸浓度呈线性关系,线性方程为A=-2.64×104c(mol/L)+0.815 4,相关系数(r2)为0.991 4。当抗坏血酸浓度为30 μmol/L时,体系呈无色(4A插图)且在652 nm处无吸收峰。以3倍信噪比(S/N=3)计算得抗坏血酸的检出限为0.32 μmol/L。
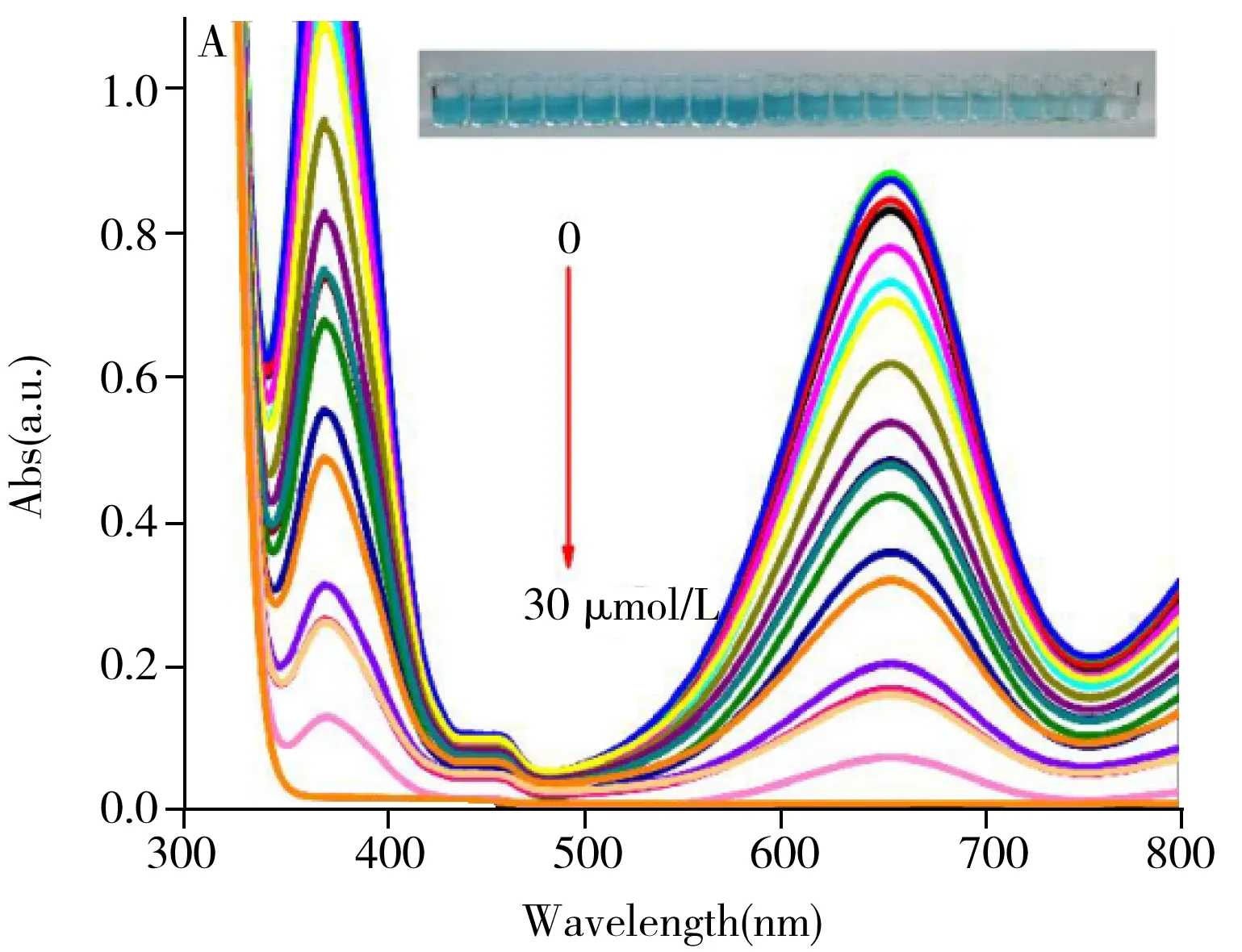

图5 抗坏血酸检测的选择性测试Fig.5 Selective test of ascorbic acid detection
2.6 选择性研究
考虑到果汁样品中可能存在某些物质干扰抗坏血酸的检测,因此选择果汁中的常见离子(K+、Na+、Ni2+、Mn2+、Cu2+、Mg2+、Ca2+、Fe2+)、柠檬酸(CA)、酒石酸(TA)、糖类(果糖、蔗糖)、氨基酸(谷氨酸、天冬氨酸)进行抗干扰实验。于Ce-BDC和TMB的醋酸盐缓冲液(pH 3.0)体系中,分别添加抗坏血酸(20 μmol/L)和其他干扰物质(200 μmol/L),混匀,在室温下孵育2 min后再对其紫外可见光吸收光谱扫描(图5)。结果显示,10倍含量的上述物质基本不干扰抗坏血酸的测定,表明方法对抗坏血酸具有良好的选择性。
2.7 实际样品测定
取市售果汁样品以12 000 r/min离心10 min,去除沉淀,上清液用醋酸盐缓冲液稀释50倍,在反应体系中加入Ce-BDC、TMB以及一系列不同浓度的抗坏血酸标准溶液(0、10、15、20 μmol/L),于室温下孵育2 min,采用紫外分光光度计扫描反应体系在300~800 nm下的吸收光谱,取波长为652 nm处样品溶液的吸光度,每组实验平行3次。结果显示:3个添加水平下抗坏血酸的平均值分别为9.82、15.36、20.22 μmol/L,回收率为98.2%~102%,相对标准偏差(RSD)为1.2%~7.2%。该结果与抗坏血酸试剂盒(MAK074, Sigma)的检测结果(10.01、15.13、19.91 μmol/L)能够较好地吻合,表明方法可用于果汁中抗坏血酸含量的准确测定。
3 结 论
本文以对苯二甲酸(H2BDC)为有机配体,Ce为活性金属中心制备了一种具有氧化物酶活性的Ce-BDC,利用Ce-BDC可以催化显色底物TMB生成氧化反应产物oxTMB,然后抗坏血酸可将oxTMB还原,反应过程中oxTMB的消耗导致溶液在652 nm处吸光度的下降,从而建立了抗坏血酸的比色检测方法。该比色方法具有检测成本低、操作简单、灵敏、迅速、选择性好等优点,为抗坏血酸的检测提供了新方法。
