18F-FDG PET/CT 与PET/MRI 在结直肠癌肝转移诊断中的比较分析
2021-05-27于军张莺任东栋李洋任春玲蔡君
于军 张莺 任东栋 陈 聪 李洋 任春玲 蔡君
1 浙江大学医学院附属第二医院核医学科,杭州 310009; 2 宁波明州医院PET 中心 315100
结直肠癌是最常见的恶性肿瘤之一,复发和转移是其主要的病死原因。肝脏是结直肠癌血行转移的最常见部位,超过一半的患者在其疾病发展过程中会发生肝转移[1-3]。结直肠癌肝转移(colorectal cancer liver metastases,CRCLM)是影响患者预后的重要因素之一,手术是其主要的治疗手段,但只有7%~25%的CRCLM 患者在确诊后可以行根治性切除手术[4-6],大部分患者由于病灶数量、大小和位置等原因无法行根治性手术,只能通过化疗、射频和靶向治疗等手段延长生存期及提高生活质量。目前,CRCLM 患者治疗后的5 年总生存率已提高至35%~50%或以上,而未经治疗的患者5 年生存率低于5%~10%[2-4]。因此,早期准确地诊断CRCLM 并明确转移灶的数量和位置等,对于肿瘤的分期、治疗方案的选择和预后的评估都具有重要的临床意义。CT、MRI 和18F-FDG PET/CT 等均是检测和诊断CRCLM 的重要手段,近年来出现的一体化PET/MRI 亦被广泛关注。目前,关于CRCLM18F-FDG PET/MRI 显像的文献报道较少,笔者回顾性分析27 例结直肠癌患者同日先后行全身18F-FDG PET/CT 显像与上腹部PET/MRI 局部显像的相关资料,评估18F-FDG PET/MRI 显像对CRCLM 的诊断价值,并比较其与PET/CT 的差异。
1 资料与方法
1.1 一般资料
回顾性分析2018 年9 月至2019 年9 月于宁波明州医院PET 中心行全身18F-FDG PET/CT 显像和上腹部18F-FDG PET/MRI 显像并疑似有CRCLM的27 例患者的临床资料,其中男性19 例、女性8 例,年龄28~78(60.6±12.2)岁;未行手术患者11例,已行手术患者16 例。纳入标准:(1)临床资料及影像学资料完整;(2)经组织病理学检查证实为结直肠癌;(3)无其他肿瘤病史或伴有其他部位的原发肿瘤;(4)经组织病理学检查或影像学随访可对肝内病灶做出最终诊断;(5)近期(<3 个月)无肝脏手术、射频消融、化疗等治疗史。反之则为排除标准。所有患者均在行PET/CT 和PET/MRI 前知悉流程及注意事项,并签署了知情同意书。本研究获得宁波明州医院伦理学委员会的批准(批准号:明伦202005001)。
1.2 检查方法
PET/CT 显像仪为德国Siemens 公司Biograph mCT 扫描仪。18F-FDG 由南京江原安迪科正电子研究发展有限公司提供,放射化学纯度>95%。所有患者均禁食6 h 以上,空腹血糖<11.1 mmol/L。患者按体重(3.70~5.55 MBq/kg)静脉注射18F-FDG显像剂,安静平躺休息60 min 后行PET/CT 显像。PET/CT 扫描前饮水500 mL 并排尿,扫描范围从颅顶至股骨中段。CT 扫描参数:管电压120 kV,管电流为自动毫安,螺距0.8,球管单圈螺旋时间为0.5 s,层厚为3.0 mm。CT 重建参数:层厚3.0 mm,层间距2.0 mm。PET 扫描参数:采用三维模式,共扫描7~10 个床位,1.5 min/床位。PET 重建参数:采用有序子集最大期望值迭代法(OSEM)重建图像,2 次迭代,24 个子集,高斯滤波半高宽为4.0 mm,散射校正,利用CT 图像进行衰减校正。将PET 和CT 图像传送到Syngo MMWP 工作站,进行帧对帧图像对位融合。
PET/MRI 显像仪为美国GE 公司Signa PET/MRI(3.0T)扫描仪。PET/MRI 显像在PET/CT 显像后进行,扫描范围自肝脏上缘至肾脏下缘。基于MRI的衰减校正序列与PET 采集同时开始,MRI 扫描序列包括:横断面T1 加权成像(weighted imaging,WI)采用屏气LAVA(可变容积加速肝脏采集)-Flex 序列进行扫描,横断面T2WI 采用呼吸门控Propeller 序列进行扫描,横断面弥散加权成像(diffusion-weighted imaging,DWI)(b值为800 s/mm2和0 s/mm2)采用呼吸门控进行扫描,冠状面T2WI采用T2 单次激发快速自旋回波(SSFSE)进行扫描。PET 采用时间飞行(TOF)及点扩散函数(PSF)技术,选择有序子集最大期望值迭代(OSEM)算法进行图像重建。PET 三维采集与MRI 检查同步进行,以确保PET 和MRI 数据具有最佳的时间和解剖位置配准,采集时长10 min。
分别应用显像仪系统自带的Syngo MMWP 和Advantage 工作站对PET/CT 和PET/MRI 数据进行图像后处理。
1.3 图像分析
PET/CT 图像由2 位具有5 年以上PET/CT 诊断经验的核医学医师采用视觉分析法独立阅片,且不参考PET/MRI 图像。PET/MRI 图像由2 位具有1 年以上PET/MRI 诊断经验的核医学医师采用视觉分析法独立阅片,且不参考PET/CT 图像。为避免回忆偏差,两次阅片时间间隔2 周以上,意见不一致时协商达成一致。PET/CT 的评价标准:(1)当病灶18F-FDG 代谢高于周围肝组织时,无论CT 上病灶呈何种密度均视为阳性;(2)当病灶代谢与周围肝组织差异不明显时,CT 上病灶呈稍低密度,且不符合囊肿和血管瘤典型特征的病灶视为阳性;(3)当病灶代谢低于周围肝组织时,无论CT 上病灶呈何种密度均视为阴性。PET/MRI 的评价标准:(1)当病灶18F-FDG 代谢高于周围肝组织时,无论MRI 上病灶呈何种信号均视为阳性;(2)当病灶代谢与周围肝组织差异不明显时,MRI 上病灶呈T1WI 低信号,T2WI 高信号,DWI呈弥散受限,且不符合囊肿和血管瘤典型特征的病灶视为阳性;(3)当病灶代谢低于周围肝组织时,无论MRI 上病灶呈何种信号均视为阴性。在CT 及MRI 图像上测量并记录病灶长径。每个患者最多测量10 个病灶,若超过10 个病灶,则选择PET/CT 或PET/MRI 图像上能识别的最大10 个病灶。分别基于患者及病灶分析,比较2 种检查方法对CRCLM 的各项诊断效能。并根据CRCLM 病灶的长径,分为长径≤1 cm 组、1 cm<长径≤2 cm 组和长径≥2 cm 组,计算和比较各组的2 种检查方法诊断CRCLM 的灵敏度。
1.4 诊断标准
对所有符合纳入、排除标准的患者,根据其组织病理学检查、现有的检查结果以及随访数据进行综合考虑[7-10],具体的诊断标准:(1)行组织病理学检查的患者以其结果为“金标准”;(2)在PET/CT、PET/MRI 以及另外一种影像学检查方法中[CT 和(或)MRI]均有典型CRCLM 表现者判定为恶性[9];(3)在影像学随访过程中,病灶长径增大(增大>20%[10])、增多者判定为恶性[9-10];(4)在随访期间行化疗或其他治疗的患者,病灶长径缩小(缩小>20%[10])、减少者判定为恶性;(5)在随访间期未行治疗的患者,影像学随访(>3 个月)期间病灶缩小或无明显改变者判定为良性;(6)影像学随访(>3个月)期间肝内均未见任何病灶者判定为良性。本研究中纳入的患者影像学随访时间为97~386 d,均未失访。
1.5 统计学分析
应用SPSS 24.0 软件对数据进行统计学分析。定性资料用率表示,采用McNemar 检验比较18F-FDG PET/CT 与PET/MRI 诊断CRCLM 的灵敏度、特异度和准确率;采用Pearsonχ2检验比较2 种检查方法诊断CRCLM 的阳性预测值和阴性预测值。P<0.05 为差异有统计学意义。
2 结果
2.1 组织病理学检查及影像学随访结果
根据诊断标准可知,27 例结直肠癌患者中,肝转移瘤患者16 例,肝良性病变患者11 例。16 例肝转移瘤患者中,6 例肝内病灶经组织病理学检查确诊,6 例在18F-FDG PET/CT、PET/MRI 和另外一种影像学检查[CT 和(或)MRI]中均有典型肝转移瘤表现,4 例在随访期间(随访时间:126~386 d)显示病灶增多或体积增大。11 例肝良性病变患者在随访期间(97~308 d)肝内病灶均无明显改变(随访期间无肿瘤治疗史)。在27 例结直肠癌患者中,共发现118 个肝内病灶,其中肝转移瘤病灶72个,长径(2.2±1.5) cm;肝良性病灶46 个,长径(0.8±0.6) cm。
2.2 18F-FDG PET/CT 与PET/MRI 对CRCLM 患者诊断效能的比较
由表1 可知,18F-FDG PET/MRI 诊断CRCLM 的灵敏度和准确率均高于PET/CT,但差异均无统计学意义(均P>0.05),二者特异度一致。16 例CRCLM患者中,PET/CT 假阴性3 例,PET/MRI 检出了其中的2 例,病灶长径均<1.0 cm(图1),另外1 例PET/MRI 亦呈假阴性,病灶长径为1.1 cm。该假阴性患者的病灶在PET/CT 中不可见,在PET/MRI中未见18F-FDG 代谢增高,影像学随访结果示病灶明显增大(图2)。
2.3 18F-FDG PET/CT 与PET/MRI 对CRCLM 病灶诊断效能的比较
由表2 可知,18F-FDG PET/MRI 诊断CRCLM的灵敏度、准确率和阴性预测值均高于PET/CT,且差异有统计学意义(均P<0.05)。1 例患者在行PET/CT 检查时,在肝尾状叶见18F-FDG 代谢增高病灶,考虑为肝转移瘤,但PET/MRI 及影像学随访在肝尾状叶均未见异常病灶,考虑肝尾状叶病灶在PET/CT 上呈假阳性(图3)。在16 例CRCLM患者中,与PET/CT 相比,44%(7/16)的患者在PET/MRI 上发现更多肝转移病灶。72 个肝转移病灶中,PET/CT 假阴性病灶27 个,其中长径≤1 cm组的病灶25 个,1 cm<长径≤2 cm 组的病灶2 个;PET/MRI 假阴性病灶11 个,其中长径≤1 cm 组的病灶10 个,1 cm<长径≤2 cm 组的病灶1 个。
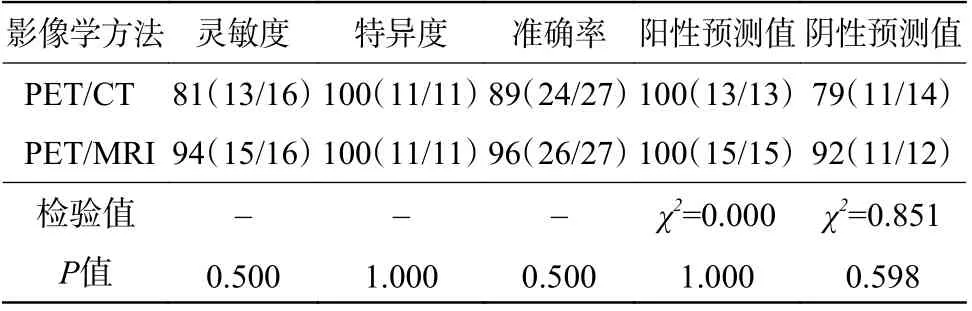
表 1 27 例结直肠癌肝转移患者18F-FDG PET/CT 与PET/MRI诊断效能的比较 (%)Table 1 Comparison of diagnostic efficacy between 18F-FDG PET/CT and PET/MRI in colorectal cancer liver meastases based on 27 patients (%)
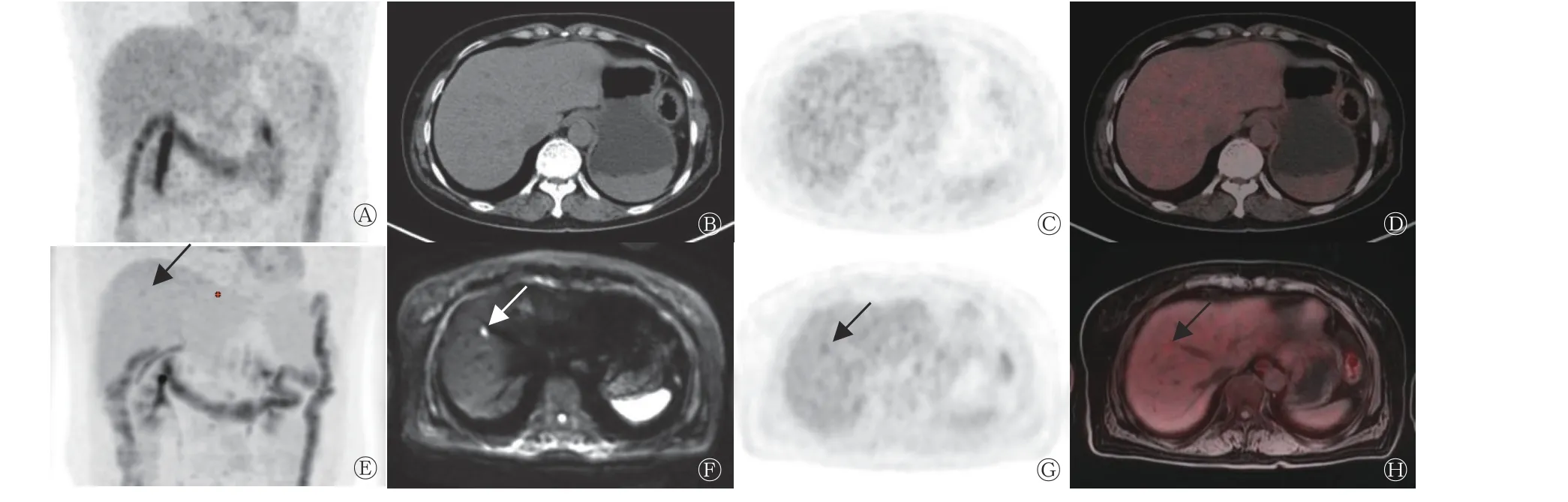
图 1 直肠癌患者(女性,69 岁)肝右前叶转移瘤的18F-FDG PET/CT、PET/MRI 显像图 A 为PET/CT MIP 图,肝脏未见明显18F-FDG代谢增高灶;B 为CT 图,肝内未见明显异常密度灶;C、D 为PET、PET/CT 融合图,肝内未见明显18F-FDG 代谢增高灶;E 为PET/MRI MIP 图,肝内可见18F-FDG 代谢轻度增高灶(箭头所示);F 为DWI 图,肝右前叶上段可见高信号病灶,长径为0.8 cm(箭头所示);G、H 为PET、PET/MRI 融合图,病灶18F-FDG 代谢轻度增高,SUVmax=3.74,考虑为肝转移瘤(箭头所示)。FDG为氟脱氧葡萄糖;PET 为正电子发射断层显像术;CT 为计算机体层摄影术;MRI 为磁共振成像;MIP 为最大密度投影;DWI 为弥散加权成像;SUVmax 为最大标准化摄取值Figure 1 18F-FDG PET/CT and PET/MRI images of metastasis in right anterior lobe of liver in a patient with rectal cancer (female, 69 years old)
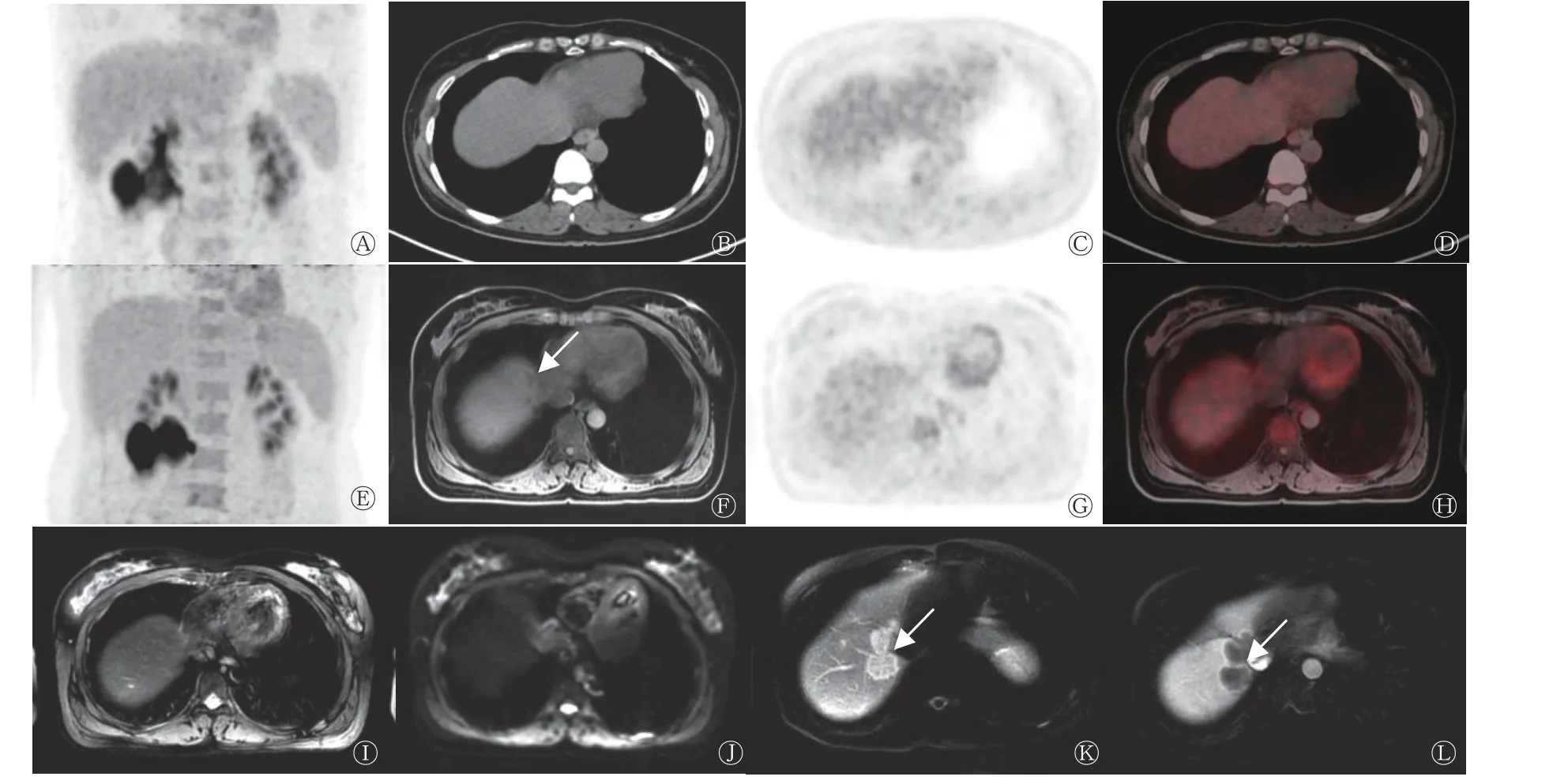
图 2 结肠癌患者(女性,61 岁)肝顶部转移瘤的18F-FDG PET/CT、PET/MRI 显像图 A 为PET/CT MIP 图,肝脏未见明显18F-FDG 代谢增高灶;B 为CT 图,肝内未见明显异常密度灶;C、D 为PET、PET/CT 融合图,肝内未见明显18F-FDG 代谢增高灶;E 为PET/MRI MIP 图,肝脏未见明显18F-FDG 代谢增高灶;F 为T1WI 图,肝顶部可见稍低信号病灶,长径为1.1 cm(箭头所示);G、H 为PET、PET/MRI 融合图,病灶未见18F-FDG 代谢增高;I、J 为T2WI、DWI 图,未见明显异常信号;K、L 为随访增强MRI 图(随访时间267 d),病灶明显增多、体积增大(箭头所示),考虑为肝转移瘤。FDG 为氟脱氧葡萄糖;PET 为正电子发射断层显像术;CT 为计算机体层摄影术;MRI 为磁共振成像;MIP 为最大密度投影;WI 为加权成像;DWI 为弥散加权成像Figure 2 18F-FDG PET/CT and PET/MRI images of metastasis in the top of liver in a patient with colon cancer (female, 61 years old)
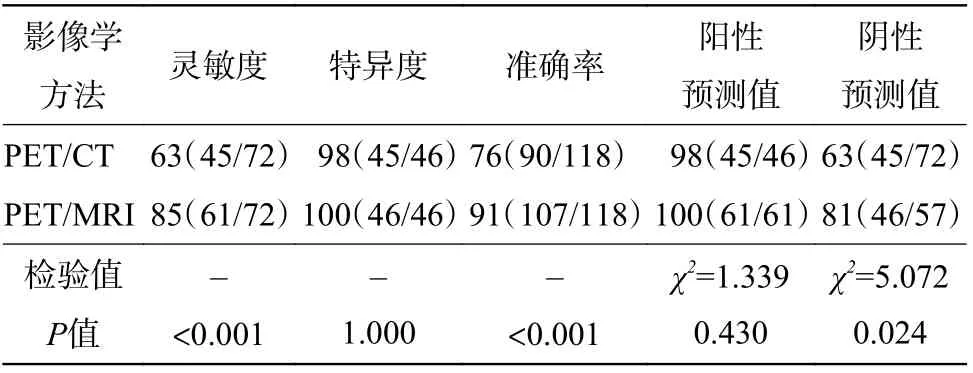
表 2 18F-FDG PET/CT 与PET/MRI 在27 例结直肠癌患者肝转移病灶(72 个)中诊断效能的比较 (%)Table 2 Comparison of diagnostic efficacy between 18F-FDG PET/CT and PET/MRI in colorectal cancer patients(27) liver meastases lesion(72) (%)
2.4 肝转移瘤病灶长径的分组比较
长径≤1 cm 组的病灶27 个,PET/MRI 的诊断灵敏度63%(17/27)高于PET/CT 7%(2/27),且差异有统计学意义(McNemar 检验,P<0.05);1 cm<长径≤2 cm 组的病灶8 个,PET/MRI 的诊断灵敏度88%(7/8)高于PET/CT 75%(6/8),差异无统计学意义(McNemar 检验,P>0.05);长径>2 cm 组的病灶37 个,2 种方法的诊断灵敏度均为100%(37/37)。
3 讨论
结直肠癌是一种常见的消化道恶性肿瘤,其发病与大肠慢性炎症、大肠腺瘤、高脂肪低纤维素饮食等密切相关[11]。结直肠癌起病较为隐匿,早期多无明显临床表现,待出现明显症状时大多已发生转移。肝脏是结直肠癌最主要且最重要的远处转移器官,1/2 以上的结直肠癌患者可出现肝转移,并且肝脏常常是其唯一的远处转移器官[11]。因此,及时、准确地诊断肝转移对患者的临床治疗及预后有重要的意义。
PET/MRI 作为新型的影像学技术,结合了PET的功能影像信息和MRI 较高的软组织分辨率及解剖定位信息,在大大降低辐射剂量的同时提高了对病灶定位及定性的准确率,在肿瘤影像的临床应用中具有良好的前景[12-13]。PET/MRI 和PET/CT 虽然都是功能与形态融合的显像方式,但并不是MRI简单地替代PET/CT 中的CT,2 种设备的PET 图像在数据采集与处理、图像重建和采集时间等方面存在较大差异。
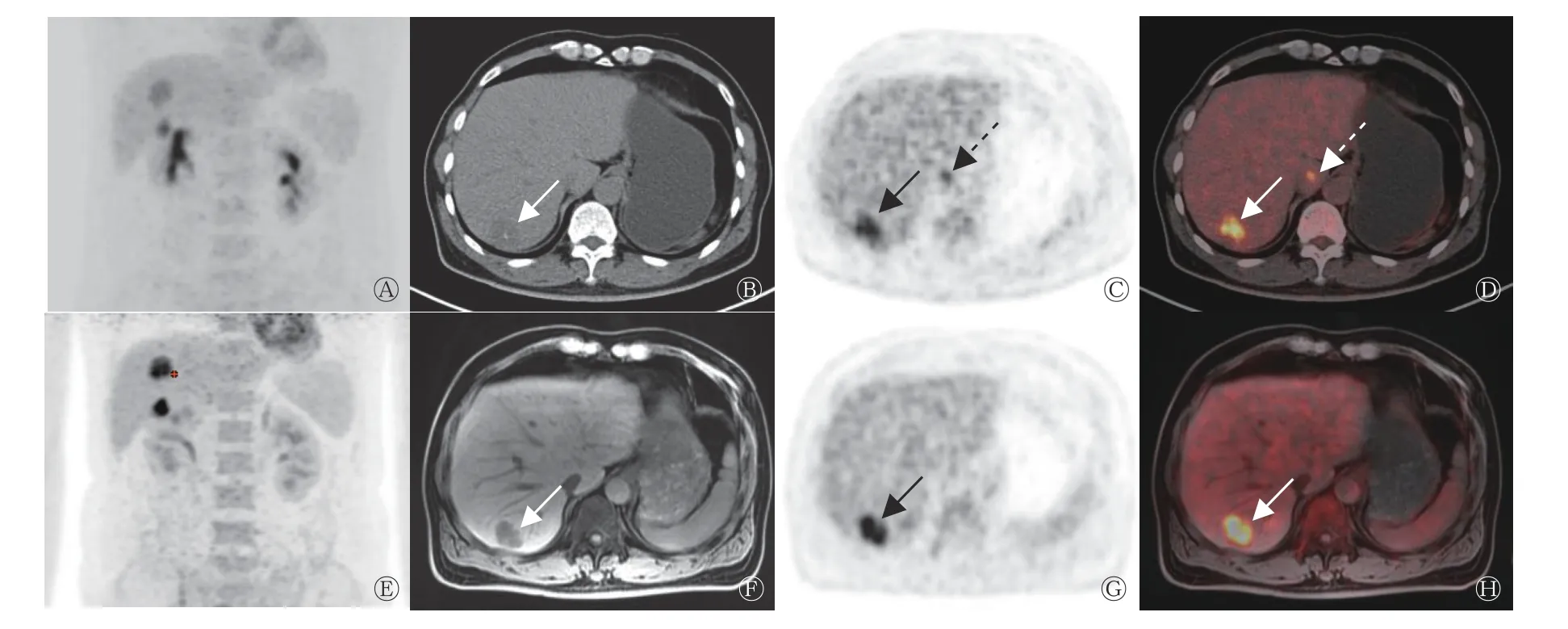
图 3 结肠癌患者(男性,61 岁)肝转移瘤的18F-FDG PET/CT、PET/MRI 显像图 A 为PET/CT MIP 图,肝内可见18F-FDG 代谢增高灶;B 为CT 图,肝右叶可见稍低密度灶,长径为2.8 cm(箭头所示),C、D 为PET、PET/CT 融合图,显示2 个病灶18F-FDG 代谢增高,SUVmax=8.03、5.48,考虑为肝转移瘤(箭头所示),其中肝尾状叶病灶在PET/MRI 及影像学随访中均未见异常,考虑肝尾状叶病灶在PET/CT 上为假阳性病灶(虚箭头所示);E 为PET/MRI MIP 图,肝内可见18F-FDG 代谢增高灶;F 为T1WI 图,肝右叶可见低信号病灶(箭头所示),长径为2.8 cm;G、H 为PET、PET/MRI 融合图,病灶18F-FDG 代谢异常增高,SUVmax=10.41,考虑为肝转移瘤(箭头所示)。FDG 为氟脱氧葡萄糖;PET 为正电子发射断层显像术;CT 为计算机体层摄影术;MRI 为磁共振成像;MIP 为最大密度投影;SUVmax 为最大标准化摄取值;WI 为加权成像Figure 3 18F-FDG PET/CT and PET/MRI images of liver metastases in a patient with colon cancer (male, 61 years old)
18F-FDG PET/CT 与PET/MRI 对CRCLM 的诊断效能各文献报道不一。Maffione 等[14]的一项包括18 篇文献1059 例患者的Meta 分析结果显示,PET和PET/CT 对CRCLM 患者诊断的灵敏度为93%,高于本研究的结果,其原因可能是PET/MRI 可检出较多的肝脏小转移灶,而这些病灶在PET/CT 上多呈假阴性。Lee 等[9]对55 例结直肠癌患者的研究结果显示,PET/MRI 对CRCLM 患者诊断的灵敏度为85%,对CRCLM 病灶诊断的灵敏度为88%~89%,与本研究结果较为一致。Brendle 等[15]对15例结直肠癌患者的研究结果显示,PET/MRI 诊断CRCLM 病灶的灵敏度为71%、准确率为74%,低于本研究结果,其原因可能是在他们的研究中,黏液性肿瘤比例较多(38.2%)。Berger 等[16]的研究结果显示,黏液性肿瘤对18F-FDG 的摄取较低,PET只能发现59%的黏液性肿瘤,同时黏液性肿瘤与实体肿瘤相比只有轻微的弥散受限[15,17],从而影响病灶的检出。
在有关肝转移瘤PET/MRI 与PET/CT 的对比研究中,Donati 等[18]对37 例患者的研究结果显示,PET/MRI 与PET/CT 诊断肝转移病灶的灵敏度分别为93%和76%,准确率分别为92%~96%和85%。Beiderwellen 等[19]对32 例患者的研究结果显示,PET/MRI 与PET/CT 诊断肝转移病灶的灵敏度分别为92.2%和67.8%、准确率分别为96.1%和82.4%,均高于本研究结果。其可能原因:(1)本研究中,小的肝转移病灶较多,其中≤1 cm 的病灶占37.5%(27/72);而在Donati 等[18]的研究中,≤1 cm的肝转移病灶仅占18.2%(10/55)。Hong 等[20]的一项Meta 分析结果显示,PET/CT 与PET/MRI 对长径≤1 cm 的肝转移病灶的诊断灵敏度分别为29%~30%和44%~71%,均显著低于对长径>1 cm 的诊断灵敏度(87%~89%和50%~98%),本研究亦得出类似的结果。(2)本研究中的PET/CT 和PET/MRI均使用平扫CT 和平扫MRI;而在Donati 等[18]的研究中,MRI 显像使用的是肝胆特异性对比增强剂(Gd-EOB-DTPA),Beiderwellen 等[19]的研究使用的是增强CT。既往研究结果显示,增强CT 和增强MRI(Gd-EOB-DTPA)均有助于提高对肝转移的诊断灵敏度和准确率[21-22]。(3)在Donati 等[18]和Beiderwellen 等[19]的研究中,原发肿瘤并非都是结直肠癌,而肝转移灶的18F-FDG 摄取与原发肿瘤病理类型密切相关。
本研究及其他一些学者的研究结果均显示,PET/MRI 诊断肝转移病灶的灵敏度和准确率均显著高于PET/CT,尤其是在长径≤1 cm 的病灶中,并且PET/MRI 在显示病灶的清晰度和诊断置信度等方面均优于PET/CT[15,18-20]。其可能原因:(1)MRI具有较高的软组织分辨率,可综合不同序列进行分析,能较好地显示肝脏的解剖细节,小的转移灶在MRI 图像上即可呈现异常信号。(2)MRI 中的DWI 是目前唯一能够从分子水平检测活体组织内水分子扩散运动的无创检测方法。当组织发生病变时,其细胞功能和代谢发生变化,水分子扩散运动受限,在DWI 序列上呈高信号,有助于早期准确地检测出肝内小的转移病灶[22]。(3)PET/MRI 为同步采集,不受呼吸运动的影响,因此提高了PET图像与MRI 图像的融合配准,有助于肝顶部病灶的检出。(4)PET/MRI 的PET 采集时间(10 min)长于PET/CT(1.5 min),采集时间越长,图像质量越好,从而有利于肝转移灶的检出。
18F-FDG 并非肿瘤特异性显像剂,当合并炎症和感染时均可出现18F-FDG 代谢增高,从而造成假阳性结果。由于肝脏可生理性摄取18F-FDG,因此体积较小、摄取18F-FDG 不明显的病灶易造成假阴性结果。另外,部分恶性程度较低或一些特殊病理类型的CRCLM 病灶(如黏液腺癌、印戒细胞癌)对18F-FDG 的摄取量有限[16,23],亦可造成假阴性结果。本研究中,大部分假阴性病灶的长径均≤1 cm,PET/MRI 显像中仅有1 个假阴性病灶的长径>1 cm,18F-FDG 代谢均未见增高,这可能与病灶的病理类型或乏血供有关。因此在临床工作中,不能仅依靠病灶代谢的高低来判断其性质,应结合CT 和MRI图像中病灶的形态、临床特点、实验室检查和其他影像学检查结果综合考虑,以减少假阳性率和假阴性率。
本研究仍存在许多局限性:(1)本研究为回顾性研究,存在一定程度的选择偏倚,可能会遗漏一些假阴性或假阳性病例;(2)部分病例通过影像学随访而非组织病理学检查结果诊断,部分小的病灶可能通过现有的影像学检查方法无法检出,因此PET/CT 和PET/MRI 诊断CRCLM 实际的灵敏度可能低于本研究结果;(3)病例数量有限,得出的结果可能存在偏差,需要更大样本做进一步研究;(4)没有对肝外转移情况进行比较,PET/MRI 扫描局限于上腹部,重点比较了2 种检查方法在肝转移中的差异,但全身显像是PET/CT 检查的一个重要优势,通过PET/CT 了解患者全身情况仍非常必要。
综上所述,与PET/CT 相比,PET/MRI 对CRCLM 病灶的检出及定性具有明显优势,尤其是在长径≤1 cm 的病灶中,有助于临床早期准确诊断CRCLM 并更好地指导患者的临床治疗。未来仍需大样本前瞻性研究进一步证实PET/MRI 的临床应用价值。
利益冲突本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明于军负责研究命题的提出与设计、数据的收集与分析、论文的撰写;张莺、陈聪负责研究命题的提出与设计、论文的审阅;任东栋负责研究命题的设计、数据的收集与分析、论文的审阅;李洋、任春玲负责数据的获取与分析;蔡君负责图像的处理。
