2019年四川省部分地区猪繁殖与呼吸综合征病毒ORF5基因的遗传变异分析
2021-05-26孔军朱国坡康斌武玉梅李少丽邵攀峰尹忠良
孔军 朱国坡 康斌 武玉梅 李少丽 邵攀峰 尹忠良


摘要:为了解2019年四川省猪繁殖与呼吸综合征病毒(PRRSV)ORF5基因的遗传变异情况,采用RT-PCR方法对来自该省部分地区猪场的36份疑似PRRS猪的组织样品进行PRRSV ORF5基因测序,并对所获得的基因序列进行了生物信息学分析。结果显示,成功扩增出14条PRRSV ORF5基因片段。同源性分析显示,14条PRRSV ORF5基因序列均为基因Ⅱ型毒株,分属于1、3、8这3个不同的谱系,以NADC30为代表的谱系1和以QYYZ为代表的谱系3各5株,以JXA1为代表的谱系8毒株4株,各毒株间核苷酸和推导氨基酸的同源性分别为78.5%~100.0%、78.0%~100.0%。氨基酸序列分析结果显示,14个毒株GP5蛋白上3个主要的抗原表位上均存在广泛的变异,同时谱系1和谱系3毒株与毒力相关的位点也发生了不同程度的突变,这些突变可能影响病毒毒力及有助于病毒逃避机体的免疫系统。结果表明,2019年四川省PRRSV呈多亚型毒株同时流行的复杂局面,有必要对PRRSV的流行和变异情况进行实时监测,以此选择更为合适的疫苗毒株及免疫程序,结合严格的生物安全措施,从而达到科学防控PRRS的效果。
关键词:猪繁殖与呼吸综合征病毒;ORF5基因;遗传变异
中图分类号: S858.285.3文献标志码: A
文章编号:1002-1302(2021)08-0068-05
收稿日期:2021-01-18
基金项目:浙江省重点研发计划(编号:2020C02011)
作者简介:孔 军(1974—),女,山西襄汾人,高级兽医师,主要从事动物疫病防控工作。E-mail:guobo916@163.com。
通信作者:康 斌,高级兽医师,主要从事动物疫苗开发。E-mail:kangb@jinheuben.com。
猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)是一种可引起以母猪繁殖系统疾病(流产、产死胎、木乃伊胎等)和各年龄猪的呼吸系统疾病为特征的重大动物传染性病原。由PRRSV引起的疾病称作猪繁殖与呼吸综合征(porcine reproductive and respiratory syndrome,PRRS),该病于20世纪80年代在欧美首次报道[1-2],随后短短数年在世界范围内广泛传播,给养猪业造成了巨大的经济损失。
PRRSV全基因组长度约15 kb,至少包含ORF1a、ORF1b、ORF2a、ORF2b、ORF3~ORF7,以及ORF5a等10个开放阅读框(Open Reading Frame,ORF)。其中,ORF1a和ORF1b编码PRRSV的非结构蛋白(non-structural protein,NSP)NSP1α、NSP1β、NSP2~NSP6、NSP7α、NSP7β、NSP8~NSP12,ORF2a、ORF2b、ORF3~ORF7分别编码病毒的结构蛋白GP2、E、GP3、GP4、GP5、GP5a、M和N等[3-4]。NSP2和GP5分别是PRRSV易于变异的非结构蛋白和结构蛋白,常被用于开展病毒的流行病学调查与遗传演化分析。
根据来源,PRRSV可分为欧洲型(基因Ⅰ型)和北美型(基因Ⅱ型),它们的代表毒株分别为Lelystad Virus(LV)和VR-2332,2个基因型间的核苷酸同源性约60%,但引起的临床症状相似[5]。Shi等根据ORF5基因将北美型PRRSV进一步分为9个谱系(Lineage)[6]。我国的北美型PRRSV流行毒株包括4个谱系,即谱系1(代表毒株NADC30)、谱系3(代表毒株QYYZ)、谱系5(代表毒株VR-2332)和谱系8(代表毒株JXA1)[7-8]。
1996年,我国首次报道并分离到PRRSV CH-1a毒株[9]。2006年,高致病性PRRSV(HP-PRRSV)在我国开始出现,引起发病猪持续高热、高发病率和高死亡率[10],该病迅速传遍全国,给我国养猪业造成了沉重打击。研究表明,与CH-1a毒株相比,HP-PRRSV以NSP2不连续缺失了30个氨基酸为特征[11-12]。2012年前后,以NSP2不连续缺失131个氨基酸為特征的新PRRSV毒株开始在我国出现,该毒株与美国NADC30具有相同的基因缺失模式,我国学者称之为类NADC30毒株(NADC30-like)[13],NADC30-like易与其他类型的PRRSV毒株发生重组变异,造成疫苗免疫失败,引起新的PRRS发病。当前,NADC30-like已成为我国一些地区优势流行毒株[8]。
本研究对2019年四川省部分地区PRRS疫苗免疫猪场采集的疑似PRRS发病猪的病变组织进行PRRSV ORF5基因的扩增和测序,并将所获得毒株的ORF5基因序列与参考毒株序列进行比对和遗传变异分析,为该省的PRRS防控提供参考依据。
1 材料与方法
1.1 材料
1.1.1 病料样品 来自2019年四川省广安、内江、眉山、雅安、广元、达州、绵阳等地疑似发生PRRS(伴有发热、呼吸系统症状、妊娠母猪流产等现象)猪的肺脏、淋巴结、流产胎儿等组织样品,共36份,-80 ℃保存备用。
1.1.2 载体、感受态细胞 pMD18-T载体、DH5α感受态细胞均购自宝生物工程(大连)有限公司。
1.1.3 主要试剂 病毒RNA/DNA提取试剂盒、1st Strand cDNA合成试剂盒、DL-2000 Marker、Ex Taq酶,均购自宝生物工程(大连)有限公司;DNA纯化回收试剂盒,购自天根生化科技(北京)有限公司。
1.2 方法
1.2.1 引物的设计与合成 依据GenBank中发布的PRRSV VR-2332(U87392)、NADC30(JN654459)、JXA1(EF112445)等毒株的基因序列,并参照周峰的方法[13],利用Primer Premier 5.0软件设计了1对用于扩增ORF5基因的特异性引物,由生工生物工程(上海)股份有限公司合成。GP5-F:5′-GTGTCAGGCATTGTGGCTGTG-3′;GP5-R:5′-CATTATTGGCGTGTAGGTKATRGAAAA-3′;预扩增片段大小约为864 bp。
1.2.2 总RNA的提取及cDNA合成
将预先称质量的组织样品剪碎、研磨,加入2倍组织质量的无菌PBS溶液,振荡混匀,-80 ℃反复冻融3次,4 ℃、3 500 r/min 离心10 min,取上清备用。按照病毒RNA/DNA提取试剂盒的方法对组织上清进行总RNA的提取。
以总RNA为模板,采用1st Strand cDNA试剂盒制备cDNA。在反应管中配制以下试剂(20.00 μL):Random 6 mers 1.00 μL,dNTP Mixture 1.00 μL,RNase Free H2O 4.00 μL,模板4.00 μL;65 ℃保温5 min,冰上冷却;向管中再加入5×PrimeScript Ⅱ Buffer 4.00 μL,RNase Inhibitor 0.52 μL,PrimeScriptⅡRTase 1.00 μL,RNase Free H2O 4.48 μL;缓慢混匀,30 ℃ 10 min,45 ℃ 60 min,70 ℃ 15 min,冰上冷却,即为cDNA模板,-20 ℃ 保存备用。
1.2.3 ORF5基因的RT-PCR扩增
以cDNA为模板,利用GP5-F/GP5-R引物扩增ORF5基因。反应体系如下(30.00 μL):ddH2O 18.96 μL,10×Ex Taq buffer 3.00 μL,dNTP Mix 2.40 μL,GP5F 120 μL,GP5R 1.20 μL,Ex Taq 0.24μL,cDNA 300 μL。PCR反应程序:95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 10 min。取扩增产物5.00 μL采用1.5%琼脂糖凝胶电泳,并观察结果。
1.2.4 ORF5基因PCR产物的回收、克隆和测序
应用通用型DNA纯化回收试剂盒对ORF5基因阳性样品的PCR扩增产物进行纯化回收,并将回收的DNA片段连接在pMD18-T载体上,转化入DH5α感受态细胞中。采用GP5-F/GP5-R引物对重组质粒进行PCR鉴定,将阳性质粒的菌液送至生工生物工程(上海)股份有限公司进行ORF5基因测序。
1.2.5 PRRSV ORF5基因序列的比对与分析
应用DNA Star7.1软件中的MegAlign对所获得的PRRSV毒株和GenBank中部分代表毒株的ORF5基因序列进行同源型和推导氨基酸的同源型分析,并对毒株的推导氨基酸进行遗传变异分析。应用MEGA 6.06软件的ClustalW对所获得的PRRSV毒株的ORF5基因核苷酸序列进行比对,并应用Neighbor-Joining法(Bootstrap=1 000)对其进行遗传演化分析。
2 结果与分析
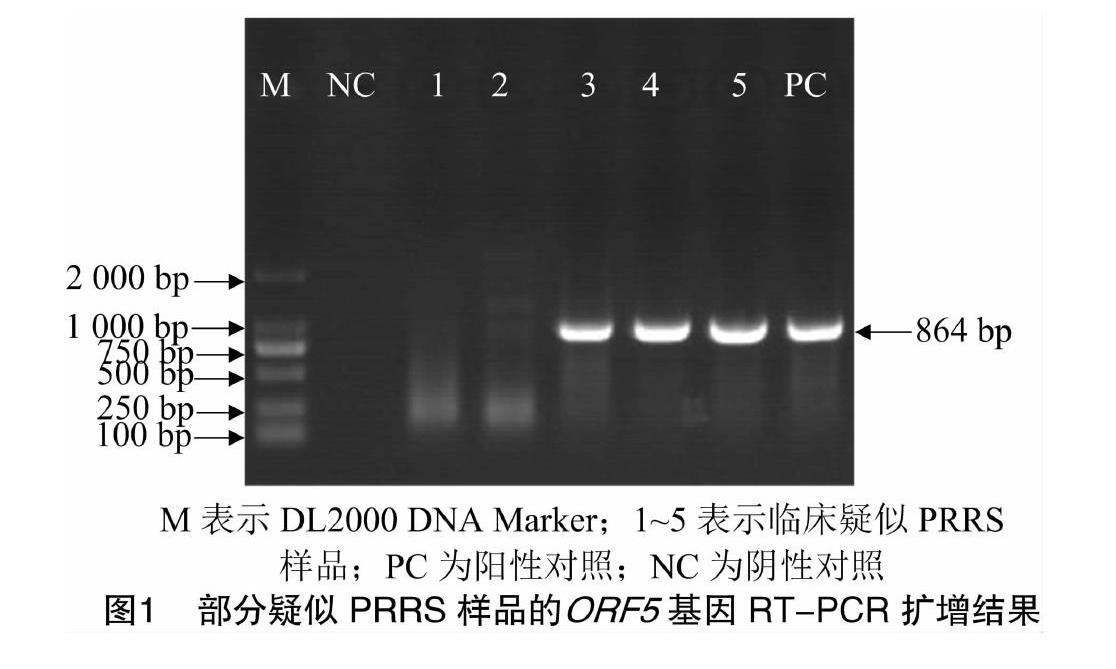
2.1 临床疑似PRRS样品ORF5基因的RT-PCR扩增结果
用RT-PCR方法对36份疑似PRRS发病猪组织样品进行了ORF5基因检测,阳性样品14份,琼脂糖凝胶电泳显示扩增条带大小与预期结果相符,部分样品ORF5基因的扩增结果见图1。
2.2 ORF5基因遗传进化分析
将14个阳性样品ORF5基因与GenBank中发布的国内外部分代表毒株的ORF5基因核苷酸序列进行比对,并构建系统进化树,由图2可知,全部14个毒株均属基因Ⅱ型。其中,5个毒株(SCms0501、SCms0801、SCms0802、SCga0401、SCya0301)属于以NADC30为代表的谱系1(占35.7%),5个毒株(SCgy0701、SCmy1101、SCdz1002、SCnj0901、SCya0302)属于以QYYZ为代表的谱系3(占357%),4个毒株(SCdz0301、SCdz0302、SCdz1001、SCmy1102)属于以JXA1为代表的谱系8(占286%)。本研究中未检测到以VR-2332为代表的谱系5毒株。
2.3 ORF5基因同源性分析
试验所获得的14个PRRSV毒株中的13个毒株ORF5序列全长为603 bp,编码200个氨基酸,1个毒株(SCya0301)ORF5序列全长为600 bp,编码199个氨基酸。14个毒株之间的核苷酸和推导氨基酸的同源性分别为78.5%~100.0%、78.0%~100.0%。依据系统进化树对所获得毒株ORF5基因进行分类比对分析,由图3、图4可知,谱系1的5个毒株与其代表毒株NADC30的核苷酸和推导氨基酸同源性分别为92.0%~94.2%、91.5%~945%,谱系3的5个毒株与其代表毒株QYYZ的核苷酸和推导氨基酸同源性分别为90.5%~942%、90.5%~94.0%,谱系8的4个毒株与其代表毒株JXA1的核苷酸和推导氨基酸同源性分别为97.3%~99.2%、97.5%~98.5%。
2.4 ORF5基因推導氨基酸的遗传变异分析
据报道,北美型PRRSV GP5蛋白上含有3个重要的抗原表位,1个中和表位(B表位,aa37~45),2个非中和表位:aa27~30(A表位)和aa180~197(C端抗原表位)[14],这些表位存在于蛋白的高变区中[15]。本研究通过对所获得的14个毒株与代表毒株的氨基酸序列比对分析,由图5、图6可知,各毒株GP5蛋白的3个表位均存在不同程度氨基酸突变。在非中和表位A区域,氨基酸突变更为明显,与 VR-2332 相比,谱系1的所有毒株均发生了V27A、A29V突变,谱系8的所有毒株均发生了A29V的突变,谱系3的各毒株之间仅有第28位氨基酸相同,为L28,其他氨基酸位点在毒株之间有较大变异。在B表位区域,各谱系毒株存在各自特征性氨基酸,其中L39为谱系1毒株的特征性氨基酸,Y38和S39为谱系3毒株的特征性氨基酸,I39为谱系8毒株的特征性氨基酸。
GP5蛋白上R13和R151氨基酸與PRRSV的毒力有关[16],它们的改变可能会导致病毒毒力的减弱[15]。与VR-2332相比,本研究的6个毒株发生了R13Q突变,7个毒株发生了R151K的突变,1个毒株发生了R151Q的突变,1个毒株发生了R151N的突变,其中谱系1的4个毒株的2个位点均发生了突变。
本研究中毒株YNrl-03-1 GP5蛋白中和表位B存在1个氨基酸的缺失(aa37),该缺失对宿主中和抗体生成的影响有待进一步研究。
3 讨论
1996年,我国首次分离到PRRSV CH-1a毒株后,猪繁殖与呼吸综合征长期困扰着我国养猪业的健康发展。由于PRRSV的RNA依赖性RNA聚合酶(RNA-dependent RNA polymerase,RdRP)缺乏 3′-5′ 校正功能的复制特性,及准种、重组等原因,我国的PRRSV毒株表现为多样性。
我国的北美型PRRSV主要包含4个谱系,在谱系1 NADC30-like毒株出现以前,谱系8的HP-PRRSV是我国田间的优势流行毒株。NADC30-like毒株极易与田间野毒或疫苗毒发生重组变异,该毒株出现后短短几年就成为我国某些地区的优势流行毒株[8,17-18]。QYYZ类毒株,及由MLV RespPRRS/Repro疫苗毒和野毒重组的GM2毒株[20],具有高致病性特点,是最早在我国南方地区出现的PRRSV变异株,与经典PRRSV、HP-PRRSV和NADC30-like PRRSV毒株的遗传距离比较远,处于进化树的独立分支上(谱系3)。本研究共获得了14个PRRSV分离株,其中,谱系1(5个)、谱系3(5个)、谱系8(4个),各谱系毒株的检出数无明显差别。值得注意的是,与之前相比谱系3毒株(以QYYZ为代表)检出率有增多趋势,需要持续加强监测[15,20]。本研究在某集团猪场的不同分场检测到相同的PRRSV毒株(SCms0501、SCms0801、SCms0802),推测可能是由猪的调运引起,提示集团猪场内部调猪时进行必要的隔离检疫、消杀等生物安全防控措施的重要性。
GP5蛋白是宿主主要的保护性抗原,存在主要的抗原表位(A表位、B表位和C端抗原表位),这些抗原表位均存在于不同的基因高变区中。GP5蛋白氨基酸序列的任何改变就可能影响病毒的感染性和疫苗的交叉保护率,甚至引起免疫失败[21-23]。在病毒感染的早期,A表位起主导作用,可抑制B表位被免疫系统识别,推迟中和抗体的产生,进而有助于病毒逃避免疫系统[24]。通过对所获得毒株的氨基酸序列比对分析发现,14个毒株GP5蛋白主要抗原表位均发生了较多的氨基酸突变,这些突变可能影响了PRRSV的免疫原性,引起已免疫PRRS疫苗的稳定场再次发病。与毒力相关R13和R151位点上,谱系8的所有毒株具有此氨基酸特征,均为R,但谱系1和谱系3的所有毒株的2个毒力相关位点均发生了不同程度突变,推测这些关键位点的突变可能是当前流行毒株毒力低于HP-PRRSV毒力的主要原因。
在非洲猪瘟疫情影响下,我国养猪企业加强了生物安全和综合性防控措施,PRRS在我国的流行和发生比较平稳,甚至呈下降趋势[17]。但在猪场急于补栏、引种调运,生物安全防范措施执行不到位的情况下,猪场时有PRRS疫情的发生。本研究结果表明,2019年四川省PRRSV毒株流行情况非常复杂,以JXA1为代表的HP-PRRSV不再是该省的优势流行毒株,与2018年的报道[15]有一定出入,也许是由组织样品的选取差异造成,研究中NADC30-like和类QYYZ变异株检出率明显增加,形成了谱系1、3、8 PRRSV共同流行的局面。据报道,商品化疫苗对谱系1和3毒株的保护效果有限,疫苗免疫的猪场存在再发PRRS疫情的现象[25]。因此,有必要对该省PRRSV毒株的流行和变异情况进行持续监测,以此选择更为合适的疫苗毒株及免疫程序,同时在引种、调运时执行严格的生物安全措施,从而达到科学防控PRRS效果。
参考文献:
[1]Goyal S M. Porcine reproductive and respiratory syndrome[J]. Journal of Veterinary Diagnostic Investigation,1993,5(4):656-664.
[2]Wensvoort G,Terpstra C,Pol J M,et al. Mystery swine disease in the netherlands the isolation of lelystadvirus[J]. Veterinary Quarterly,1991,13(3):121-130.
[3]Johnson C R,Griggs T F,Gnanandarajah J,et al. Novel structural protein in porcine reproductive and respiratory syndrome virus encoded by an alternative ORF5 present in all arteriviruses[J]. Journal of General Virology,2011,92(5):1107-1116.
[4]Beerens N,Selisko B,Ricagno S,et al. De novo initiation of RNA synthesis by the arterivirus RNA-dependent RNA polymerase[J]. Journal of Virology,2007,81(16):8384-8395.
[5]Forsberg R. Divergence time of porcine reproductive and respiratory syndrome virus subtypes[J]. Molecular Biology and Evolution,2005,22(11):2131-2134.
[6]Shi M,Lam T T,Hon C C,et al. Molecular epidemiology of PRRSV:a phylogenetic perspective[J]. Virus Research,2010,154(1/2):7-17.
[7]曲向阳,孙英军,张洪亮,等. 2014—2017年山东省部分规模化猪场PRRSV ORF5基因的遗传演化分析[J]. 中国兽医杂志,2018,54(9):12-15,18.
[8]杨汉春,周 磊. 猪繁殖与呼吸综合征病毒的遗传变异与演化[J]. 生命科学,2016,28(3):325-336.
[9]郭宝清,陈章水,刘文兴,等. 从疑似PRRS流产胎儿分离PRRSV的研究[J]. 中国畜禽传染病,1996(2):3-7.
[10]童光志,周艳君,郝晓芳,等. 高致病性猪繁殖与呼吸综合征病毒的分离鉴定及其分子流行病学分析[J]. 中国预防兽医学报,2007,29(5):323-327.
[11]Li Y,Zhou L,Zhang J,et al. Nsp9 and Nsp10 contribute to the fatal virulence of highly pathogenic porcine reproductive and respiratory syndrome virus emerging in China[J]. PLoS Pathogens,2014,10(7):e1004216.
[12]Nelsen C J,Murtaugh M P,Faaberg K S. Porcine reproductive and respiratory syndrome virus comparison:divergent evolution on two continents[J]. Journal of Virology,1999,73(1):270-280.
[13]周 峰. 2012—2013年河南地区猪繁殖与呼吸综合征病毒分子流行病学调查及河南流行株的分离、鉴定[D]. 郑州:河南农业大学,2014.
[14]Keyk F,Haqshenas G,Guenette D K,et al. Genetic variation and phylogenetic analyses of the ORF5 gene of acute porcine respiratory and reproductive syndrome virus isolates[J]. Vet microbial,2001,83(3):249-263.
[15]刘瀚扬,张 毅,肖 冉,等. 2018年四川地区猪繁殖与呼吸综合征病毒ORF5基因的分子流行病学调查研究[J]. 中国畜牧兽医,2020,47(4):1172-1182.
[16]Allende R,Kutish G F,Laegreid W,et al. Mutations in the genome of porcine reproductive and respiratory syndrome virus responsible for the attenuation phenotype[J]. Archives of Virology,2000,145(6):1149-1161.
[17]楊汉春,周 磊,高元元,等. 2019年猪病流行情况与2020年流行趋势及防控对策[J]. 猪业科学,2020,37(2):52-54.
[18]朱国坡,马凤龙,王家福,等. 2016—2018年我国华北部分地区猪繁殖与呼吸综合征病毒ORF5基因的遗传变异分析[J]. 黑龙江畜牧兽医:上半月,2020(6):96-100.
[19]Lu W H,Wei Z Y,Zhang G Q,et al. Complete genome sequence of a novel variant porcine reproductive and respiratory syndrome virus (PRRSV) strain:evidence for recombination between vaccine and wild-type PRRSV strains[J]. Journal of Virology,2012,86(17):9543.
[20]Lu W H,Tun H M,Sun B L,et al. Re-emerging of porcine respiratory and reproductive syndrome virus (lineage 3) and increased pathogenicity after genomic recombination with vaccine variant[J]. Veterinary Microbiology,2015,175(2/3/4):332-340.
[21]Zhang Q,Xu X,You S,et al. Emerging of two new subgenotypes of porcine reproductive and respiratory syndrome viruses in Southeast China[J]. Microbial Pathogenesis,2016,97:27-33.
[22]赵 蕾,吴发兴,张 锋,等. 2015年、2016年我国部分地区猪群猪繁殖与呼吸综合征的分子流行病学研究[J]. 黑龙江畜牧兽医,2018(5):96-100,244.
[23]王雅婷,柴 娟,张红丽,等. 浙江省猪繁殖与呼吸综合征病毒ORF5基因的遗传变异分析[J]. 中国畜牧兽医,2019,46(12):3715-3724.
[24]Ostrowski M,Galeota J A,Jar A M,et al. Identification of neutralizing and nonneutralizing epitopes in the porcine reproductive and respiratory syndrome virus GP5 ectodomain[J]. Journal of Virology,2002,76(9):4241-4250.
[25]徐晓杰,张乔亚,谈 晨,等. 2015—2016年我国部分地区猪繁殖与呼吸综合征的分子流行病学调查[J]. 畜牧与兽医,2017,49(6):153-156.
