前列腺影像报告和数据系统2.1版联合临床指标对前列腺癌的诊断价值
2021-05-26魏晓婷钟淑媛胡根文邹锦森丁志广徐坚民
魏晓婷,钟淑媛,胡根文,邹锦森,丁志广,徐坚民
暨南大学第二临床医学院,深圳市人民医院放射科,广东深圳 518000; *通讯作者 徐坚民 13600163204@163.com
近年我国前列腺癌(prostate cancer,PCa)的发病率明显上升[1],且患者确诊时多已发展至中晚期,预后较差[2]。早期诊断和治疗是降低PCa 病死率、改善患者预后的关键。前列腺特异性抗原(prostatespecific antigen,PSA)是PCa 的主要筛查指标之一,但其特异性较差[3]。PCa 多通过前列腺穿刺获得病理标本确诊[4],但前列腺穿刺为有创性检查,可引起血尿、泌尿系统感染等并发症。
多参数MRI 是目前诊断前列腺较好的影像学检查[5]。全球多通过前列腺影像报告和数据系统(prostate imaging reporting and data system,PIRADS)评估前列腺病灶,以判断病灶为PCa 的可能性,得分越高,危险性越大,但对于PI-RADS 指导穿刺的截断值,目前尚未达成共识[6],若以4 分为穿刺截断值,会导致部分漏诊;而以3 分为截断值,则可能导致较多患者接受不必要的穿刺[7]。
如何更好地预测PCa 穿刺阳性结果,避免过度诊治带来不必要的损伤值得进一步探讨。本研究拟将PI-RADS v2.1 评分与PSA 衍生指标结合,以提高对PCa 的诊断效能,协助临床做出合理的穿刺决策。
1 资料与方法
1.1 研究对象 收集2018年1月—2019年4月因尿频、排尿障碍及尿储留等症状就诊于深圳市人民医院,并行首次前列腺穿刺活检术的患者180例,其中良性前列腺增生(benign prostate hyperplasia,BPH)111例,PCa 69例。收集患者的年龄、PSA、游离PSA/总PSA(fPSA/tPSA)。纳入标准:①术前于我院行3.0T MRI 检查,临床资料和影像学资料齐全;②行MRI 检查前未接受过内分泌治疗、放疗及手术治疗等;③前列腺MRI 检查时间与穿刺活检术、手术切除术时间间隔<3 个月。
1.2 仪器与方法 采用Siemens 3.0T Skyra 超高场强MR 扫描仪,使用18 通道体部矩阵线圈,嘱患者少量留尿,以耻骨联合上方约1 cm 处为中心进行扫描,扫描范围至少包括前列腺及精囊。T2WI 序列(包括横断位、矢状位、冠状位):采用快速自旋回波序列,TR 6100 ms,TE 101 ms,层厚3.5 mm,层间距0 mm,矩阵320×320,FOV 200 mm×200 mm,扫描层数20 层。
DWI 采用单次激发自旋回波平面回波成像序列:TR 4200 ms,TE 74 ms,层厚3.5 mm,层间距0 mm,矩阵140×140,FOV 200 mm×200 mm,并排采集加速 因子=2,相位编码方向为前后方向,扫描层数20 层,扩散敏感梯度场强b 值取50、800、1500 s/mm2。
MR-DCE 采用三维扰相梯度回波的T1WI 抑脂成像序列:TR 4.32 ms,TE 1.99 ms,层厚3.5 mm,层间距0 mm,矩阵179×256,FOV 260 mm×228 mm,并排采集加速因子=2,扫描层数20 层,单次序列采集扫描时间14 s。经静脉快速推注钆喷替酸葡甲胺0.2 mmol/kg。
1.3 图像评估 将MRI 扫描图像传至PACS 系统,由1 名放射科住院医师和1 名主任医师分别采用盲法进行PI-RADS v2.1 评分[8],当评分不一致时,经讨论协商确认最终评分。采用公式(1)估算前列腺体积(prostate volume,PV),并根据公式(2)计算PSA密度(prostate-specific antigen density,PSAD)。

1.4 前列腺穿刺及分组 由1 名超声科副主任医师及泌尿外科主治医师使用针突长度为22 mm 的TSK-18G 全自动型活检针,经直肠超声行常规12 针前列腺穿刺,并在超声、MRI 融合成像引导下,对MRI 上可疑病灶或不确定病灶处加穿1~2 针;由病理科副主任医师记录每针穿刺组织的病理结果,并对PCa 组织进行Gleason 评分(Gleason score,GS)。
根据PI-RADS v2.1 评分系统,将临床有意义的前列腺癌(clinically significant prostate cancer,CsPCa)定义为GS≥3 分(主要评分)+4 分(次要评分),和(或)体积≥0.5 cm3,和(或)包膜外侵犯。根据病理结果进行分组:①BPH 组与PCa 组;②非CsPCa 组与CsPCa 组,其中非CsPCa 组为BPH+临床无意义的前列腺癌(clinically insignificant prostate cancer,CisPCa)。
1.5 统计学方法 采用SPSS 22.0 软件,正态分布的计量资料用x ±s表示,两组间比较采用独立样本t检验;非正态分布的计量资料采用M(Qr)表示,组间比较采用Mann-WhitneyU检验。计数资料组间比较采用χ2检验。对组间差异有统计学意义的参数绘制受试者工作特征(ROC)曲线,并计算曲线下面积(AUC),评价诊断效能。另外,以PI-RADS v2.1评分分为1~2 分组、3 分组、4~5 分组;以年龄分为≤60 岁、61~70 岁、>70 岁;以fPSA/tPSA 分为≤0.160、0.161~0.250、>0.250;以PSAD 分为≤0.150 ng/ml2[9]、0.150~0.350 ng/ml2、>0.350 ng/ml2组。将PI-RADS v2.1评分、年龄、fPSA/tPSA、PSAD 分组、分层后采用二元Logistic 回归分析多参数联合对PCa 的诊断效能;P<0.05 表示差异有统计学意义。
2 结果
2.1 BPH 组与PCa 组、非CsPCa 组与CsPCa 组基线指标比较 180例患者中,BPH 111例,PCa 69例,其中CsPCa 57例(包括GS≤6 分4例、GS=7 分22例、GS≥8 分31例),CisPCa 12例。
PI-RADS v2.1 评分1~2 分75例,3 分44例,4~5 分61例。PI-RADS v2.1 评分3 分的44例中,5例 (11.36%)移行带病灶参照PI-RADS v2.0 标准评为2 分,DWI 序列评分≥4 分,因此根据PI-RADS v2.1评分标准,病灶最终得分加至3 分,病理结果均为BPH。BPH 组与PCa 组间、非CsPCa 组与CsPCa 组间PI-RADS v2.1 评分、PSA、fPSA/tPSA、PSAD 和PV 差异均有统计学意义(均P<0.01)。BPH 组与PCa组患者年龄差异有统计学意义(P=0.04),非CsPCa组与CsPCa 组患者年龄差异无统计学意义(P=0.07,表1、2)。
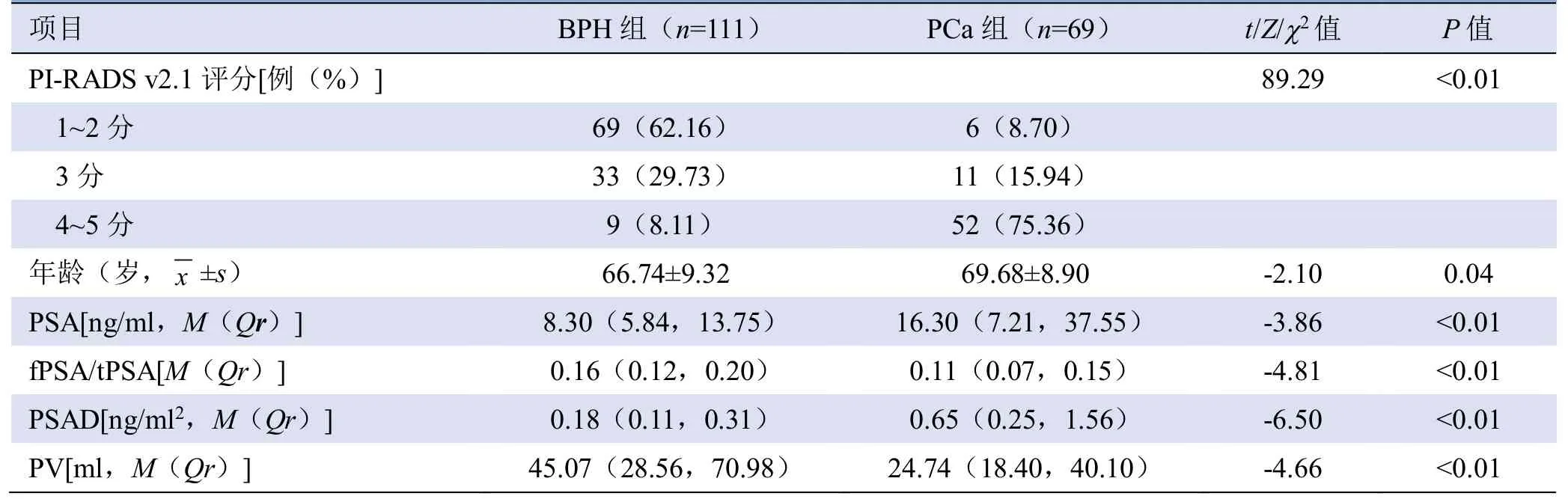
表1 BPH 组与PCa 组单因素分析结果
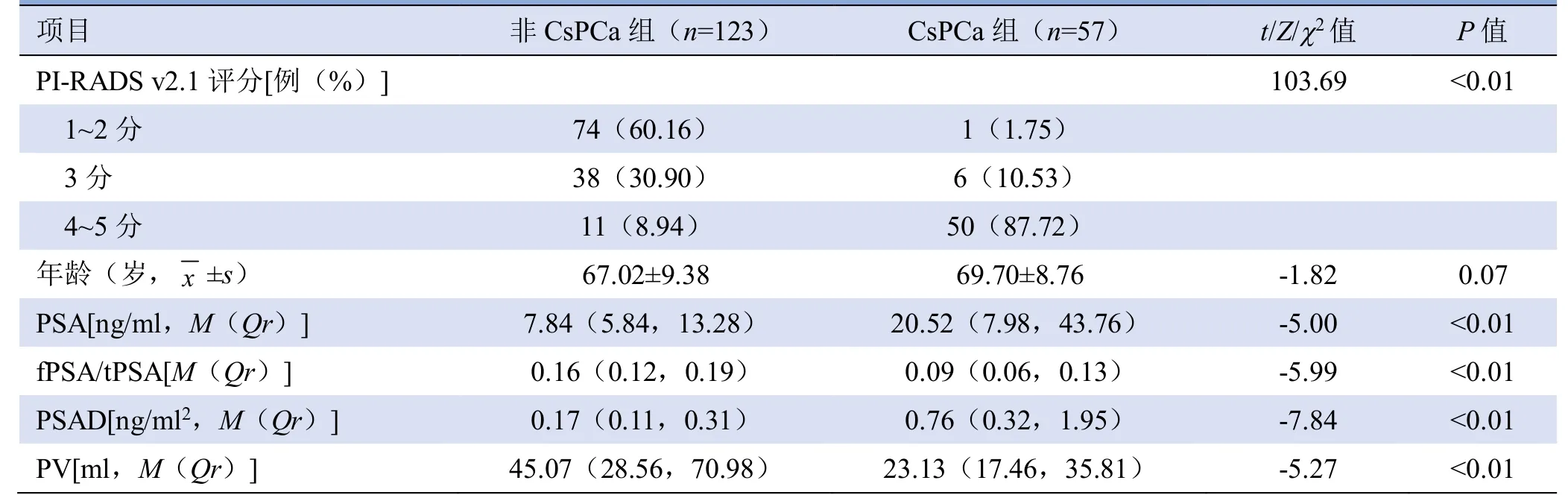
表2 非CsPCa 组与CsPCa 组单因素分析结果
2.2 各指标对PCa 及CsPCa 的诊断价值 ROC 曲线显示,PI-RADS v2.1 评分、PSAD 诊断PCa 的AUC分别为0.882(P<0.01)、0.785(P<0.01),高于年龄(0.592)、PSA(0.666)、fPSA/tPSA(0.715)、PV(0.706);当PI-RADS 截断值为4 分时,约登指数最大,敏感度为75.36%,特异度为91.89%,阳性预测值为85.25%,阴性预测值为85.71%;若以PI-RADS 3 分为截断值,敏感度为91.30%,特异度为62.16%,阳性预测值为60.00%,阴性预测值为92.00%。当PSAD 截断值为0.50 ng/ml2时,约登指数最大,诊断敏感度及特异度分别为55.90%、91.82%。
2.3 Logistic 回归分析结果 由于PSAD=PSA/PV, 为了避免多重共线性,未将PSA、PV 纳入Logistic 回归分析。
将PI-RADS v2.1 评分、年龄、fPSA/tPSA、PSAD分组、分层后采用二元Logistic 回归分析多参数对PCa 的诊断效能,得出PI-RADS v2.1 评分分组(P<0.001)及PSAD 分层(P=0.039)为PCa 的独立预测因子,该模型的 AUC 为 0.897(95%CI0.848~0.946,P<0.001;图1)。

图1 PI-RADS、PSAD 及Logistic 回归模型诊断PCa 的ROC曲线
2.4 PI-RADS v2.1 评分结合PSAD 分层对PCa 及CsPCa 的诊断效能 根据CsPCa、PCa、BPH 在PIRADS v2.1 评分联合PSAD 分层中的分布以及CsPCa的阳性率显示,当PI-RADS≤2 分且PSAD≤0.350 ng/ml2及PI-RADS=3 分且PSAD≤0.150 ng/ml2时,BPH 70例,PCa 7例,且均为CisPCa,即CsPCa 阳性率为0。当PI-RADS=3 分且PSAD>0.350 ng/ml2或PI-RADS≥4 分且PSAD>0.150 ng/ml2时,BPH 15例,PCa 53例,且其中CsPCa 52例,即在该范围内CsPCa 阳性率较高(76.47%)。
3 讨论
PI-RADS 作为多参数MRI 评估前列腺病灶的标准,促进了影像科医师之间及影像科医师与临床医师的沟通,减少了对影像征象分析及解读的差异,诊断敏感度及特异度均较高[10],已广泛应用于临床。然而,PI-RADS 评分仍然局限于对PCa 发生几率的预判,尚未转化为临床实践,即不能单纯依靠其评分决定是否进行前列腺穿刺。基于PI-RADS 联合某些临床指标以提高预测效能,对临床决策具有现实意义。本研究结果显示,PI-RADS v2.1 评分对PCa 的诊断效能最高,AUC 为0.882,即PI-RADS v2.1 评分预测PCa具有较好的优越性,但单纯根据评分预测穿刺结果存在一定的缺陷。若以4 分为界,可能导致24.64%的PCa 被漏诊;以3 分为界,则有37.84%的BPH 患者接受不必要的穿刺。为了进一步提高其准确性,通过多因素Logistic 回归分析显示PI-RADS v2.1 评分及PSAD 分层是PCa 的独立预测因子,回归模型的AUC为0.897,诊断效能较单独使用PI-RADS v2.1 或PSAD高,即两者结合可以更准确地预测前列腺穿刺活检结果,同时有助于辅助指导临床穿刺决策。
2019年初,美国放射协会颁布了PI-RADS v2.1,其除对PI-RADS v2.0 中模糊不清的概念进行解释、定义外,对PI-RADS v2.0 中移行带病灶2、3 分评分细则也进行了修订,目前国内较少使用PI-RADS v2.1进行前列腺病灶评价。本研究中,5例移行带病灶T2WI 评分为2 分,DWI 评分为4 分,因此最终PIRADS v2.1 评分为3 分;若根据PI-RADS v2.0 评分标准,最终评分为2 分,此5例患者病理结果均为BPH,即本研究中PI-RADS v2.1 诊断效能较PI-RADS v2.0 未见提高,可能原因是由于PI-RADS v2.1 本质并非PI-RADS v2.0 的升级版[11],且本研究样本量较小。大多数研究认为PI-RADS 评分4、5 分病例的穿刺阳性率高,诊断敏感度及特异度较高,多建议临床行前列腺穿刺术,但对于PI-RADS 3 分病灶是否需要穿刺,仍未达成共识。本研究中,若仅以3 分作为穿刺截断值,将有37.84%的BPH 患者接受不必要的穿刺,诊断特异性相对较低。
PSA 是前列腺特异性指标,但诊断PCa 的特异性较低。近年研究报道多个PSA 相关新参数可以提高对PCa 的诊断率,包括PSAD、前列腺特异抗原移行带密度、fPSA/tPSA 等,其中以PSAD 最受关注[12]。PSAD 是PSA 与PV 的比值,可规避BPH 时PV 增大及前列腺上皮细胞数量增多所造成的PSA 增高。既往研究显示,当tPSA 介于4~10 ng/ml 时,PSAD 可作为PCa 的独立预测因子[13],其正常值<0.15 ng/ml2[9]。Lin 等[14]的多中心研究显示,当tPSA 介于10.1~ 20.0 ng/ml 时,PSAD 的最佳截断值为0.33 ng/ml2。本研究结果显示,PSAD 对PCa 的诊断价值较高,AUC 为0.785,当PSAD 截断值为0.50 ng/ml2时,诊断敏感度及特异度分别为55.90%、91.82%,其特异度较高而敏感度相对较低,但截断值明显大于上述研究,与本研究未限定tPSA 范围有关。
根据PI-RADS v2.1 评分及PSAD 分层这两个独立预测因子进行分组、分区,结果显示当PI-RADS≤2 分且PSAD≤0.350 ng/ml2及PI-RADS=3 分且PSAD ≤0.150 ng/ml2时,PCa 阳性率较低,而CsPCa 阳性率为0,PCa 诊断治疗指南建议CisPCa 患者首选等待观察治疗及密切随访[15],因此根据本研究结果推断,在此范围内的患者可等待观察治疗及主动监测,避免不必要的穿刺活检术。当PI-RADS=3 分且PSAD>0.350 ng/ml2或PI-RADS≥4 分且PSAD>0.150 ng/ml2时,PCa 阳性率高,且53例PCa 中,仅1例(1.89%)为CisPCa,提示该范围内的PCa 患者多为CsPCa,尽早行穿刺活检术并获得GS 有助于避免错误分期、延误病情,同时可辅助决定治疗方案。本研究结果与Washino 等[16]的结果相近,但该研究采用的评分标准是PI-RADS v2.0 , PSAD 分 为≤0.150 ng/ml2、 0.150~0.300 ng/ml2、>0.300 ng/ml23 组,与本研究分组不同,可能是由于中国人前列腺上皮区域比例较大,因此PSA 较高所致[17]。综上所述,PI-RADS v2.1 评分及PSAD 是PCa 的危险因素,PI-RADS v2.1 评分结合PSAD 分层,有助于更直观、更准确地预测前列腺穿刺活检结果,同时有助于辅助指导临床的穿刺决策。
本研究的局限性:①样本量相对较小,且为回顾性研究,可能存在选择偏倚;②未区分外周带、移行带病灶,后续研究将进一步收集病例,并对病灶分区进行分析。
