从数学到心脏:心脏磁共振分形分析评估心肌小梁的应用
2021-05-26张鑫郑甜温金扬龚良庚
张鑫,郑甜,温金扬,龚良庚
南昌大学第二附属医院,江西南昌 330000;*通讯作者 龚良庚 Gong111999@126.com
分形理论在生物学中具有重要作用,有助于识别心脏结构及功能表现出的“复杂性”,对于正在努力量化心肌小梁复杂结构的临床医师而言,分形分析是一种强大却未得到充分利用的数学工具。本综述概述了分形分析的相关理论,及利用心脏磁共振(CMR)分形分析技术量化心肌小梁复杂程度的相关研究,阐述了分形分析在诊断及评估心脏疾病中潜在的临床应用价值。
1 分形分析的数学原理
由传统点、线、面构成的欧几里得几何图形,可以通过长度、面积、体积等单位进行测量。而现实生活中,一些生物结构的复杂图形,难以用传统欧式几何语言描述,而“分形(fractal)”这个抽象的数学概念,可以用于描述在无限尺度上自相似的复杂现象。1967年,数学家曼德布罗特发表的论文《英国的海岸线有多长》,发现10 km 长海岸线放大后与在空中拍摄的100 km 长的海岸线看上去十分相似,这种几乎同样程度的复杂性和不规则性,表明海岸线在形貌上是自相似的,即局部形态和整体形态的相似[1]。曼德布罗特将这些部分与整体以某种方式相似的形体称为“分形”。分形分析类似纹理特征,可对单纯的影像图像进行形态量化评估分析[2]。分形分析和影像学的实践应用之间的联系是分形维数(fractal dimension,FD)——一个非度量的、自相似的无单位数。在分形理论中,FD 测量的是一个现象的“复杂性”,即细节变化与尺度变化的对数比,由基本的分形关系联系起来:N∝εFD,基于这一关系式可得出指数FD=log N/log ε[1]。这种关系式表明,FD 与传统的维数概念不同,可以是整数或分数,其大小反映了分形集的复杂程度,体现了分形所占据的空间大小,维数越高的分形集填充的空间越复杂。
2 心肌小梁的形成与异常
心肌小梁参与心脏传导系统形成,并具有增加心肌表面积与质量、加强心肌收缩、分流和储蓄心室腔 内血液等重要功能[3-5]。在所有的脊椎动物中,心肌壁具有复杂的形态,在心室中最为明显。心室壁的外表面相对光滑,并覆盖着一层薄薄的心外膜,但其内表面显示出一个复杂的结构,包括不同的心肌束,称为小梁。在胚胎心脏发育过程中,心肌细胞增殖形成向心腔内突起的疏松网状结构,类似“海绵样”,增加血氧接触面积[6-7]。一般认为,在心脏发育的晚期,交织的网状心肌小梁发生形态变化,肌小梁之间的窦隙逐渐消失,留下致密的心肌,心肌质量增加[8-10]。
导致心肌小梁异常的原因通常分为先天性和继发性[11-12],①先天性因素:在胚胎发育过程中,由于基因异常导致左心室心肌致密化过程终止,导致左心室壁内层突起的肌小梁及深陷的小梁间隐窝残留,致密心肌细胞减少,心室壁变薄——这是导致左心室心肌致密化不全(1eft ventricular noncompaction,LVNC)的重要病因[13-16]。②继发性因素:由于先天性心脏血管疾病或存在致使心脏负荷增加的情况,导致左心室压力负荷加重和心肌缺血,心腔内血流将直接作用于肌小梁,产生高压机械效应,导致心肌小梁增多,即心肌过度小梁化[5,11,18]。
在广泛的心肌疾病中可以观察到异常的心肌小梁,如LVNC[16,18]、扩张型心肌病(dilated cardiomyopathy,DCM)[5,16]、肥厚性心肌病(hypertrophic cardiomyopathy,HCM)[18]、镰状细胞性贫血及先天性心脏病;运动员[19]和孕妇[20]也会出现心肌小梁代偿性增多。心脏的小梁结构中包含丰富的信息,小梁的形成不仅受种族或人群的影响,更重要的是受心脏负荷条件和疾病的影响[21]。小梁的精准量化对于疾病早期诊断和病变随访跟踪具有重要意义,异常小梁结构在非缺血性心肌病早期即具有预测作用[22-23]。
3 分形分析的测量工具及方法
在实践中,CMR 图像的分形分析可以通过半自动化软件完成,测量左心室内膜的复杂性并提供FD值,对于所有研究的数字图像,均能够实现小于1 mm的平均点到曲线误差[24]。通过人工在左心室短轴舒张末期勾勒心外膜与心内膜的边界,基于计盒维数法(Box-counting method)计算心肌小梁的填充空间,并将其量化[25-26]。可以实现上述操作的半自动化软件主要包括ImageJ 的FracLac 插件、MATLAB 及心脏专业软件cvi42 和OsiriX50 的Fractal Analysis插件[27]。
基于分形分析测量每层短轴的肌小梁的填充空间,得到一个可重复性高的连续变量FD(如左心室室壁厚度或射血分数),是取值范围为1~2 的非整数值,反映了肌小梁的复杂程度[28]。通过FD 大小可以反映左心室的心内膜复杂性(即心内膜轮廓空间填充的度量):正常人左心室小梁的FD 从基底部到心尖部呈特征性变化,且与种族、年龄、性别、体质量及左心室质量等特征具有相关性[29-30]。分形分析对心肌小梁测量的主要参考指标包括:①mean global FD,为左心室纳入计算的每一层短轴的平均FD 值;②max basal FD,为心远端(包括室中部及基底部)的最大FD 值;③max apical FD,为心尖部的最大FD 值。
4 分形分析的临床应用及进展
CMR 可实现心肌小梁的可视化,具有不受限制的成像平面、空间清晰度高和血液与心肌对比度高的优势,而分形分析成功应用于CMR 图像,为量化心 肌小梁提供了一种高重复性和准确性的测量方法。目前,临床主要依据左心室舒张末期测得的非致密心肌层(noncompacted myocardium,NC)与致密心肌层(compacted myocardium,C)的厚度比值(NC/C)作为诊断LVNC 的主要指标,但NC/C 受测量者主观因素影响较大,且厚度是作为肌小梁增多程度的间接指标,并不能完全反映心肌小梁的内部结构。
分形分析作为一种客观的定量测量左心室肌小梁的方法,在LVNC 的诊断中发挥了重要作用,Captur 等[26]研究发现,与健康志愿者相比,LVNC 患者的FD 显著升高。Zheng 等[31]的研究为诊断LVNC 提供了参考截断值:mean global FD 为1.265,max apical FD 为1.318,并进一步为LVNC 与DCM 的鉴别诊断提供了新的思路,即LVNC 的mean global FD 及max apical FD 均高于DCM。分形分析对HCM 的诊断评估也具有重要意义,Captur 等[25]的分形分析结果显示,与正常组相比,不仅在显性疾病中,在未发生左心室心肌肥厚的肌节蛋白基因阳性患者(G+ LVH-)中,max apical FD 也异常升高,FD 增大是肌节蛋白基因突变携带者的重要临床前表型之一[32],可用于在家庭筛查中预测HCM 患者亲属的遗传携带者。Wang 等[33]的研究进一步表明,max apical FD 对HCM 的全因死亡率和心血管事件具有独立的预后价值,为HCM 患者的预后预测因子提供了增量价值。分形分析的临床应用进展见表1。
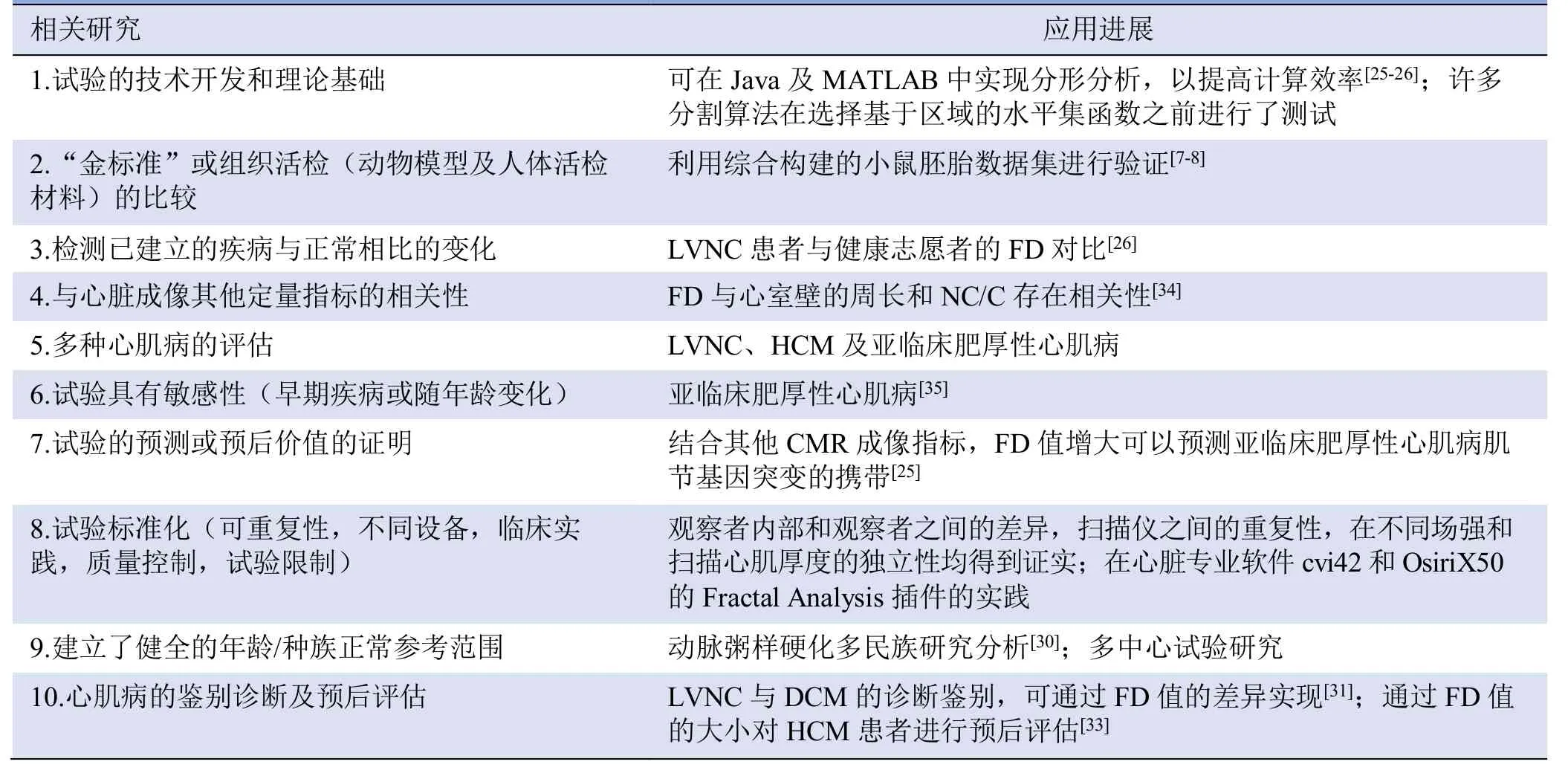
表1 分形分析应用于心肌小梁评估的相关研究及应用进展
5 分形分析的未来方向
分形分析对心血管系统相关疾病的临床应用范围非常广,尽管心脏中的分形模式可能无法在空间或时间上无限地缩放比例,但是分形分析还是很合适的,FD仍然可以用来描述心脏结构的复杂程度。小梁的发育和心脏胚胎发生过程中发生的心肌变化尚不完全清楚,这是分形分析的一个潜在应用。目前,本文分析仅实现了基于左心室短轴上获取的二维图像,而未来的研究应该将其扩展到基于CMR的三维心肌小梁网络中。
6 小结
本文阐述了分形几何学的一些基本原理,与现阶段分形方法成功应用于心血管疾病机制的相关研究成果,并提出其在心脏成像中的潜在临床作用。随着分形技术在心血管影像研究方向的不断发展及实践,对心脏发育、结构和功能的理解将逐渐加深。本文提出了分形分析应用于心血管疾病研究的可实现性,期望能吸引更多的心脏成像工作者,利用现有的有效分形分析工具库进行临床实践并创新。
