丙型肝炎病毒调控ADAR1逃避先天免疫的机制研究
2021-05-26王本鑫王福义孟凡鑫
王本鑫,王福义,孟凡鑫
沈阳医学院附属中心医院检验科,辽宁沈阳 110024
丙型肝炎病毒(HCV)感染已经成为严重的公共卫生问题[1]。HCV感染在大多数感染者中为慢性感染,是肝细胞癌的主要原因之一[2]。HCV感染发生在肝细胞内,因此HCV的免疫防御第一线依赖于肝细胞的内在先天免疫[3]。干扰素(IFN)的表达驱动数百种干扰素刺激基因(ISG)的表达,这些ISG编码先天的免疫效应子,这些效应子也控制着病毒的复制和传播[4]。影响HCV感染的基因包括不同的IRF家族成员、信号转导因子和其他未知作用机制的ISG,例如ADAR1[5]。已有研究表明,ADAR1能够帮助HCV逃避宿主的先天免疫[6],但是其中的机制尚不明确。基于此,本研究旨在探讨HCV调控ADAR1逃避先天免疫的潜在机制。
1 材料与方法
1.1细胞来源及主要试剂 Huh7细胞购自深圳市益百顺科技有限公司(货号:Huh-7)。引物和DNA探针购自Life Technologies公司。miRNA mimics,miRNA inhibitor、siRNA均由上海吉凯基因化学技术有限公司合成。DMEM培养基购自深圳市益百顺科技有限公司(货号:XBPY)。HCV Jc1病毒受赠于武汉病毒所。QuickextractTMRNA提取试剂盒购自蓝景科信(北京)技术有限公司(货号:QER090150)。DNaseI购自北京普益华科技有限公司(货号:AMPD1-1KT)。PrimeScript RT预混液购自Takara公司(货号:RR036Q)。NucleoSpin RNAⅡ试剂盒购自Gene公司(货号:740945.50)。ADAR1的3′端非编码区由Huh7细胞基因组扩增并插入pMIR载体中构成,并命名为ADAR1-3′UTR-WT。ADAR1-3′UTR-MT为ADAR1的3′端非编码区中miRNA靶向区域的碱基突变形式。
1.2方法
1.2.1细胞培养与转染 Huh7细胞用含10%胎牛血清(FBS)的DMEM培养基培养,并补充葡萄糖(4.5 g/L)、2 mmol/L 1-谷氨酰胺、1 mmol/L丙酮酸钠和1X MEM非必需氨基酸,将细胞放于37 ℃、5%CO2的培养箱中培养。将miRNA mimics、miRNA inhibitor、siRNA与Lipofectamine 2000试剂混合,终浓度为100 nmol/L,静置20 min。然后,将复合物与2×105个细胞混合,并在不存在血清的情况下使用OPTIMEM培养基接种到24孔板中。24 h后,加入含血清的培养基。转染后48 h,用乙二胺四乙酸(EDTA)溶液分离细胞,计数并以适当浓度接种以进行病毒感染。同时,通过测量RNA表达和蛋白质表达来评估敲除表型。在检测ADAR1对HCV感染影响的实验中,敲低GFP为对照组,敲低ADAR1为敲低组。在检测HCV感染对ADAR1表达影响的实验中,HCV感染细胞为HCV组,对照为没有任何处理的MOCK组。在转染miRNA mimics或miRNA inhibitor的实验中,转染miRNA mimics或miRNA inhibitor的为实验组,转染negative control的为对照组。在检测miRNA是否靶向ADAR1 3′端非编码区的实验中,转染ADAR1-3′UTR-WT的为野生组,转染ADAR1-3′UTR-MT的为突变组。
1.2.2HCV的生产 使用HCV Jc1病毒感染Huh7细胞,感染复数(MOI)为0.02,病毒复制5 d后通过定量感染细胞中的HCV RNA进行检测。按照制造商的操作规程,使用QuickextractTMRNA提取试剂盒规程提取HCV感染细胞的总细胞RNA,包括DNaseⅠ处理步骤,提取的RNA保存在—80 °C冰箱中待测,然后用PrimeScript RT预混液将1 μg的总RNA反转录为cDNA,将该cDNA用于Taqman定量PCR,并使用HCV 5′NC6引物和探针对病毒HCV RNA进行转录本的检测。
1.2.3RNA抽取与实时荧光定量PCR 为了进行相对mRNA定量,按照制造商的建议,使用NucleoSpin RNAⅡ试剂盒提取RNA,包括DNaseⅠ处理步骤。反转录酶使用PrimeScriptTMRT-PCR试剂盒进行。通过两步定量RT-PCR测量所有基因的mRNA相对水平,并使用2—ΔCt方法将其标准化为GAPDH mRNA表达。
1.2.4免疫印迹 将细胞在冰冷的磷酸盐(PBS)缓冲液中冲洗,并在裂解缓冲液(50 μmol/L Tris HCl pH值7.5、1 μmol/L EDTA,1 μmol/L EGTA,1 μmol/L Na3VO4、10 μmol/L β-甘油磷酸钠,50 μmol/L NaF中制备提取物,添加270 μmol/L蔗糖和1%Triton X-100),并添加蛋白酶抑制剂(Roche)和1 μmol/L苯基甲基磺酰氟。将裂解物进行聚丙烯酰胺凝胶电泳(SDS-PAGE),并转移至聚偏二氟乙烯(PVDF)膜。
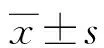
2 结 果
2.1ADAR1抑制HCV感染Huh7细胞后的先天免疫 使用siRNA敲低ADAR1后(图1),敲除组炎症因子和干扰素的mRNA水平较对照组均表达上升,差异有统计学意义(P<0.05),见表1。同时,与对照组比较,敲低组中IFNγ的分泌水平上升,HCV的复制水平下降,差异有统计学意义(P<0.05),见表2和表3。
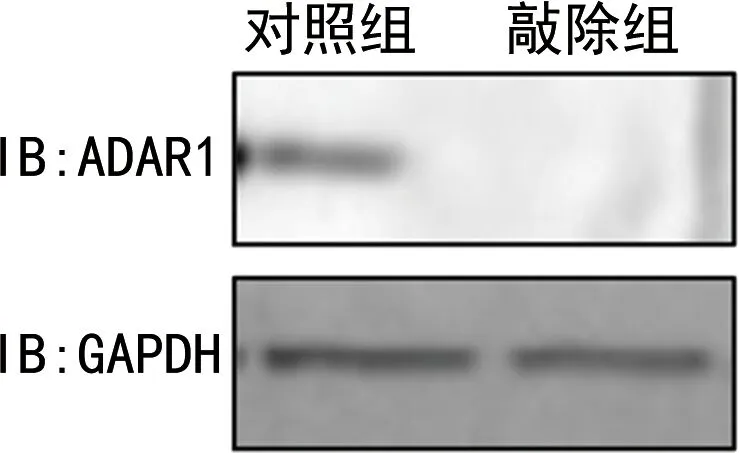
图1 siRNA敲低ADAR1的效率

表1 敲低ADAR1后HCV基因组的相对水平
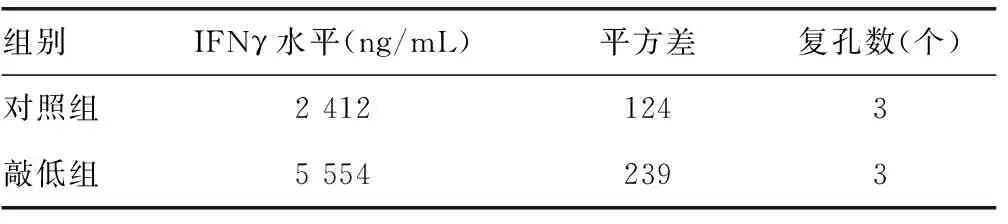
表2 敲低ADAR1后IFNγ的分泌水平

表3 敲低ADAR1后炎症因子和干扰素的相对mRNA水平(siADAR1/control)
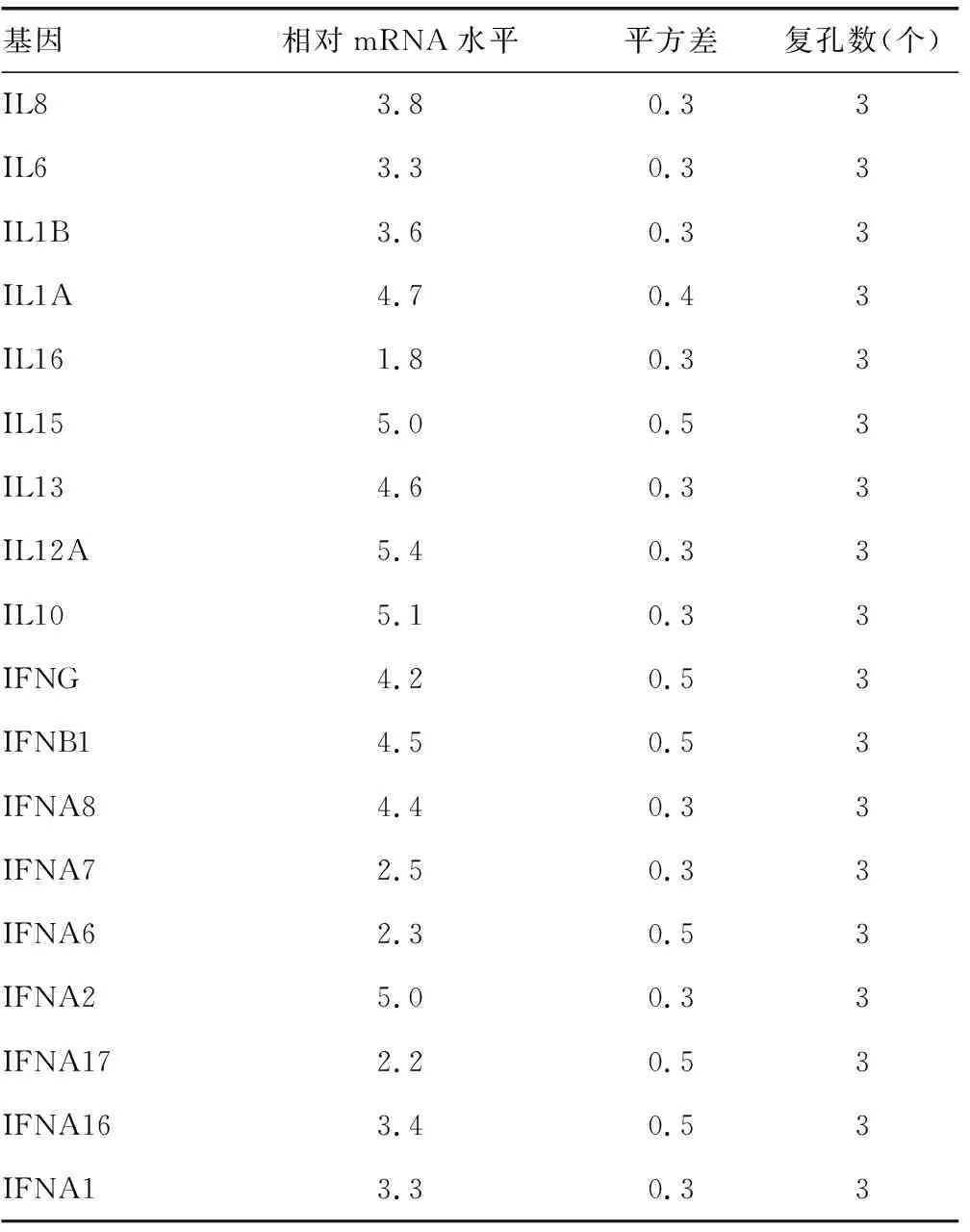
续表3 敲低ADAR1后炎症因子和干扰素的相对mRNA水平(siADAR1/control)
2.2HCV感染后ADAR1的表达水平 与MOCK组比较,HCV组的ADAR1mRNA水平和蛋白水平均明显上升,差异有统计学意义(P<0.05),见图2和表4。但是,ADAR1的启动子活性没有明显变化,差异无统计学意义(P>0.05),见表5。
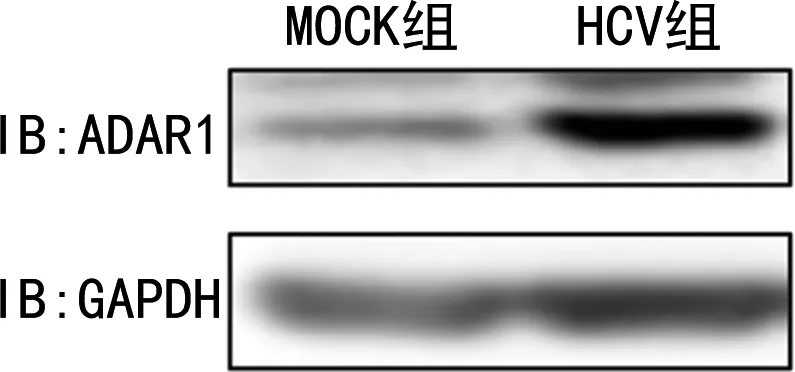
图2 HCV感染后ADAR1的表达水平

表4 HCV感染后ADAR1 mRNA的相对表达水平

表5 HCV感染后ADAR1启动子的活性
2.3hsa-miR-135a-5p和hsa-miR-135b-5p靶向ADAR1的3′端非编码区 miRDB在线分析发现有多种潜在靶向ADAR1的miRNA。HCV感染Huh7细胞后,通过实时荧光定量PCR检测上述miRNA,与对照组比较,hsa-miR-613、hsa-miR-206、hsa-miR-135b-5p、hsa-miR-135a-5p、hsa-miR-6803-5p、hsa-miR-4530、hsa-miR-3915的表达水平均下降,差异有统计学意义(P<0.05),见表6。在Huh7细胞中过表达上述miRNA后,与对照组比较,hsa-miR-135b-5p和hsa-miR-135a-5p能够在mRNA水平减少ADAR1的表达,差异有统计学意义(P<0.05),见表7。同时,过表达hsa-miR-135a-5p或hsa-miR-135b-5p后,与突变组比较,野生组的荧光素酶相对活性明显下降,差异有统计学意义(P<0.05),见表8。过表达hsa-miR-135a-5p或miR-135b-5p后,与对照组比较,ADAR1 的表达水平均下降,IFNγ的分泌水平上升,HCV的复制水平下降,差异有统计学意义(P<0.05);敲低hsa-miR-135a-5p或miR-135b-5p后,与对照组比较,ADAR1 的表达水平均上升,IFNγ的分泌水平下降,HCV的复制水平上升,差异有统计学意义(P<0.05),见图3、表9、表10和表11。
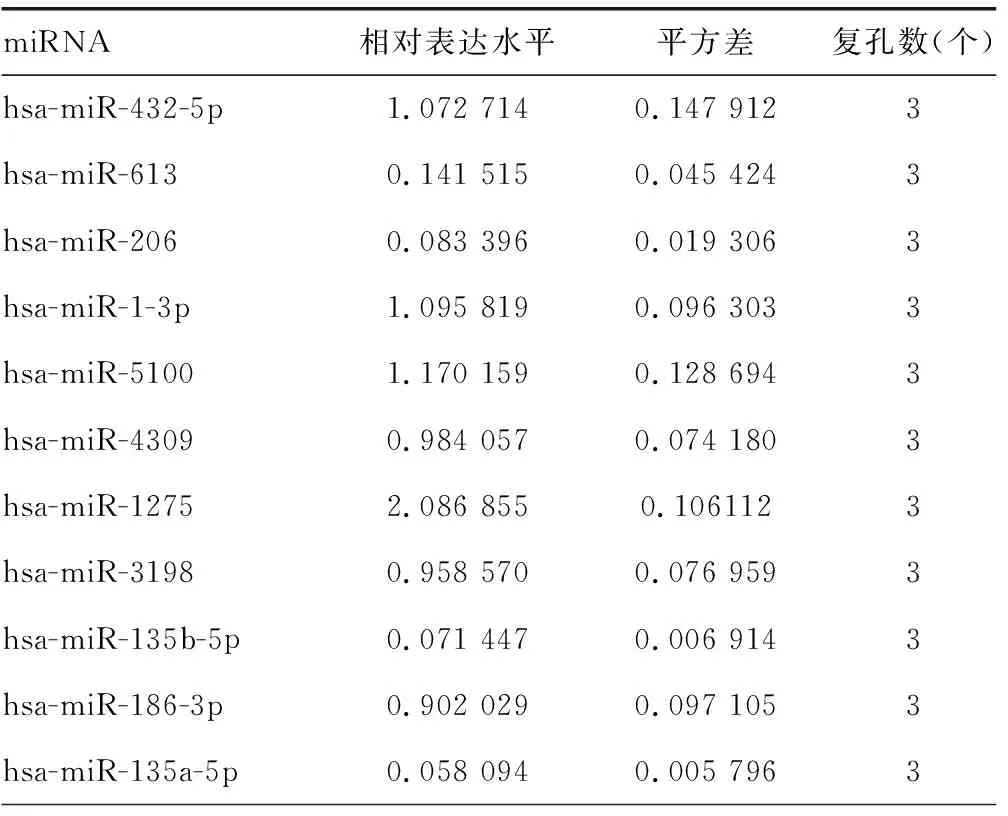
表6 HCV感染后miRNA的相对表达水平
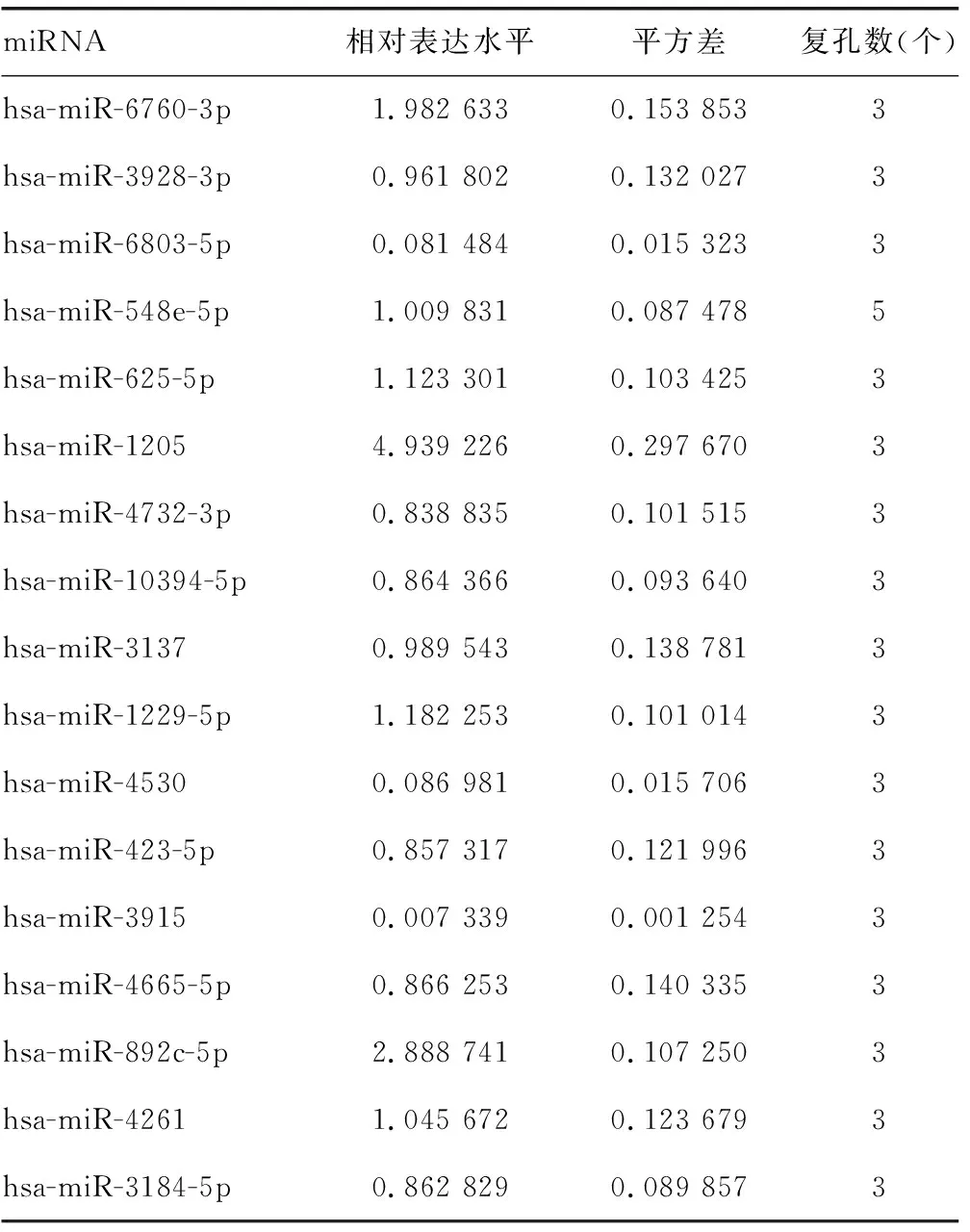
续表6 HCV感染后miRNA的相对表达水平
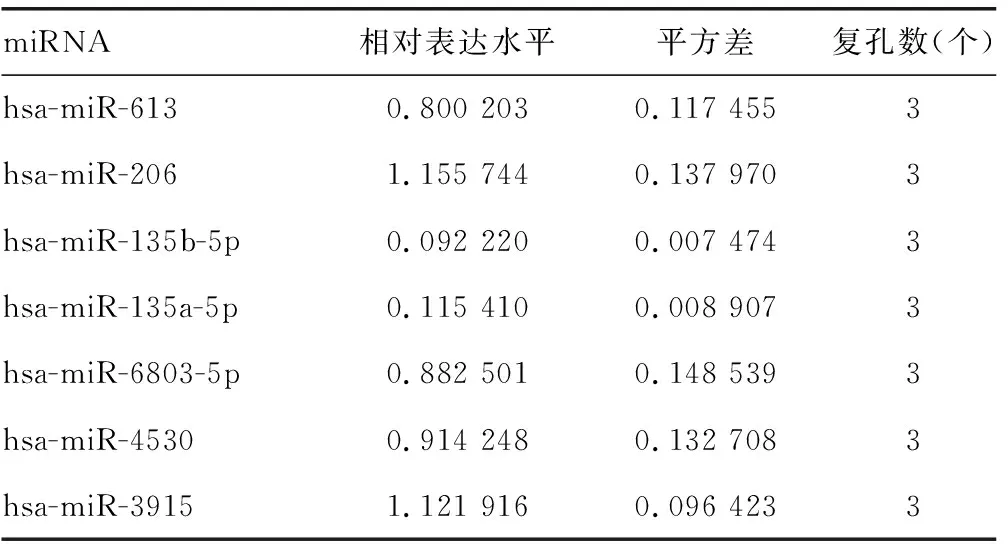
表7 过表达miRNA后ADAR1的相对表达水平
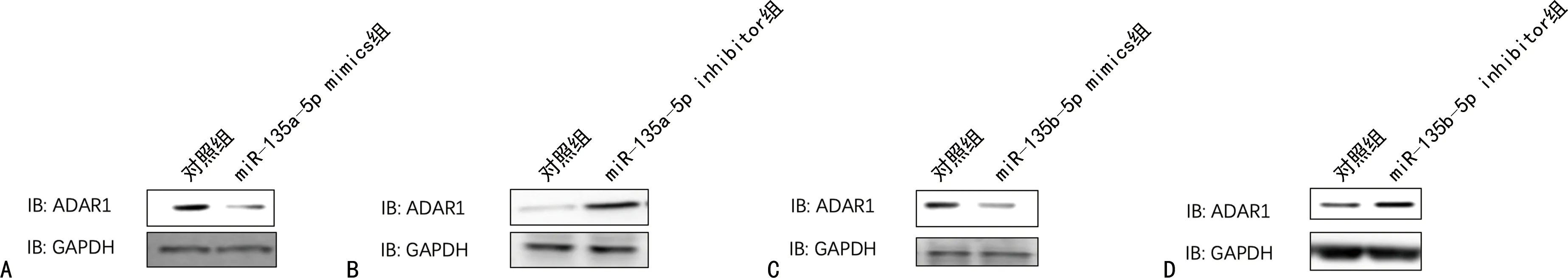
注:A为过表达hsa-miR-135a-5p后ADAR1的蛋白表达水平;B为敲低hsa-miR-135a-5p后ADAR1的蛋白表达水平;C为过表达hsa-miR-135b-5p后ADAR1的蛋白表达水平;D为敲低hsa-miR-135b-5p后ADAR1的蛋白表达水平。

表8 过表达hsa-miR-135a-5p后荧光素酶的活性

表9 过表达hsa-miR-135b-5p后荧光素酶的活性
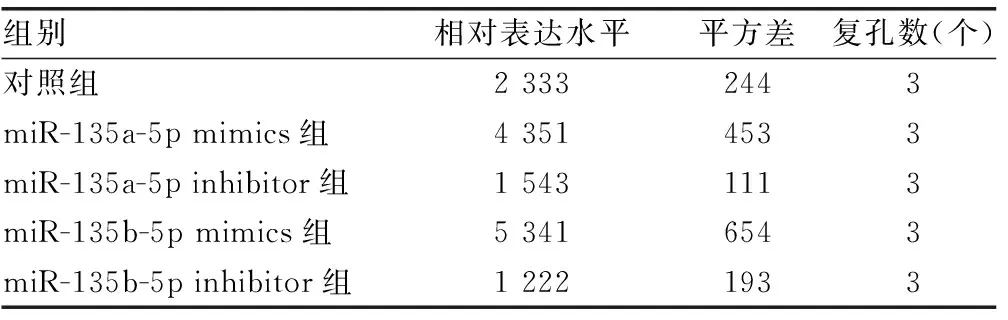
表10 hsa-miR-135a-5p、hsa-miR-135b-5p调控Huh7细胞IFNγ的分泌
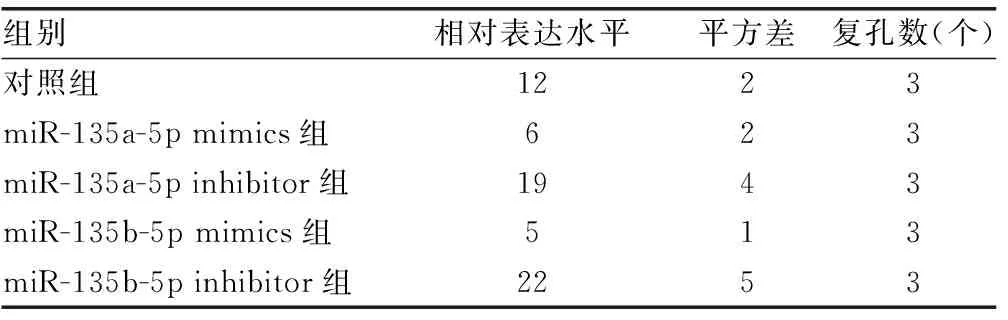
表11 hsa-miR-135a-5p、hsa-miR-135b-5p调控Huh7细胞中HCV的复制
3 讨 论
HCV感染后,宿主诱导IFN介导一线防御限制病毒复制,这主要由Ⅰ型IFN介导,并通过诱导多种ISG引起其抗病毒作用[7]。但是,HCV采用了多种策略来逃避宿主的先天免疫监视[8-9]。尽管在某些情况下免疫反应可以清除HCV,但HCV通常会导致慢性感染,最终导致肝病和肝细胞癌[10]。本研究敲低ADAR1后,炎症因子和干扰素的mRNA水平均上升,INFγ的分泌水平上升,HCV的复制水平下降,差异有统计学意义(P<0.05)。因此,HCV逃避宿主先天免疫的策略之一是操控ADAR1。
在本研究中,HCV感染Huh7细胞后,ADAR1在mRNA水平和蛋白水平均明显上升,差异有统计学意义(P<0.05)。但是,ADAR1的启动子活性没有明显变化,差异无统计学意义(P>0.05)。因此,HCV调控ADAR1的水平可能是在mRNA水平上。miRNA是短的RNA序列(19~22 nt),当miRNA的种子区加入信使的3′UTR区时,它调节靶mRNA的翻译,特别是诱导其沉默或降解[11]。miRNA参与组织发育、分化、细胞增殖、组织修复及病理过程[12]。因此,ADAR1的表达水平在HCV感染后可能受到miRNA的调控。过表达miR-135a-5p或miR-135b-5p后,ADAR1 的表达水平均下降,IFNγ的分泌水平上升,HCV的复制水平下降,差异有统计学意义(P<0.05);敲低miR-135a-5p或miR-135b-5p后,ADAR1 的表达水平均上升,IFNγ的分泌水平下降,HCV的复制水平上升,差异有统计学意义(P<0.05)。因此,HCV能够通过操纵宿主的miRNA促进ADAR1的表达和功能的发挥。
ADAR催化双链RNA底物中腺苷(A)向肌苷(I)的转化,这一过程具有广泛的生理作用[13]。人体中存在3种ADAR酶,包括ADAR1、ADAR2、ADAR3[14]。已证明ADAR1在生理和病理状况(包括感染、自身免疫性疾病和癌症)中起着更重要的作用[15]。据报道,对ADAR1的抑制刺激了HCV RNA的产生[16],这表明ADAR1在感染性病毒细胞培养系统中也是HCV与宿主相互作用的重要影响因素。尚不清楚ADAR1在HCV感染中抗病毒作用的确切机制。但是,已有研究报道ADAR1可以调节HCV感染细胞中的PKR激活状态,从而抑制IFN刺激的细胞蛋白合成,但不能抑制HCV IRES依赖性病毒蛋白合成[17]。此外,HCV还通过调节PKR激活来控制IFN的产生[18]。通过eIF2介导的翻译抑制作用,在JFH1 HCV感染的Huh细胞中发生PKR介导的IFN诱导抑制作用[19]。因此,笔者猜测ADAR1在HCV感染的情况下是通过以下机制组合产生抗病毒作用:HCV RNA的A至I编辑通过病毒编码序列的突变降低HCV蛋白表达,以及ADAR1的编辑通过抑制干扰素和ISG来阻止HCV复制。
综上所述,HCV感染后,Huh7细胞中hsa-miR-135a-5p和miR-135b-5p的表达水平下降,其靶向ADAR1 mRNA的3′端非编码区的水平下降,随后ADAR1的表达水平上升,抑制了宿主的先天免疫,促进了HCV的复制。
