外周血NLR、MLR、PLR和SII在宫颈癌中的临床意义分析*
2021-05-26朱光琼许华斌陈传平张光满
朱光琼,许华斌,陈传平,张光满△
1.皖西卫生职业学院附属医院检验科,安徽六安 237008;2.皖西卫生职业学院医学技术系,安徽六安 237005
宫颈癌是女性常见生殖系统恶性肿瘤,发病率居于女性恶性肿瘤的第2位,已成为全球特别是发展中国家女性因恶性肿瘤死亡的主要原因[1-2]。宫颈癌的发生和发展是一个渐进的过程,从癌前病变发展为恶性肿瘤需要经历一段较长的病变时期,如果在这个病变时期及早发现并给予有效治疗,可以有效降低宫颈癌的发病率和病死率[3-4]。有研究发现,炎性反应在肿瘤的发生和发展中具有非常重要的促进作用,是肿瘤微环境中非常重要的影响因素[5-6],在肿瘤的免疫逃逸、耐药及血管生成和肿瘤细胞的增殖中都具有重要的作用,已成为研究的热点[7-8]。中性粒细胞与淋巴细胞比值(NLR)、单核细胞与淋巴细胞比值(MLR)、血小板与淋巴细胞比值(PLR)及系统性免疫性炎症指数(SII)逐渐成为研究肿瘤诊断和预后的重要指标[9-13]。本研究旨在分析NLR、MLR、PLR和SII在宫颈癌前病变和宫颈癌中的鉴别诊断价值,并进一步分析这4项指标与宫颈癌病理特征的关系,从而为宫颈癌的早期诊断和治疗提供依据。
1 资料与方法
1.1一般资料 选取2016年1月至2020年6月皖西卫生职业学院附属医院收治的236例疑似宫颈癌患者为研究对象,年龄25~82岁,平均(47.39±11.20)岁;根据病理结果分为宫颈癌组(n=67)和宫颈癌前病变组(n=169),其中宫颈癌前病变患者又按照宫颈上皮内瘤变级别分为宫颈上皮内瘤变Ⅰ级(CINⅠ组,n=91)、宫颈上皮内瘤变Ⅱ级(CINⅡ组,n=23)和宫颈上皮内瘤变Ⅲ级(CINⅢ组,n=55)。另选取42例在皖西卫生职业学院附属医院进行体检的健康女性作为对照组,年龄26~71岁,平均(46.62±11.35)岁。所有研究对象均严格按照《宫颈癌及癌前病变规范化诊疗指南(试行)》[14]相应诊断标准进行诊断,同时排除急性炎症、慢性炎症、合并其他肿瘤、自身免疫性疾病、血液系统疾病等,其中对照组在满足这些排除标准外还排除宫颈癌前病变和宫颈癌。
1.2仪器与试剂 血常规采用深圳迈瑞生物医疗电子股份有限公司生产的BC-6800血细胞分析仪及配套试剂、校准品和质控品进行检测。所有操作均严格按照标准操作规程操作,在整个研究期间每日检测室内质控品以保证检测的精密度,并每年参加国家临床检验中心室间质量评价保证检测的准确度。
1.3检测方法 以乙二胺四乙酸二钾(EDTA-K2)抗凝管采集肘静脉血2.0 mL,立即颠倒混匀后用于血常规检测。根据血常规中中性粒细胞计数、淋巴细胞计数、单核细胞计数和血小板计数分别计算NLR、MLR、PLR和SII,其中NLR=N/L、MLR=M/L、PLR=P/L和SII=P×N/L,其中N、M、P和L分别为血常规中中性粒细胞绝对值、单核细胞绝对值、血小板绝对值和淋巴细胞绝对值。
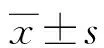
2 结 果
2.13组NLR、MLR、PLR和SII比较 宫颈癌组的NLR、MLR、PLR和SII明显高于宫颈癌前病变组和对照组,差异有统计学意义(P<0.05);宫颈癌前病变组的NLR、MLR、PLR和SII明显高于对照组,差异有统计学意义(P<0.05)。见表1。
2.2NLR、MLR、PLR、SII与宫颈上皮内瘤变级别的关系 CINⅢ组的NLR、MLR、PLR、SII明显高于对照组、CINⅠ组和CINⅡ组,差异有统计学意义(P<0.05);CINⅡ组的NLR、MLR、PLR和SII明显高于对照组和CINⅠ组,差异有统计学意义(P<0.05);CINⅠ组的NLR、MLR、PLR、SII与对照组比较,差异无统计学意义(P>0.05)。见表2。
2.3NLR、MLR、PLR、SII对宫颈癌和宫颈癌前病变鉴别诊断的效能评价 ROC曲线分析结果显示,NLR、MLR、PLR和SII鉴别诊断宫颈癌和宫颈癌前病变的ROC曲线下面积(AUC)分别为0.724、0.700、0.646和0.733。 根据ROC曲线计算Youden指数,以最大Youden指数对应的数值作为最佳诊断截断值,得出NLR、MLR、PLR和SII的最佳诊断截断值分别为2.11、0.20、120.81和662.29。根据此截断值分别计算NLR、MLR、PLR和SII鉴别诊断宫颈癌和宫颈癌前病变的灵敏度、特异度、符合率、阳性预测值和阴性预测值,见表3和图1。
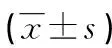
表1 3组NLR、MLR、PLR和SII比较
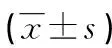
表2 NLR、MLR、PLR和SII水平与宫颈上皮内瘤变级别的关系

表3 NLR、MLR、PLR、SII对宫颈癌和宫颈癌前病变鉴别诊断的效能评价

图1 NLR、MLR、PLR和SII诊断宫颈癌的ROC曲线
2.4年龄及临床病理特征与NLR、MLR、PLR、SII的关系分析 以NLR、MLR、PLR和SII的最佳诊断截断值对宫颈癌患者进行分层后分析发现:NLR≥2.11患者中肿瘤浸润深度≥深肌层、FIGO分期为Ⅲ~Ⅳ期和有淋巴结转移的例数明显多于NLR<2.11患者,差异有统计学意义(P<0.05)。MLR≥0.20患者中肿瘤浸润深度≥深肌层、FIGO分期为Ⅲ~Ⅳ期和有淋巴结转移的例数明显多于MLR<0.20患者,差异有统计学意义(P<0.05)。SII≥662.29患者中肿瘤浸润深度≥深肌层、FIGO分期为Ⅲ~Ⅳ期和有淋巴结转的移例数明显多于SII<662.29患者,差异有统计学意义(P<0.05)。PLR≥120.81患者中肿瘤分期为Ⅲ~Ⅳ期和有淋巴结转移的例数明显多于PLR<120.81患者,差异有统计学意义(P<0.05)。但分层后不同NLR、MLR、PLR和SII患者在年龄、组织类型及分化程度方面比较,差异无统计学意义(P>0.05)。见表4。

表4 年龄、临床病理特征与NLR、MLR、PLR和SII的关系(n=67)
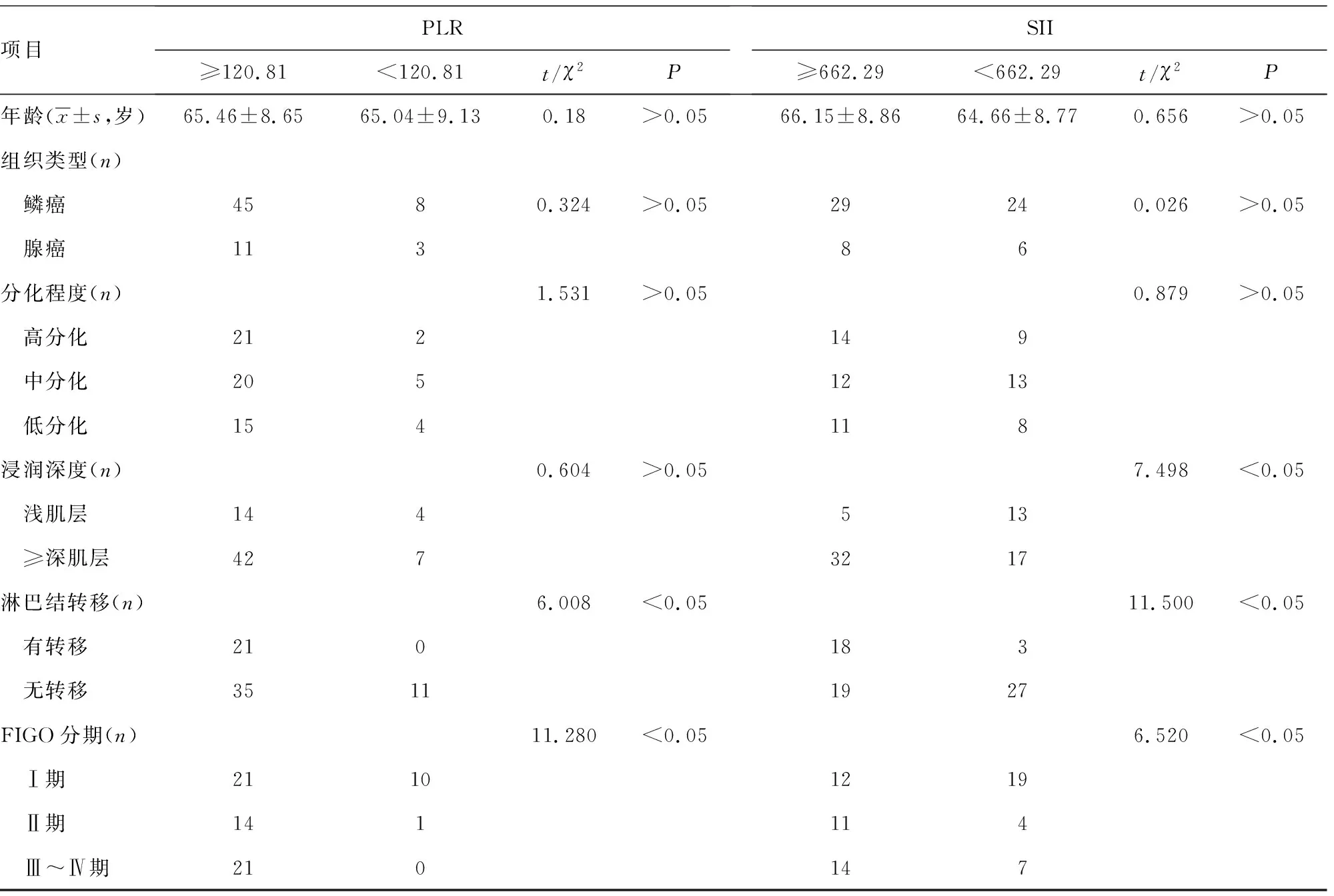
项目PLR≥120.81<120.81t/χ2PSII≥662.29<662.29t/χ2P年龄(x±s,岁)65.46±8.6565.04±9.130.18>0.0566.15±8.8664.66±8.770.656>0.05组织类型(n) 鳞癌4580.324>0.0529240.026>0.05 腺癌11386分化程度(n)1.531>0.050.879>0.05 高分化212149 中分化2051213 低分化154118浸润深度(n)0.604>0.057.498<0.05 浅肌层144513 ≥深肌层4273217淋巴结转移(n)6.008<0.0511.500<0.05 有转移210183 无转移35111927FIGO分期(n)11.280<0.056.520<0.05 Ⅰ期21101219 Ⅱ期141114 Ⅲ~Ⅳ期210147
3 讨 论
虽然随着醋酸染色、人乳头瘤病毒DNA检测及液基薄层细胞等检测方法的应用,宫颈癌的筛查取得了较大的进展,但是在不发达地区的基层医院由于不具备开展这些检测的能力,无法进行有效筛查,导致大多数宫颈癌患者被发现时已处于晚期而无法进行有效治疗[2-4]。因此,有必要寻找一些简单、廉价,并且可以常规检测的标记物进行宫颈癌早期筛查。
炎性反应在肿瘤的发生、发展、侵袭和转移中均发挥着重要作用[15-16]。有研究结果显示,中性粒细胞可改变肿瘤周围环境,使正常细胞向肿瘤细胞转化,并且可诱导肿瘤细胞增殖、转移,而淋巴细胞是机体重要的免疫细胞,对肿瘤起到监视、杀灭作用,淋巴细胞减少,可促进肿瘤浸润、转移的发生[17-18]。血小板也存在于肿瘤微环境中,对肿瘤细胞的增殖有促进作用[15]。但是单独使用以上指标作为标志物对肿瘤进行研究的效果并不好[19]。因此,反映中性粒细胞、淋巴细胞、单核细胞和血小板相对变化的复合参数——NLR、MLR、PLR和SII已成为当前研究的热点,并且已在肾透明细胞癌[7]、肝内胆管癌[9]、甲状腺癌[10]、结直肠癌[11]和膀胱癌[16]等肿瘤诊断中得到了应用。目前,关于这些复合炎性反应指标在宫颈癌中的疗效和预后评估方面的研究较多,但是对宫颈癌前病变和宫颈癌的鉴别诊断方面的研究还较少[1,6,19]。
本研究首先对宫颈癌、宫颈癌前病变和健康女性的外周血NLR、MLR、PLR和SII进行了比较,发现宫颈癌组的NLR、MLR、PLR和SII明显高于宫颈癌前病变组和对照组,差异有统计学意义(P<0.05),表明宫颈癌的发生、发展与炎性反应关系密切。这与以往研究发现中性粒细胞可以促进肿瘤细胞的生长和转移,血小板具有促进肿瘤分化作用,而淋巴细胞具有免疫监测作用,在癌症的发生和发展过程中免疫监测的功能逐渐降低的研究结论一致[10-13]。另外,本研究还对不同级别上皮内瘤变的宫颈癌前病变患者的NLR、MLR、PLR和SII进行分析,发现NLR、MLR、PLR和SII 4项参数随着上皮内瘤变级别的升高逐渐升高(P<0.05),表明炎症细胞在宫颈癌前病变的发展过程中也起着重要的作用,这与方虹等[20]的研究结果一致。
本研究在发现宫颈癌患者外周血NLR、MLR、PLR和SII明显高于宫颈癌前病变患者的基础上,进一步分析了NLR、MLR、PLR和SII鉴别诊断宫颈癌和宫颈癌前病变的能力,发现SII的AUC在4项指标中最高,SII的特异度、阳性预测值、符合率和Youden指数均明显高于其他3项指标,而灵敏度和阴性预测值低于其他3项指标,但是SII诊断宫颈癌的各项效能评价指标均大于53.00%,而其他3项指标均有低于42.00%的情况,表明SII的诊断效果优于其他3项指标。特别是NLR、MLR和PLR的特异度均低于60.00%,而SII的特异度达到81.07%,因此,在计算NLR、MLR、PLR的同时再计算SII可以明显降低假阳性率,从而能更加有效地鉴别诊断宫颈癌和宫颈癌前病变。
以外周血NLR、MLR、PLR和SII的最佳诊断截断值对宫颈癌患者进行分层后发现,NLR≥2.11、MLR≥0.20、SII≥662.29的患者中肿瘤浸润深度≥深肌层、FIGO分期为Ⅲ~Ⅳ期和有淋巴结转移的例数明显多于NLR<2.11、MLR<0.20、SII<662.29患者,差异有统计学意义(P<0.05);PLR≥120.81患者中FIGO分期为Ⅲ~Ⅳ期和有淋巴结转移的例数明显多于PLR<120.81患者,差异有统计学意义(P<0.05);但分层后在年龄、组织类型及分化程度方面比较,差异无统计学意义(P>0.05)。表明外周血NLR、MLR和SII对宫颈癌肿瘤的浸润深度、FIGO分期和淋巴结转移具有一定的预测价值,但对组织类型和分化程度无预测价值;而PLR对宫颈癌FIGO分期和淋巴结转移具有一定的预测价值,但对组织类型、肿瘤的浸润深度和分化程度无预测价值。
NLR、MLR、PLR和SII可以较好地鉴别诊断宫颈癌和宫颈癌前病变,特别是SII可以明显提高鉴别诊断的特异度。同时NLR、MLR和SII还对宫颈癌肿瘤的浸润程度、FIGO分期和淋巴结转移具有一定的预测价值,PLR对宫颈癌FIGO分期和淋巴结转移具有一定的预测价值。由于NLR、MLR、PLR和SII是由血常规参数计算所得的一种简单、廉价且常规检测就可以获得的复合型炎性反应指标,属于住院必查项目,不会增加患者经济负担,所以适合不发达地区的基层医院用于宫颈癌的筛查,但作为非特异性的炎性反应指标也有一定的临床应用局限性。本研究样本量较少,其结论尚需多中心大样本数据来证实和完善。
