miR-124-3p通过靶向Rab11a缓解创伤性脑损伤引起的氧化应激和炎性反应*
2021-05-26何买定余慧敏杨永花苏文兵
何买定,余慧敏,杨 伟,杨永花,苏文兵
云南省曲靖市第一人民医院康复医学科,云南曲靖 655000
创伤性脑损伤(TBI)是一种由于外部原因引起的颅脑损伤,当脑组织挫伤后,大量炎症因子释放,氧自由基过载引起海马神经元细胞氧化应激,进一步促进TBI的发展[1-2],因此,深入探讨引起神经元细胞氧化应激和炎性反应的分子机制,对临床治疗TBI极为重要。研究发现,微小RNA(miRNA)在TBI引起的氧化应激和炎性反应中具有重要调控作用[3-5],其中miR-124-3p在TBI后表达下调,上调miR-124-3p能抑制炎症因子释放,缓解TBI的发展[6]。脑Ras相关蛋白11a(Rab11a)是一种小分子GTP酶,主要参与调节细胞内吞再循环过程,近年有研究发现Rab11a能促进TBI的发展进程[7],但有关miR-124-3p通过调控Rab11a表达缓解TBI引起的氧化应激和炎性反应的研究,目前鲜有报道。为此,本研究将重点探讨miR-124-3p/Rab11a分子轴在TBI引起的氧化应激和炎性反应中的作用,为临床治疗TBI提供一定研究方向。
1 材料与方法
1.1细胞与主要试剂 小鼠海马神经元(HT22)细胞为BNCC细胞库产品(中国北纳),DMEM培养基和GeneJET RNA 纯化试剂盒为Thermo Fisher公司产品(美国);SYBR Green qPCR 主混合液购自Med Chem Express公司(美国);qPCR HifairTM Ⅲ 1st Strand cDNA化学合成超混合液购自上海翊圣生物科技有限公司;PCR引物、miR-124-3p mimic/inhibitor由GenePharma公司构建(中国);pmirGLO荧光素酶靶表达载体及Dual-Luciferase®报告检测系统购自Promega公司(美国);活性氧(ROS)活性测定试剂盒购于AmyJet Scientific公司(中国);免疫印迹一抗及二抗均购自Abcam公司(英国)。
1.2方法
1.2.1HT22细胞的培养、过氧化氢(H2O2)处理及转染 将HT22细胞置于含10%胎牛血清的DMEM培养基中,在37 ℃、5% CO2条件的培养箱中培养,取对数生长期细胞为空白对照组(BC组);取10 μmol/L H2O2加入HT22细胞培养基中处理12 h,为氧化应激对照组(OSC组);HT22细胞在H2O2处理后,根据LipofectamineTM2000 检测试剂盒说明书转染miR-124-3p mimic、sh-Rab11a和sh-Rab11a+miR-124-3p inhibitor,分别为miR-124-3p mimic组、sh-Rab11a组和sh-Rab11a+miR-124-3p inhibitor组。设3个复孔,转染48 h后置荧光显微镜下观察细胞的转染效果。
1.2.2实时荧光定量PCR(RT-qPCR)检测miR-124-3p和炎症因子mRNA的表达 采用RNA提取试剂盒提取各组细胞的总RNA,用反转录试剂盒对总RNA进行反转录,反转录反应体系(20 μL):10 μL变性后反应液、4 μL 5×PrimeScript缓冲液、0.5 μL RNase Inhibitor、1.0 μL PrimeScript RTase、4.5 μL dH2O。反转录反应条件:30 ℃ 10 min;45 ℃ 60 min,40个循环。根据SYBR Green qPCR主混合液试剂盒说明书检测mRNA的表达,以U6为检测miR-124-3p的内参对照,以甘油醛-3-磷酸脱氢酶(GAPDH)为检测炎症因子的内参对照。引物序列见表1。RT-qPCR反应体系(20 μL):2.0 μL反转录产物、10.0 μL SYBR Green qPCR主混合液、0.4 μL ROX Reference Dye、上下游引物(10 μmol/L)各0.8 μL、6.0 μL dH2O。RT-qPCR反应条件:95 ℃ 5 min;94 ℃变性30 s,60 ℃退火30 s,35个循环。试验结果用2-ΔΔCt法计算,每个实验重复3次。

表1 各项靶标的引物
1.2.3Western blot检测Rab11a及氧化应激相关蛋白的表达 收集各组细胞提取总蛋白,并检测硒蛋白N1(SEPN1)、谷胱甘肽过氧化物酶1(GPX1)和诱导型一氧化氮合酶(iNOS)蛋白表达水平;SDS-PAGE分离蛋白条带后,采用半干转膜法进行转膜,用5%脱脂奶粉避光室温孵育1 h,加入一抗(1∶1 000),4 ℃条件下孵育并过夜;弃去一抗,洗膜缓冲液洗涤后,加入二抗(1∶2 000),37 ℃避光孵育1 h后,采用增强化学发光(ECL)液进行显膜色,凝胶成像仪曝光观察,拍照记录,并用Image J软件进行灰度定量分析。
1.2.4ROS活性检测 收集处理后的各组细胞(2×105个/mL)重悬于稀释好的DCFH-DA溶液中,于37 ℃、5% CO2细胞培养箱内培养20 min;培养期间颠倒混匀4~5次;取出细胞后,采用无血清培养基洗涤3次;采用500 μL无血清培养基,加入到96孔板中,并吹打,在荧光酶标仪激发波长488 nm处和发射波长525 nm处检测荧光强度。
1.2.5双荧光素酶报告基因试验验证miR-124-3p对Rab11a的靶向调控 扩增Rab11a基因3′-UTR片段,将miR-124-3p与Rab11a结合部位的序列及其突变体序列插入到pmirGLO 荧光素酶靶表达载体构建载体,将miR-124-3p mimic与pmirGLO-Rab11a-WT/MUT重组质粒,对照组与LipofectamineTM2000脂质体混合后转染HEK 293T细胞,转染48 h后,根据Dual-Luciferase®报告检测系统检测荧光素酶活性。
1.3观察指标 比较各组miR-124-3p表达、SEPN1、iNOS和GPX1蛋白表达,以及caspase 1、白细胞介素1β(IL-1β)、白细胞介素18(IL-18)、肿瘤坏死因子α(TNF-α)和ROS水平。
1.4统计学处理 采用SPSS20.0统计软件进行数据处理及统计分析,采用GraphPad Prism 7.0软件进行绘图。两组间比较采用t检验,多组间比较采用方差分析。以P<0.05为差异有统计学意义。
2 结 果
2.1过表达miR-124-3p对H2O2处理细胞的氧化应激和炎症因子水平的影响 与BC组比较,OSC组中miR-124-3p表达、SEPN1和GPX1蛋白表达下调,但caspase 1、IL-1β、IL-18、TNF-α、iNOS蛋白表达和ROS水平上调,差异均有统计学意义(P<0.05)。与OSC组比较,miR-124-3p mimic组中miR-124-3p表达上调,SEPN1和GPX1蛋白表达上调,而caspase 1、IL-1β、IL-18、TNF-α、iNOS蛋白表达和ROS水平下调,差异均有统计学意义(P<0.05)。miR-124-3p mimic组与BC组比较,所有检测指标水平差异均无统计学意义(P>0.05)。见表2和图1。
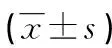
表2 过表达miR-124-3p对H2O2处理HT22细胞的氧化应激和炎症因子水平的影响
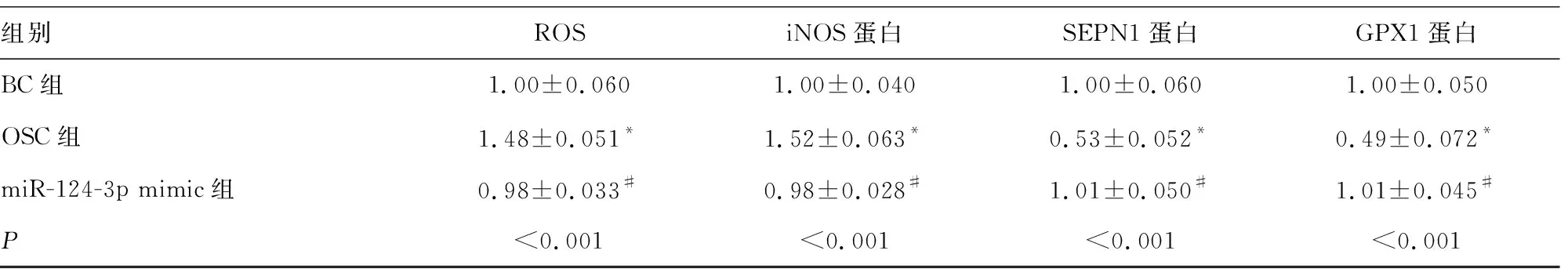
组别ROSiNOS蛋白SEPN1蛋白GPX1蛋白BC组1.00±0.0601.00±0.0401.00±0.0601.00±0.050OSC组1.48±0.051*1.52±0.063*0.53±0.052*0.49±0.072*miR-124-3p mimic组0.98±0.033#0.98±0.028#1.01±0.050#1.01±0.045#P<0.001<0.001<0.001<0.001
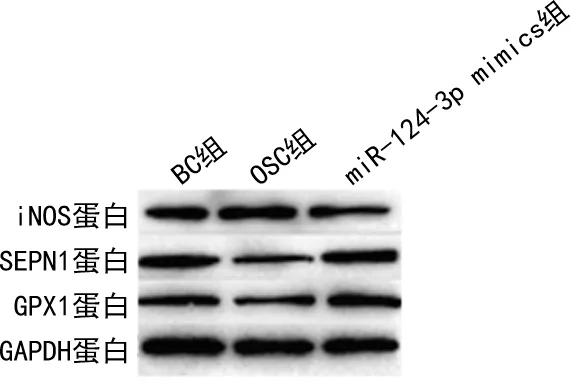
图1 过表达miR-124-3p抑制H2O2处理HT22细胞产生氧化应激相关蛋白表达
2.2miR-124-3p靶向调控Rab11a的表达 从starBase数据库预测发现Rab11a是miR-124-3p潜在下游靶基因(图2A)。与BC组比较,miR-124-3p mimic组中野生型Rab11a的mRNA和蛋白的表达降低,差异有统计学意义(P<0.05),突变型Rab11a中mRNA差异无统计学意义(P>0.05)。见表3和图2。
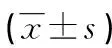
表3 相对荧光强度和Rablla表达水平
2.3miR-124-3p通过下调Rab11a抑制H2O2处理HT22细胞氧化应激和炎性反应 与OSC组比较,sh-Rab11a组中Rab11a、iNOS蛋白、ROS、caspase 1、IL-1β、IL-18及TNF-α水平下调,SEPN1和GPX1蛋白表达上调,差异均有统计学意义(P<0.05)。与sh-Rab11a组比较,sh-Rab11a+miR-124-3p inhibitor组中Rab11a、iNOS蛋白、ROS、caspase 1、IL-1β、IL-18表达上调,TNF-α、SEPN1和GPX1蛋白表达下调,差异均有统计学意义(P<0.05)。sh-Rab11a+miR-124-3p inhibitor组与OSC组比较,所有检测指标差异无统计学意义(P>0.05)。见表4和图3。
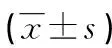
表4 miR-124-3p通过Rab11a对H2O2诱导HT22细胞产生氧化应激和炎性反应的影响
组别TNF-αROSiNOS蛋白SEPN1蛋白GPX蛋白OSC组1.00±0.0401.00±0.0601.00±0.0701.00±0.0501.00±0.090sh-Rab11a组0.46±0.043*0.46±0.044*0.66±0.046*1.48±0.034*1.68±0.034*sh-Rab11a+miR-124-3p inhibitor组1.01±0.056#0.98±0.033#0.98±0.033#0.96±0.043#1.02±0.038#P<0.001<0.001<0.001<0.001<0.001

注:A为miR-124-3p和Rab11a的结合位点;B为Western blot检测Rab11a蛋白表达水平。
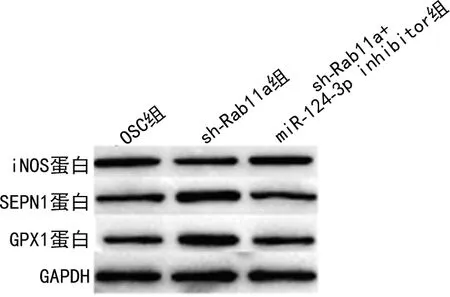
图3 miR-124-3p通过下调Rab11a抑制H2O2处理HT22细胞产生氧化应激相关蛋白表达
3 讨 论
TBI是一种神经外科常见急重症,其发生率占全身各部位创伤的9%~21%,病死率及致残率处于全身各部位创伤首位[8-9]。当脑组织挫伤、颅脑结构被破坏后,血脑屏障失去功能,外周血循环中的中性粒细胞、单核巨噬细胞等浸入受损脑组织,启动一连串分子反应,诱导大量炎症因子长时间释放,氧自由基过载并堆积造成活性氧与抗氧化系统之间的平衡失调[10-11],致使海马神经元细胞等多种细胞发生氧化应激和炎性反应,进一步引起继发性脑损伤[12-13]。本研究采用H2O2处理HT22细胞,发现caspase 1、IL-1β、IL-18、TNF-α及ROS水平均明显升高,氧化应激相关蛋白SEPN1和GPX1表达降低,而iNOS蛋白表达水平上调,表明H2O2处理能促进HT22细胞产生氧化应激和炎性反应。此结果与ZHANG等[10]研究一致,且本研究以此为基础构建TBI细胞模型,进一步探讨miR-124-3p/Rab11a分子轴对TBI引起的氧化应激和炎性反应的作用。
非编码miRNA在近年来的研究中多次被报道参与了原发性和继发性TBI的发展进程,并通过自身水平变化促进或缓解TBI由原发性向继发性的恶性转变[14]。此外,miRNA也被证实在TBI氧化应激和炎性反应中具有重要调节作用,如LV等[15]研究发现上调miR-let-7c-5p能抑制caspase 3、IL-1β等炎症因子释放,缓解继发性TBI发展;miR-124-3p在发生TBI后呈低表达,过表达miR-124-3p能靶向调控下游蛋白表达,抑制神经元发生炎性反应[16-17]。本研究采用H2O2处理HT22细胞构建TBI细胞模型,发现在氧化应激和炎性反应环境中,miR-124-3p明显低表达,过表达miR-124-3p能恢复由H2O2诱导的炎症因子caspase 1、IL-1β和IL-18,以及SEPN1、GPX1和iNOS蛋白的特异性表达。本研究结果与VUOKILA等[16]的研究结论一致,此外还进一步证实,过表达miR-124-3p能下调ROS水平,从而缓解HT22细胞所产生的氧化应激。
Rab11a属于小GTPase超家族的Rab家族,是一种小分子GTP酶,主要参与细胞内吞再循环过程。研究发现,Rab11a参与调节自噬的早、晚期,可促进神经元细胞的自噬[18]和炎症因子的分泌[19-20],进一步介导继发性TBI的发展。本研究通过生物信息学预测发现Rab11a是miR-124-3p的潜在靶基因。H2O2处理HT22细胞后,HT22细胞中Rab11a高表达,且Rab11a能够促进HT22细胞氧化应激和炎性反应,此结果与POEHLER等[18]的研究结论一致。此外本研究进一步证实,miR-124-3p通过靶向下调Rab11a能下调炎症因子caspase 1、IL-1β、IL-18及ROS水平,上调SEPN1和GPX1蛋白的表达,并下调iNOS蛋白水平,从而缓解HT22细胞的氧化应激和炎性反应。
综上所述,本研究通过模拟体内TBI产生氧化应激和炎性反应环境,从细胞水平证实,miR-124-3p通过靶向下调Rab11a的表达水平,从而缓解TBI引起的氧化应激和炎性反应。
