肝细胞肝癌患者血清SDF-1、MCP-1水平及临床意义*
2021-05-26黄培芝刘灵芝赵钢艳何树光
黄培芝,刘灵芝,汪 柳,赵钢艳,吴 芳,何树光
湖南中医药高等专科学校附属第一医院检验科,湖南株洲 412000
肝细胞肝癌(HCC)是常见的消化系统恶性肿瘤,我国每年因肝癌死亡人数达35.81万人,HCC病死率达25.85/100 000[1]。虽然近年来外科手术、介入栓塞术等新的治疗手段提高了临床治疗HCC的疗效,改善了HCC患者的生存预后,但由于患者早期临床表现不明显,一旦出现肝区疼痛、巩膜黄染、消瘦等表现时已处于中晚期,失去最佳手术时机[2]。甲胎蛋白(AFP)是常用的诊断HCC的肿瘤标志物,但临床上发现约40%的HCC患者AFP无异常变化,并且AFP在肝炎、肝硬化,以及睾丸癌等恶性肿瘤中也会出现表达升高的现象[3]。因此,深入探讨HCC的疾病发生、发展机制,寻找能够早期诊断并具有较高特异度的血清肿瘤标志物具有重要意义。基质细胞衍生因子-1(SDF-1)又称CXCL12,位于10q11.21,编码蛋白属于基质细胞衍生的α趋化因子家族成员,可充当G蛋白偶联受体、趋化因子受体4的配体,参与胚胎发育、免疫监视及肿瘤生长和转移等多种病理、生理过程[4]。有研究表明,肿瘤中存在SDF-1异常高表达的现象,并且能够分泌到患者外周血中,检测患者外周血SDF-1水平有利于肿瘤的早期诊断及预后判断[5]。单核细胞趋化蛋白-1(MCP-1)也称CCL2,基因位于17q12,该基因编码蛋白属于趋化因子CC亚家族成员,结构上具有两个相邻的半胱氨酸残基,能与趋化因子受体CCR2和CCR4结合,对单核细胞和嗜碱性粒细胞具有趋化活性,参与免疫调节和炎性反应过程。有研究表明,肿瘤中MCP-1的异常表达升高能够作为旁分泌生长因子促进肿瘤细胞的增殖,诱导肿瘤血管的新生,导致肿瘤的恶性进展[6]。目前,关于SDF-1、MCP-1在肝癌患者血清中的表达水平及意义的相关报道较少,本研究通过分析SDF-1、MCP-1在肝癌患者血清中的表达,探讨二者的临床意义。
1 资料与方法
1.1一般资料 选取2018年4月至2020年4月本院诊治的179例HCC患者纳入HCC组,其中男99例,女80例;年龄34~73岁,平均(43.6±6.2)岁;肿瘤最大径<3 cm者96例,≥3 cm者83例;肿瘤TNM分期Ⅰ~Ⅱ期126例,Ⅲ~Ⅳ期53例;肿瘤分化:高中分化104例,低分化75例;伴远处转移25例,无远处转移154例;AFP<400 ng/mL者101例,≥400 ng/mL者78例。纳入标准:(1)HCC的诊断参考2015年《原发性肝癌规范化病理诊断指南》诊断标准[7]。(2)HCC患者均为首次诊治,既往未接受过其他治疗。(3)患者无严重肝肾功能障碍。排除标准:(1)合并肝脓肿、结核分枝杆菌感染等。(2)梅毒螺旋体抗体阳性。(3)合并自身免疫性疾病。68例肝良性病变患者纳入病例对照组,其中男41例,女27例;年龄33~77岁,平均(41.5±6.2)岁。62例体检健康人员作为健康对照组,其中男35例,女27例;年龄32~78岁,平均(44.5±7.2)岁。3组间性别、年龄比较,差异无统计学意义(P>0.05)。本研究经本院医学伦理委员会审核批准后进行,患者及家属对本研究知情同意并已签字。
1.2方法 采集所有研究对象清晨空腹静脉血5 mL,乙二胺四乙酸(EDTA)抗凝,室温静置1 h,2 500 r/min离心10 min,离心半径10 cm,吸取上层血清在—80 ℃冰箱保存。通过酶联免疫吸附试验(ELISA)检测各组研究对象血清SDF-1、MCP-1水平。人SDF-1、MCP-1 ELISA检测试剂盒购自Abcam公司,批号分别为ab100637、ab179886,检测严格按照相关说明书操作。SDF-1检测范围为0.94~6.00 μg/L,MCP-1检测范围为4.70~300.00 pg/mL。采用电化学发光法应用Cobase601电化学发光免疫分析仪对血清AFP进行检测,AFP试剂盒购自Roche公司。
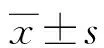
2 结 果
2.1各组血清SDF-1、MCP-1水平比较 3组间血清SDF-1、MCP-1水平比较,差异有统计学意义(P<0.05)。HCC组血清SDF-1、MCP-1水平明显高于病例对照组及健康对照组,差异有统计学意义(P<0.05)。病例对照组与健康对照组血清SDF-1、MCP-1水平比较,差异无统计学意义(P>0.05)。见表1。
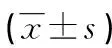
表1 各组血清SDF-1、MCP-1水平比较
2.2不同特征HCC患者血清SDF-1、MCP-1水平比较 TNM分期Ⅲ~Ⅳ期、低分化HCC患者血清SDF-1、MCP-1水平明显高于TNM分期Ⅰ~Ⅱ期、高中分化HCC患者,差异有统计学意义(P<0.05)。不同性别、年龄、肿瘤最大径、血清AFP水平及远处转移情况患者血清SDF-1、MCP-1水平比较,差异无统计学意义(P>0.05)。见表2。
2.3HCC组患者血清SDF-1与MCP-1水平的相关性 血清SDF-1与MCP-1水平在HCC患者中的表达呈正相关(r=0.612,P<0.001)。

表2 不同特征HCC患者血清SDF-1、MCP-1水平比较
2.4血清SDF-1、MCP-1单独及联合检测对HCC的诊断价值 血清SDF-1、MCP-1单独诊断时取约登指数最大时的值作为最佳截断值,二者同为阳性或阴性时诊断为阳性或阴性,一阴一阳时,阳性诊断参考SDF-1指标(灵敏度较高),阴性诊断参考MCP-1指标(特异度较高),并结合临床医师的观点综合判断。血清SDF-1、MCP-1单独及联合检测的ROC曲线下面积(AUC)分别为0.839、0.741、0.913,见表3和图1。

表3 血清SDF-1、MCP-1单独及联合检测对HCC的诊断价值

图1 血清SDF-1、MCP-1单独及联合检测对HCC的诊断价值
3 讨 论
肝癌是消化系统常见的恶性肿瘤,全球每年新发病例约78.2万,死亡例数约74.5万,并且肝癌的发病率有逐渐升高的趋势,严重威胁人类健康[8]。肝癌的病理类型分为HCC、肝内胆管细胞癌和混合型3种,其中以HCC最为常见。临床上HCC的治疗包括手术治疗、介入治疗、靶向药物治疗及免疫治疗等,但部分患者即使经积极治疗后仍可出现复发及远处转移,导致患者预后不佳[9]。因此,有必要研究HCC的发病机制,寻找新的HCC肿瘤标志物。有学者报道,肿瘤的发生、发展与肿瘤微环境密切相关,特别是肿瘤微环境中的免疫细胞,如T淋巴细胞、巨噬细胞等的功能异常可导致肿瘤细胞发生免疫逃逸,促进肿瘤的发生和发展[10]。
SDF-1基因位于人类10号染色体,其编码蛋白是一种趋化因子,主要由骨髓基质细胞分泌,具有促进骨髓、血管、淋巴管生成的作用。研究表明,乳腺癌、前列腺癌等肿瘤中存在SDF-1表达水平升高的现象,其能够通过结合其配体CXCR4,促进肿瘤的恶性进展,与患者的不良预后密切相关[11]。本研究结果显示,HCC组血清SDF-1水平明显高于病例对照组及健康对照组,其机制可能与转录后表达调控异常有关。有学者报道,肿瘤中微小RNA-137表达水平降低,导致其SDF-1信使RNA的稳定性升高,促进肿瘤细胞SDF-1的表达水平升高[11]。此外,TNM分期Ⅲ~Ⅳ期、低分化HCC患者血清SDF-1、MCP-1水平明显高于TNM分期Ⅰ~Ⅱ期、高中分化HCC患者,差异有统计学意义(P<0.05),表明SDF-1的高表达可能参与促进HCC中肿瘤细胞的恶性进展。有研究结果显示,肿瘤细胞中SDF-1能够通过自分泌或旁分泌的方式,与细胞表面的CXCR4配体结合,进而激活细胞内核因子κB信号通路,促进下游癌基因如c-myc的表达,导致肿瘤细胞过度增殖[12-13]。此外,SDF-1还可通过激活蛋白激酶B,抑制促凋亡因子如Bax的表达,促进抗凋亡基因如Bcl-2等的表达,抑制肿瘤细胞的程序性细胞死亡,导致肿瘤的分期升高[14-15]。
MCP-1基因位于人类17号染色体,其编码蛋白包括76个氨基酸,可由正常组织细胞、内皮细胞及免疫细胞等分泌产生。近年来研究表明,在胶质瘤、前列腺癌等肿瘤中均存在MCP-1表达升高的现象,其能够结合其配体CCR2,促进肿瘤细胞内磷脂酰肌醇3激酶的磷酸化激活,导致肿瘤细胞的无限增殖[16-17]。本研究结果显示,HCC组血清中MCP-1表达明显高于病例对照组及健康对照组。分析其原因,可能是肿瘤微环境中的肿瘤相关巨噬细胞释放MCP-1增多,导致血清中MCP-1水平升高,MCP-1 能够招募大量单核细胞进入肿瘤组织,形成免疫抑制的微环境,促进肿瘤的恶性进展[18]。此外,HCC组患者血清MCP-1的表达与肿瘤TNM分期关系密切,其原因可能是MCP-1能结合肿瘤细胞表面的CXCR4,激活蛋白激酶B信号通路,促进下游c-myc等癌基因的表达,导致肿瘤细胞的恶性增殖,引起肿瘤分期升高[19]。此外,肿瘤细胞分泌的MCP-1能够趋化单核巨噬细胞进入肿瘤组织局部,进而分泌产生血管内皮生长因子、转化生长因子β等,促使肿瘤细胞发生上皮-间质转化,导致HCC细胞的迁移、侵袭等生物学过程[20]。本研究进一步分析血清SDF-1、MCP-1表达对HCC的诊断价值,结果表明SDF-1与MCP-1联合检测诊断HCC的灵敏度为82.1%,高于二者单独检测。以往研究表明,AFP对肝癌诊断的灵敏度为70%~80%,特异度为70%~90%。虽然本研究SDF-1、MCP-1单一指标诊断HCC的特异度并不优于AFP,但SDF-1、MCP-1联合检测的灵敏度明显升高,表明联合检测血清SDF-1与MCP-1水平有可能成为潜在的HCC诊断标志物,值得临床深入研究。本研究中,HCC患者血清中SDF-1与MCP-1水平呈显著正相关(r=0.612,P<0.001)。有学者报道,肿瘤处于一种缺氧的微环境中,肿瘤细胞缺氧导致缺氧诱导因子1A(HIF-1A)表达水平升高,HIF-1A能够直接结合SDF-1、MCP-1的启动子区,促进两者的表达[21]。但HCC中SDF-1与MCP-1的相互作用机制有待深入研究。
综上所述,HCC患者血清SDF-1、MCP-1表达上调,二者水平呈显著正相关。HCC患者血清SDF-1、MCP-1水平与肿瘤TNM分期及肿瘤分化程度关系密切。联合检测血清SDF-1、MCP-1可能成为新的诊断HCC的方法。
