两种胃癌细胞株与小鼠原代脾脏淋巴细胞共培养对Th17细胞分化的影响
2021-05-26刘畅陈阳叶佳朱梅萍
刘畅,陈阳,叶佳,朱梅萍
1.上海中医药大学附属曙光医院消化科,上海 201203;2.上海中医药大学附属岳阳中西医结合医院急诊内科,上海 200437
T 淋巴细胞作为免疫反应的中心环节,在胃癌的发生发展中扮演了重要角色,胃癌发生发展过程中广泛存在辅助性T 细胞(helper T cell,Th)亚群免疫紊乱现象。Th17细胞是胃癌组织中最丰富的CD4+T细胞亚群[1]。自2008 年起,有关胃癌患者肿瘤组织及外周血中Th17 细胞数量增多及RORγt 及IL-17 表达增加的报道相继涌现[2-3]。但是,胃癌环境下CD4+T细胞分化还罕有报道。本研究通过将人胃癌SGC-7901细胞株及人胃癌BGC-823 细胞株与小鼠原代脾脏淋巴细胞共培养,以细胞内细胞因子染色FCM 测定Th17 细胞,观察上述胃癌环境对Th17细胞分化的影响。
1 材料与方法
1.1 实验动物 小鼠来自上海斯莱克实验动物有限责任公司,实验动物生产许可证号:SCXK(沪)2007-00058。饲养于上海钰森生物实验公司,饲养条件为SPF级。
1.2 实验材料 人胃癌SGC-7901细胞株及人胃癌BGC-823 细胞株均来自来自上海钰森生物实验公司;CD3 ε 抗 体 来 自Miltenyi 公 司;IL-17A 抗 体、Cytofix/Cytoperm W/Golgi Stop KitCD4-PE 抗体、CD62L-FITC 抗体均来自BD 公司;胎牛血清及1640培养基来自Gibco公司。
1.3 实验方法
1.3.1 小鼠原代脾脏淋巴细胞分离、分析及鉴定 (1)准备含2%青链霉素的磷酸盐缓冲液(PBS),4℃预冷。(2)在洁净环境中取下小鼠脾脏组织,放入预冷的含2%青链霉素的PBS中。(3)在预冷的含2%青链霉素的PBS中剥离去除其他多余组织,并漂洗3遍。(4)把脾脏组织放入一个干净的6 cm 盘中,用20 mL注射器的活塞胶体部分轻柔碾压脾脏组织,待组织全部碾碎后加入3 mL PBS 重悬细胞,过筛。(5)将收集的脾单细胞悬液缓慢加入预先加有等量小鼠淋巴细胞分离液的离心管中,2 000 r/min离心15 min。(6)小心吸取单个核细胞,移入另一离心管中,加入CD4 及CD62L 抗体孵育后,进行流式分选。(7)分选后的细胞,PBS洗涤两次,在流式细胞分析仪上进行检测,测定分选后细胞的纯度。
1.3.2 细胞分组 试验分为SGC-7901 共培养组、BGC-823共培养组和对照组,分别进行以下操作:(1)24 孔细胞培养板提前1 d 用CD3ε单抗进行包被,4℃孵育过夜。(2)分选后的CD4+CD62L+naiveT 细胞用加有10%热灭活胎牛血清的1640 培养基,调整细胞浓度为1×107/mL。(3) SGC-7901 共培养组及BGC-823 共培养组分别将提前种板的SGC-7901 或BGC-823 细胞去上清,用无菌PBS 洗涤两遍后,加入1×107个naiveT 细胞,共培养6 h。对照组将1×107个naiveT细胞加入空板并培养6 h。
1.4 Th17 细胞流式检测 (1)共培养后,将各组细胞悬液离心,用无菌PBS 洗涤两遍,并转移至新的培养皿中,并加入新鲜培养基,继续培养12 h;倒置显微镜观察细胞生长状态。(2)取上述细胞悬液置于48孔培养板内,每孔1 mL,并加丙二醇甲醚醋酸酯(PMA)(50 μg/L)、离子霉素(1 μmol/L)和蛋白转运抑制剂莫能菌素(2 μmol/L)以阻止细胞因子向细胞外分泌,在37℃孵箱中培育5 h。(3)流式检测各组Th17 细胞的比例,以CD4直方图设门区分Th17细胞,最终以散点图IL-17染色阳性表示Th17细胞。
1.5 统计学方法 采用SPSS21.0统计学软件对各组数据进行分析,计量数据以均数±标准差(x-±s)表示,采用独立样本t检验,以P<0.05为差异具有统计学意义。
2 结果
2.1 小鼠原代脾脏淋巴细胞分离后鉴定 经检测,分选后CD4+CD62L 双阳性细胞比例达到98%以上,可以用于下游实验,见图1和图2。
2.2 三组细胞共培养后Th17细胞流式检测 以CD4直方图设门区分Th17细胞,SGC-7901共培养组、BGC-823共培养组、对照组的CD4+IL-17A+细胞数量分别为(3.97±0.27)%、(5.17±0.14)%、(1.96±0.29)%,与对照组相比,小鼠淋巴细胞与人胃癌SGC-7901 细胞株及人胃癌BGC-823 细胞株共培养后,Th17 细胞数量均显著增多(t=-8.52、-17.141);与SGC-7901共培养组相比,BGC-823 共培养组Th17 细胞数量均显著增多,差异均具有统计学意义(t=-6.496,P<0.05)。
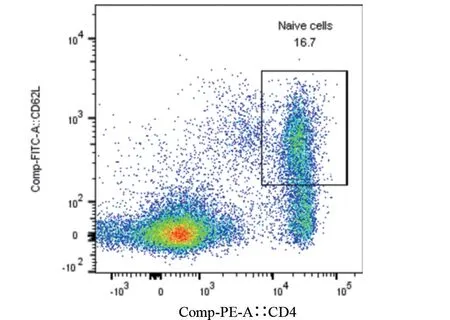
图1 CD4+CD62L双阳性细胞(分选前)
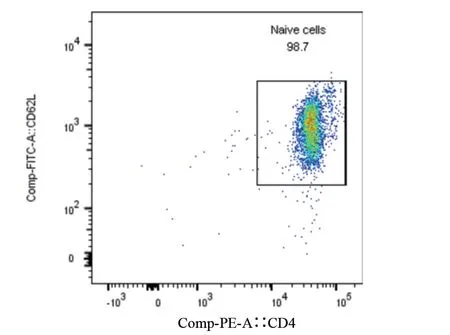
图2 CD4+CD62L双阳性细胞(分选后)
3 讨论
胃癌是世界范围内第四常见的肿瘤,是肿瘤相关死亡的第二大原因[1]。肿瘤的发生发展与免疫细胞的调节密切相关。T 淋巴细胞是免疫的中心环节,根据在免疫应答中功能的不同可分为Th细胞、调节性T细胞(regulatory T cell,Treg)和 细 胞 毒 性 相 比T 细 胞(cytotoxic T cell,Tc)。其中,Th 细胞由CD4+T 细胞分化,是辅助T、B 细胞应答的功能亚群。正常情况下,Th 细胞亚群Th1、Th2、Th17、Th9 等处于平衡状态,当受到抗原、细胞因子、抗原提呈细胞等刺激时,CD4+T细胞可向不同Th 细胞转化,不同Th 细胞间亦可相互转化。
Th17细胞是胃癌组织中最丰富的CD4+T细胞亚群[2]。自2008 年起,有关胃癌患者肿瘤组织及外周血中Th17 细胞数量增多及RORγt 及IL-17 表达增加的报道相继涌现[3-4]。在胃癌环境中,STAT3信号通路的激活介导了CD4+T细胞向Th17细胞分化[5]。
IL-17为Th17细胞最主要的效应因子,在胃癌中,IL-17 主要起促瘤作用,研究发现,在表达高水平的IL-17 mRNA 的胃癌患者肿瘤组织中,血管内皮细胞和浸润性嗜中性粒细胞的数量比在表达低水平的IL-17 mRNA 的肿瘤组织中显著增多,且肿瘤组织中IL-17 mRNA 的表达水平与肿瘤的深度、淋巴管侵润和淋巴结受累有关[6]。此外,IL-17 基因多态性、microRNA结合位点单核苷酸多态性均与胃癌密切相关[7-8]。IL-17 的促瘤机制主要包括:(1)上调血管内皮生长因子、前列腺素1、前列腺素2、巨噬细胞炎症蛋白-2 等促血管生成因子水平,激发血管内皮细胞迁移,促进血管生成以促进肿瘤增殖[6,9]。(2)扩大炎症反应,引起组织增生,诱发炎症-肿瘤效应,加剧肿瘤发展,同时减弱趋化因子依赖性的抗肿瘤反应[10]。(3)直接促进肿瘤细胞增殖及抗肿瘤细胞凋亡[10]。(4)促进淋巴管形成,参与肿瘤转移[6]。(5)通过AKT 信号通路,进一步激活STAT3,诱导沉默性胃癌干细胞转化为侵袭性胃癌干细胞[11]。因此,IL-17水平与胃癌患者预后密切相关,临床研究同样证实高血清IL-17 浓度胃癌患者五年生存率远低于低血清浓度患者[2,12]。
综上所述,胃癌环境存在CD4+T 细胞向Th17 细胞分化增多的现象,过度分化的Th17细胞又加重了胃癌的发生发展。有研究发现,IL-17 阻断剂有望在胃癌治疗中发挥作用[13-15],因此阻断Th17 细胞分化有望成为治疗胃癌的新思路。大量文献报道了胃癌患者肿瘤组织及外周血中Th17细胞数量增多的现象,本研究首次证实与两种胃癌细胞株共培养后,CD4+T细胞向Th17细胞分化均增多,而与SGC-7901共培养组相比,BGC-823共培养组Th17细胞数量显著增多,这在细胞学角度上对胃癌环境中Th17 细胞的过度分化进行了验证,后续研究可在此基础上继续开展,探索以Th17细胞为靶点的抗肿瘤手段。
