基于影像学评价正弦电磁场对大鼠股骨骨折的影响
2021-05-26侯雪峰贾鹏举高玉海吴思敏陈克明
侯雪峰,贾鹏举,柏 鑫,高玉海,任 莉,吴思敏,陈克明
骨折是人类最常见的大器官创伤[1],其愈合时间久,常给患者带来巨大的痛苦,因此如何促进骨折愈合成为目前研究的热点。随着物理学与生物学及医学的相互交叉结合,电磁场物理疗法在骨质疏松症及其他代谢性骨疾病治疗中的应用越来越广泛。研究表明,正弦电磁场(SEMFs)在特定条件参数下对胎儿成骨细胞及主动脉血管平滑肌细胞等多种细胞的增殖具有促进作用[2]。相关研究指出,暴露持续时间90 min是SEMFs发挥作用的最佳时间[3]。本课题组前期研究也显示,50 Hz的1.8 mT电磁场以波形依赖的方式影响成骨细胞的增殖和分化[4];50 Hz的1.8 mT正弦交变电磁场可通过提高骨形成降低具有骨吸收活性的相关细胞因子的表达,有效提高青年大鼠的峰值骨量,并有效抑制尾吊大鼠的骨量丢失[5-7];50 Hz、1.8 mT的SEMFs能提高大鼠股骨组织中骨代谢相关基因的表达,同时增加钙含量[8]。目前关于SEMFs的研究多集中于骨质疏松症,对于SEMFs促进骨折愈合的研究尚不多见。因此结合本课题组的前期研究,本实验主要研究治疗时间为90 min的50 Hz、1.8 mT SEMFs对大鼠股骨骨折愈合的影响。
1 材料与方法
1.1实验仪器与器械 电磁场治疗仪,病理切片扫描仪(滨松公司,日本),AG-X系列台式电子万能试验机(岛津公司,日本),High Resolutionin-vivo X-ray Microtomograph(布鲁克科技有限公司,德国),X线照片机(HOLOGIC公司,美国),钛合金克氏针(张家港市华阳医疗器械厂,中国),骨科钻(上海紫霭医疗器械有限公司,中国),可吸收缝合线(上海浦东金环医疗用品股份有限公司,中国),圆锯,手术器械。
1.2实验试剂 水合氯醛(天津大茂化学试剂公司,中国)、注射用青霉素(山东鲁抗医药股份有限公司,中国)、碘伏皮肤消毒液(上海利康消毒高科技有限公司,中国)、75%乙醇(山东利尔康医疗科技股份有限公司,中国)、0.9%氯化钠注射液(四川科伦药业股份有限公司,中国)。
1.3实验动物及处理方法 SPF级Wistar雄性大鼠40只,体质量(220±10)g,由兰州大学中国农业科学研究院兽医研究所实验动物中心提供,许可证编号:SCXK(甘)2014-0006-152。40只大鼠饲养于解放军联勤保障部队第九四〇医院SPF级动物实验中心,许可证编号:SYXK(军)2017-0047,适应性驯化1周后建立大鼠股骨开放性骨折模型。建模完成后立即摄X线片,确定大鼠建模是否成功,将建模成功大鼠随机分成模型对照组(MC组)和SEMFs治疗组(SEMFs组),每组20只,严格控制温度、湿度,自由进食水。MC组不采取任何干预措施,SEMFs组每天给予50 Hz、1.8 mT SEMFs干预90 min。
1.4检测项目与方法
1.4.1主要脏器HE染色及器官指数:开始实验8周后脱颈处死大鼠,迅速取出肝、肾、脾、心、肺,将周围脂肪及黏膜组织剥离干净,生理盐水清洗残留血液,反复清洗3遍后用滤纸吸干多余的生理盐水并称取各器官重量,计算器官指数。器官指数=器官重量/大鼠体质量×100%。
1.4.2X线检查:每2周对大鼠行X线检查,每次检查时先麻醉大鼠,然后对每只大鼠进行检查,检查体位为俯卧位。通过X线片观察各组大鼠骨痂生长情况,并根据骨痂评分标准对大鼠骨痂生长情况进行评分。骨痂评分标准:断端未见骨痂为Ⅰ级;断端边缘模糊,少见骨痂为Ⅱ级;断端边缘进一步模糊,骨痂量增多但尚未填满骨折缺损部位为Ⅲ级;断端边缘已完全消失,骨折缺损部位被骨痂填满为Ⅳ级。Ⅰ、Ⅱ、Ⅲ、Ⅳ级分别记为0、1、2、3分。
1.4.3生物力学指标检测:开始实验8周后,随机取2组大鼠各6只,过量麻醉处死大鼠,迅速分离术侧股骨,剔除股骨周围其他组织,用生理盐水浸泡过的纱布包裹于-20℃冰箱中保存。后将冻存的股骨室温解冻2 h置于AG-IS生物力学万能试验机上行三点弯曲试验,支点跨距17 mm,中点为加压点,加载速度为2 mm/min,计算机记录载荷-位移曲线,得出弹性模量、最大载荷和断裂点载荷骨生物力学指标值。
1.4.4显微CT三维重建:分别于各组开始实验4、8周后随机取3只大鼠,过量麻醉处死,取出术侧股骨,4%多聚甲醛固定后室温保存。采用SkyScan1276扫描仪,源电压85 V,源电流200 μA,中度分辨率,感兴趣区域为以骨折线为中心的前后4 mm区域。使用CTvox软件对股骨建模,使用NRecon软件进行三维重建。
1.4.5骨组织病理学检测:开始实验4周后,脱颈处死2组大鼠,迅速取出术侧股骨固定于4%多聚甲醛溶液中,1周后进行包埋、切片、染色处理,处理后使用病理切片扫描仪进行扫描,生成图像后使用NDP.veiw软件进行观察。

2 结果
2.1SEMFs安全性分析 开始实验8周后,2组大鼠主要脏器的器官指数比较差异无统计学意义(P>0.05),见图1;开始实验8周后,2组大鼠主要器官的组织病理学表现也未见明显异常改变,见图2。提示长期给予50 Hz、1.8 mT SEMFs治疗对生长期大鼠未产生明显的毒副作用。
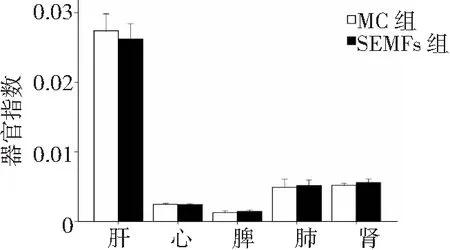
图1 开始实验8周后股骨骨折2组大鼠主要脏器器官指数

图2 开始实验8周后股骨骨折2组大鼠主要脏器的组织病理学检查结果(HE染色)
2.22组大鼠X线检查结果比较 X线检查结果显示,SEMFs组股骨骨痂生长速度及质量均明显优于MC组。开始实验4周后,SEMFs组骨折线几乎消失,骨痂大量生长形成骨桥连结,骨痂基本填满骨折缺损部位;开始实验6周后,可见骨痂进一步钙化,并且开始骨痂塑形;开始实验8周后骨痂塑形基本完成。MC组开始实验4周及6周后仍然可见明显的骨折缝隙,缝隙中骨痂含量较少,至开始实验8周后观察仅有一半的骨桥连结相对完整,另一半骨折线仍清晰可见。见图3。骨痂评分结果显示,SEMFs组各阶段骨痂评分均高于MC组(P<0.01),见图4。

图3 股骨骨折2组大鼠X线检查骨折愈合情况
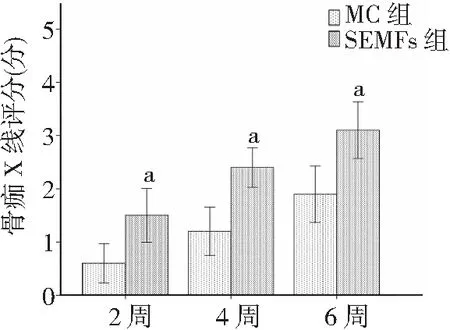
图4 股骨骨折2组大鼠X线骨痂评分比较
2.32组大鼠股骨生物力学指标检测结果比较 开始实验8周后2组大鼠股骨三点弯曲试验结果显示,SEMFs组弹性模量显著升高(P<0.01),而2组最大载荷与断裂点载荷比较差异均无统计学意义(P>0.05),见表1。提示SEMFs可增强骨折愈合后股骨的韧性。
表1 股骨骨折2组大鼠实验8周三点弯曲试验结果
2.42组大鼠显微CT结果比较 显微CT扫描结果显示,开始实验4周后SEMFs组骨折断端部位骨痂填充良好,骨桥连结完整,而MC组骨折断端部位骨痂填充较少,骨桥尚未连接。开始实验8周后,SEMFs组明显可见骨痂塑形基本结束,股骨形态基本恢复,而MC组骨痂尚未完全吸收,见图5、6。显微CT三维立体重建结果显示,SEMFs组骨痂生长塑形进程明显快于MC组,开始实验8周后SEMFs组股骨表面较MC组平整,基本恢复股骨原有形态,见图7。

图5 股骨骨折2组大鼠股骨显微CT平面横切图
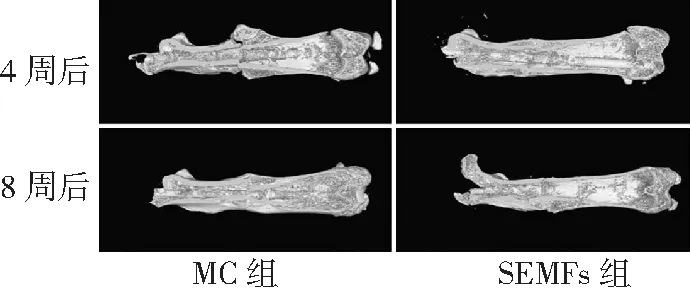
图6 股骨骨折2组大鼠股骨显微CT立体横切图
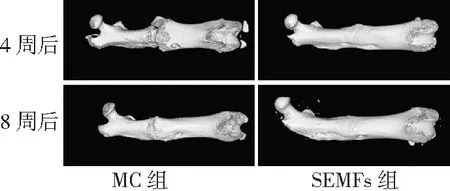
图7 股骨骨折2组大鼠股骨显微CT三维立体重建图
2.52组大鼠股骨组织病理学观察 开始实验4周后,SEMFs组骨痂组织中见大量成熟的骨组织,排列相对整齐,而MC组骨折断端主要以纤维软骨细胞为主,钙化不明显。见图8。提示SEMFs在促进骨折愈合方面具有良好效果,且无明显毒副作用。

图8 股骨骨折2组大鼠股骨组织病理学检查结果(HE染色)
3 讨论
骨折常由于跌扑撞击等外力作用导致,常通过手术解剖复位,但其修复时间漫长,且术后常有骨延迟愈合及骨不连的发生,发生率为8%~10%[9]。如何促进骨折修复,缩短病程,减轻患者痛苦成为创伤骨科的一大难题。
近年来,物理疗法因便捷有效逐渐成为医疗研究的热点。相关研究表明,电磁场作为一种可调节的恒强磁场对体内的细胞、基因、蛋白可产生多种影响[10]。本课题组前期研究证实1.8 mT的SEMFs可促进体外培养大鼠股骨组织的骨形成,提高骨组织中碱性磷酸酶活性,并抑制骨吸收,调节骨骼重塑[11]。同时本课题组研究发现,50 Hz的SEMFs具有双强度窗效应,即在1.8 mT和3.6 mT作用下最为明显[12-13];进一步研究证实,治疗时间为1.5 h的1.8 mT、50 Hz的SEMFs可促进体外培养成骨细胞的成熟及矿化[14]。除此之外,SEMFs对骨髓间充质干细胞的分化成熟也有一定影响,SEMFs以时间依赖性的方式诱导骨髓间充质干细胞成骨性分化,且以1.8 mT强度干预效果最为明显[15-17]。SEMFs发挥作用主要是通过激活Wnt10b/β-catenin、BMP-Smad及NO-cGMP-PKG等多条信号途径促进成骨细胞的分化成熟与矿化,同时通过调节成骨细胞前列腺素E2分泌影响OPG/Rankl的基因表达,进而抑制破骨细胞的骨吸收活性[18-22]。
本动物实验表明,SEMFs组X线骨痂评分明显优于MC组,且通过不同时间的X线观察可以确定SEMFs组骨折愈合速度明显加快,显微CT结果进一步表明SEMFs组的骨折修复效果优于MC组。SEMFs组骨痂组织中可见大量成熟的骨组织,排列相对整齐,而MC组骨折断端主要以纤维软骨细胞为主,钙化不明显,说明SEMFs在促进骨折愈合方面具有良好效果,且无明显的毒副作用。另外,在本实验结果中,生物力学指标未表现出明显的差异性,开始实验8周后,SEMFs组骨折塑形基本完成,而MC组尚有大量骨痂存在,可能为最大载荷及断裂点载荷未表现出差异性的原因。
综上,SEMFs对骨折愈合具有良好的促进作用,可明显促进骨痂生长,改善骨组织形态学,促进大鼠股骨骨折的愈合。本研究仅初步证明了SEMFs对骨折愈合具有一定的作用,虽然本课题组前期的体外研究已经阐明了一些作用机制,但是由于机体相对于组织细胞更系统、更复杂,故其具体作用机制仍需在体实验进一步揭示验证。
