5-氮杂-2'-脱氧胞苷对食管癌放射敏感性的影响及作用机制
2021-05-26张翠红侯春立马博敬张建军
张翠红,吕 欣,范 才,侯春立,马博敬,张建军
放射治疗是食管癌一种重要、有效的治疗手段,约80%的患者需接受放射治疗[1-2]。然而肿瘤细胞对放射线抗拒是抗肿瘤治疗失败的主要原因之一[3],所以如何提高肿瘤细胞对放射线的敏感性,在提高肿瘤局部控制率的同时降低放射线对正常组织的毒性作用是食管癌放射治疗的重要研究课题。5-氮杂-2'-脱氧胞苷(5-aza-CdR)属于核苷类似物甲基化抑制剂,不仅可以抑制DNA甲基转移酶,降低细胞分裂时DNA甲基化水平,还可以干扰RNA代谢、DNA和蛋白质合成[4-6]。研究表明,5-aza-CdR可通过与DNA甲基转移酶1共价结合形成复合物,进而抑制该酶甲基转移活性,逆转CpG岛异常甲基化、恢复肿瘤抑制因子表达,起到抑制肿瘤作用[7]。最近研究发现,5-aza-CdR可能与肿瘤的放射敏感性有密切关系[8]。但目前有关5-aza-CdR在食管癌放射敏感性方面的研究甚少。故本研究以5-aza-CdR作用于人食管癌细胞株EC9706,研究其对食管癌细胞增殖、凋亡、侵袭及放射敏感性的影响。
1 材料与方法
1.1材料和主要试剂
1.1.1食管癌细胞株:人食管癌EC9706细胞购自中国细胞资源库,用含10%胎牛血清、青霉素100 U/ml、链霉素100 μg/ml的DMEM培养基在37℃、5%CO2培养箱中培养,用0.25%胰蛋白酶消化传代。取第二、三代对数生长期细胞进行实验。
1.1.2药物及主要试剂、仪器:5-aza-CdR购自上海研谨生物有限公司;DMEM培养基及胎牛血清购自美国Gibco公司;CCK8试剂购自武汉默沙克生物科技有限公司;Annexin V-FITC/PI双染细胞凋亡试剂盒购自美国BD公司;一抗cleaved caspase-3、Bax、Bcl-2、p-ATM/ATM、β-actin及二抗购自美国Cell Signaling Technology公司;细胞裂解及蛋白抽提试剂、蛋白浓度检测试剂考马斯亮蓝、Western blot配胶试剂盒购自江苏碧云天生物技术有限公司;聚偏二氟乙烯膜、ECL发光液购自美国Millipore公司。Transwell小室购自美国Millipore公司;Matrigel购自美国BD公司。流式细胞仪购自美国BD公司。
1.2实验方法
1.2.1细胞分组及照射方法:将实验细胞分为4组:①对照组(Control组):不做任何处理;②5-aza-CdR处理组:予不同浓度(0、0.50、1.00、1.50及3.00 μmol/L)5-aza-CdR处理细胞;③单纯照射组(RT组):仅予射线照射;④照射+5-aza-CdR处理组(RT+5-aza-CdR组):予5-aza-CdR处理细胞48 h后行射线照射。5-aza-CdR用磷酸盐缓冲溶液(PBS)溶解,对照组用等量PBS液处理。培养12 h细胞贴壁后,室温下采用6 MV-X射线照射。
1.2.2CCK-8法测定5-aza-CdR对EC9706细胞毒性及照射后增殖抑制的影响:取对数生长期EC9706细胞,胰蛋白酶消化制成细胞悬液,接种于96孔细胞培养板中(2.0×103/孔),细胞贴壁后加入不同浓度5-aza-CdR,每个浓度设3个复孔,细胞培养箱中继续培养48 h后,弃去旧培养基,加入100 μl新鲜无血清培养基,然后各孔加入CCK-8溶液10 μl,放入37℃孵箱继续培养4 h,用酶标仪检测450 nm波长处的吸光度,计算细胞增殖抑制率。增殖抑制率(%)=[1-(吸光度实验/吸光度对照)]×100%。实验重复3次。采用相同方法检测5-aza-CdR对EC9706细胞放射敏感性,将接种细胞分为Control组、RT组(射线照射剂量2、4、6、8及10 Gy)和RT+5-aza-CdR组,每组设置3个复孔。培养24 h后,RT+5-aza-CdR组细胞加入1.00 μmol/L 5-aza-CdR;2 h后,RT组和RT+5-aza-CdR组细胞分别接受不同剂量射线照射,继续培养48 h,按照CCK-8法检测吸光度值,计算细胞增殖抑制率和放射增敏比(SER)。SER=RT组D0/RT+5-aza-CdR组D0,D0为细胞增殖活性下降50%时的放射剂量,即半数致死剂量。实验重复3次。
1.2.3Western blot检测相关蛋白表达:收集RT组和RT+5-aza-CdR组细胞,加入PMSF细胞裂解液,提取蛋白。考马斯亮蓝法检测蛋白浓度,加热使蛋白变性,10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离,转膜,血清密闭,分别加入cleaved caspase-3(1︰1000稀释)、Bax抗体(1︰1000稀释)、Bcl-2抗体(1︰500稀释)、ATM/p-ATM抗体(1︰1000稀释)、β-actin抗体(1︰20 000稀释),置于4℃摇床过夜。次日TBST反复冲洗,加入二抗(1︰5000稀释)。ECL试剂显影,拍照。实验重复3次。
1.2.4流式细胞仪检测细胞周期:细胞以每皿3×105个的密度接种于25 cm2培养皿中,贴壁后分为RT组和RT+5-aza-CdR组,继续培养24 h后收集细胞,细胞周期检测按试剂盒说明进行操作,用流式细胞仪进行检测。
1.2.5Transwell小室侵袭实验检测5-aza-CdR对EC9706细胞照射后的侵袭能力:用DMEM培养液将Matrigel按1︰6稀释,取80 μl稀释液加入到Transwell小室上室,37℃培养箱中过夜。收集RT组和RT+5-aza-CdR组细胞,胰蛋白酶消化制备成1×105/ml细胞悬液,接种于已铺基质胶的Transwell小室上室,铺匀,下室加入含20%胎牛血清的DMEM培养液600 μl,在5% CO2、37℃培养箱中培养24 h,取出Transwell小室,用棉签拭去聚碳酸酯膜表面的Matrigel胶,PBS液冲洗,4%多聚甲醛固定20 min,0.1%结晶紫染色30 min,PBS液冲洗晾干,光学显微镜下观察并拍照。实验重复3次。

2 结果
2.15-aza-CdR对人食管癌EC9706细胞的毒性作用 CCK-8法检测结果显示,不同浓度(0、0.50、1.00、1.50及3.00 μmol/L)5-aza-CdR处理后,细胞增殖活性受到明显抑制,分别为(0.68±0.07)%、(0.80±0.10)%、(1.13±0.32)%、(13.33±4.16)%及(38.33±7.64)%。0、0.50及1.00 μmol/L 5-aza-CdR对EC9706细胞增殖抑制作用基本一致,经单因素方差分析,差异无统计学意义(P>0.05);1.00、1.50及3.00 μmol/L 5-aza-CdR对EC9706细胞增殖抑制率经单因素方差分析,差异有统计学意义(P<0.01),且进一步两两比较差异亦有统计学意义(P<0.05)。见图1。可见1.00 μmol/L是5-aza-CdR无毒的最高剂量,故为排除5-aza-CdR本身对细胞增殖抑制的影响,本研究选择1.00 μmol/L为实验浓度行放射敏感性研究。
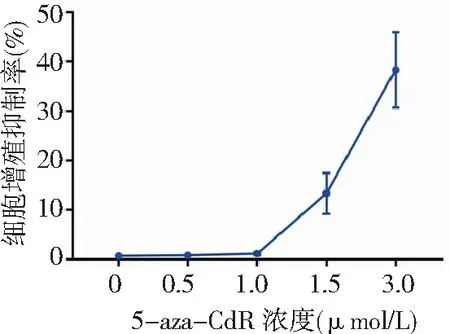
图1 不同浓度5-aza-CdR对人食管癌EC9706细胞的毒性作用
2.25-aza-CdR对人食管癌EC9706细胞照射后增殖活性的影响 CCK-8法检测显示,不同放射剂量(2、4、6、8及10 Gy)照射后,细胞增殖活性受抑制,D0为6.897 Gy。而不同照射组细胞予5-aza-CdR预处理后,各组细胞增殖抑制率经析因设计的双因素方差分析,处理因素5-aza-CdR的主效应比较差异有统计学意义(P<0.01),处理因素放射线的主效应比较差异有统计学意义(P<0.01),二者交互作用比较差异无统计学意义(P>0.05)。故无论是否予5-aza-CdR预处理,经不同放射剂量照射后,细胞增殖活性均受抑制;而予5-aza-CdR预处理后,能增强放射线对EC9706细胞增殖活性的抑制作用。RT组D0为6.016 Gy,RT+5-aza-CdR组D0为4.506 Gy,SER为1.335±0.04。见表1,图2。
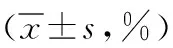
表1 2组人食管癌EC9706细胞经不同放射剂量照射后细胞增殖抑制率的变化
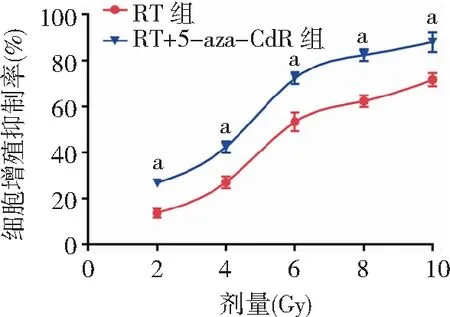
图2 2组人食管癌EC9706细胞经不同放射剂量照射后细胞增殖抑制率的变化
2.35-aza-CdR对人食管癌EC9706细胞照射后凋亡的影响 RT+5-aza-CdR组细胞培养48 h后,凋亡相关蛋白cleaved caspase-3和Bax相对表达量较RT组明显升高(P<0.01),抗凋亡蛋白Bcl-2相对表达量较RT组降低(P<0.01)。见表2,图3。

图3 5-aza-CdR对人食管癌EC9706细胞照射后cleaved caspase-3、Bax和Bcl-2蛋白表达的影响
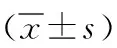
表2 2组人食管癌EC9706细胞cleaved caspase-3、Bax及Bcl-2蛋白相对表达量变化
2.45-aza-CdR对人食管癌EC9706细胞照射后细胞周期的影响 流式细胞术结果显示,RT组(4 Gy)和RT+5-aza-CdR组G0/G1期、S期和G2/M期细胞比例比较,差异有统计学意义(P<0.05或P<0.01)。见图4。与RT组比较,RT+5-aza-CdR组G0/G1期和S期细胞减少(P<0.05或P<0.01),而G2/M期细胞增多(P<0.01)。见表3。
表3 5-aza-CdR对人食管癌EC9706细胞照射后细胞周期的影响

图4 5-aza-CdR对人食管癌EC9706细胞照射后细胞周期的影响
2.55-aza-CdR对人食管癌EC9706细胞照射后DNA损伤修复的影响 EC9706细胞在照射后1 h p-ATM蛋白表达明显增加,随着时间推移,表达逐渐下降;RT+5-aza-CdR组照射1、24、48 h与RT组EC9706细胞中p-ATM蛋白表达比较差异无统计学意义(P>0.05)。说明5-aza-CdR不是通过抑制DNA损伤修复来增加细胞放射敏感性的。见图5。

图5 5-aza-CdR对人食管癌EC9706细胞照射后DNA损伤修复的影响
2.65-aza-CdR对人食管癌EC9706细胞照射后侵袭能力的影响 Transwell小室侵袭实验结果显示,RT+5-aza-CdR组细胞的侵袭能力发生了改变,与RT组相比,RT+5-aza-CdR组穿膜细胞数量明显减少,差异有统计学意义(P<0.01)。提示5-aza-CdR可明显增加放射线抑制食管癌细胞侵袭的能力,提高放射敏感性。见图6。
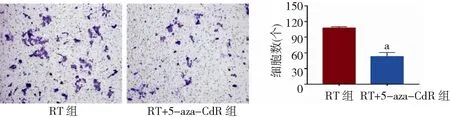
图6 5-aza-CdR对人食管癌EC9706细胞侵袭能力的影响
3 讨论
放射治疗是食管癌常用、有效的治疗手段,治疗原理为利用电离辐射诱导细胞核DNA损伤甚至双链断裂,从而促进肿瘤细胞凋亡[9-11]。多年临床实践证实,不同患者对放射线的敏感性和耐受性差异较大,是导致局部治疗失败和影响患者预后的主要原因[12]。因此,如何改善食管癌细胞的放射敏感性,是提高食管癌患者放射治疗效果、减少局部复发及实现个体化治疗的有效策略[13]。
5-aza-CdR作为胞嘧啶类似物,不仅表现出显著的去甲基化作用,而且具有直接的抗肿瘤作用[14-17],虽然其临床应用较为广泛,但是在食管癌放射敏感性方面的研究却较少见。蔡锐等[18]研究发现,5-aza-CdR可增加鼻咽癌细胞株C666-1的放射敏感性。Hu等[19]研究发现,5-aza-CdR可提高子宫内膜癌细胞对孕酮治疗的敏感性。除此之外,Füller等[20]发现5-aza-CdR通过改变DNA甲基化,在急性白血病和非小细胞肺癌治疗过程中,可以与多种化疗药物产生协同效应而提高疗效。以上研究提示我们,5-aza-CdR在调节肿瘤细胞多种生物学行为、功能改变及放化疗敏感性方面发挥重要作用。因此,探究5-aza-CdR在食管癌治疗中的作用,有可能为寻求更佳治疗手段提供新的思路和方法。
在本研究中,我们首先通过CCK-8法确定5-aza-CdR最高无毒剂量为1.00 μmol/L。因此,在后续实验中初步选定1.00 μmol/L作为5-aza-CdR的用药剂量。进一步在放射线照射前2 h予1.00 μmol/L 5-aza-CdR预处理,后采用CCK-8法检测证实1.00 μmol/L 5-aza-CdR可增强不同照射剂量对EC9706细胞增殖的抑制作用,SER为1.335±0.04。
药物增加肿瘤细胞放射敏感性的机制一般与诱导肿瘤细胞凋亡、影响细胞周期进程和DNA损伤修复密切相关[21]。Bcl-2蛋白家族和cleaved caspase-3都属于重要的细胞凋亡相关蛋白。Bcl-2属于抗凋亡因子,可以抑制线粒体细胞色素C的释放,而Bax为促凋亡蛋白,可以诱导线粒体释放细胞色素C,从而启动细胞凋亡[22]。当Bcl-2表达增强时,其与Bax形成异源二聚体,从而抑制细胞凋亡[23-25]。所以我们进一步从凋亡蛋白分子水平分析5-aza-CdR对EC9706细胞放射敏感性的影响。结果显示:5-aza-CdR联合射线照射处理EC9706细胞后,cleaved caspase-3和Bax表达较单纯照射处理明显升高,Bcl-2表达明显降低。既往研究发现,在骨肉瘤细胞株SaOS2、HOS和U2OS中,5-aza-CdR通过调节细胞周期和增加细胞凋亡来增加放射敏感性,提示5-aza-CdR可能是提高骨肉瘤治疗效果的潜在放射增敏剂[26]。Qiu等[27]利用5株胃癌细胞株(OCUM-2M、OCUM-12、KATO-Ⅲ、MKN-45和MKN-74)观察5-aza-CdR联合照射对胃癌细胞生长活性、细胞周期分布及凋亡相关基因表达的影响,结果发现在5-aza-CdR联合照射明显降低了OCUM-2M、OCUM-12和MKN-45细胞的生长活性,而G2/M期细胞百分率和细胞凋亡率均升高。进一步研究发现,在5-aza-CdR联合射线照射干预下,G0/G1期和S期细胞减少,而G2/M期细胞增多。p-ATM与DNA损伤相关,当DNA损伤时,ATM激酶被激活,使其下游的反应元件发生磷酸化,导致细胞在细胞周期关卡处停滞分裂,使损伤的DNA获得修复的时间,若修复失败则细胞进入凋亡过程。本研究结果显示,p-ATM蛋白表达随着时间的推移无明显差异。最后,我们探究了5-aza-CdR联合射线照射对EC9706细胞侵袭能力的影响,结果发现5-aza-CdR联合射线照射使EC9706细胞的穿膜数量明显减少,侵袭能力下降。以上结果说明5-aza-CdR不是通过抑制DNA损伤修复来提高放射敏感性的,而是通过升高射线照射后细胞凋亡率、影响细胞周期和增强放射线抑制细胞侵袭的能力,从而提高食管癌细胞放射敏感性。然而5-aza-CdR是通过调节细胞甲基化状态还是通过其他途径诱导细胞凋亡,还需进行深入研究。
综上所述,1.00 μmol/L 5-aza-CdR可增加人食管癌EC9706细胞放射敏感性,其作用机制可能与5-aza-CdR能增加放射线诱导的细胞凋亡、抑制细胞增殖、影响细胞周期及增强放射线抑制细胞侵袭的能力有关,为5-aza-CdR用于放射治疗增敏提供一定的实验依据,但是其是否可以作为放射治疗增敏剂用于临床,尚需要更全面、更系统的实验研究。
