固态锂硫电池电解质及其界面问题研究进展
2021-05-26朱鑫鑫万正威李泽珩王利光倪文斌梁成都
朱鑫鑫,蒋 伟,万正威,赵 澍,李泽珩,王利光,倪文斌,凌 敏,梁成都
(1浙江大学化学工程与生物工程学院,浙江 杭州310007;2浙江大学衢州研究院,浙江 衢州324000)
电动汽车和移动设备的快速发展,对锂离子电池的能量密度提出了更高的要求。锂离子电池受制于正负极材料自身理论容量低的限制,其能量密度很难突破400 W·h/kg[1-2]。Li-S电池在高能量密度的提升上具有锂离子电池无法比拟的优势,硫单质的理论比容量高达1675 mA·h/g,同时也可补偿过渡氧化物的氧化还原电位低带来的能量密度损失。Li-S电池的理论质量密度和体积能量密度分别可高达2600 W·h/kg和2800 W·h/L,被认为是最具有潜力的电池体系之一[3-4]。此外,硫单质在自然界中稳定的存在方式为冠状硫八元环结构(α-S8),储存丰富、成本低廉、对环境友好。
尽管液态Li-S电池具有上述优势,但其大规模应用依旧面临以下关键问题。对于硫正极来说[5-7]:①单质α-S8及其放电产物Li2S 的电子电导率较低(10-30S/cm),其电子绝缘性限制了S和Li2S之间的固-固转换;②正极结构体积变化。室温下α-S8晶态的硫和放电最终产物Li2S 的密度分别为2.07 g/cm3和1.66 g/cm3,这会导致电池在充放电循环中产生约80%的体积变化,进而导致正极结构坍塌,影响电池的循环稳定性;③穿梭效应问题。中间产物多硫化物会溶解到电解液中,扩散到锂负极表面并形成不溶性的Li2S、Li2S2和其他短链多硫化物,其迁回正极会继续失电子氧化,导致活性材料利用率降低,库仑效率下降。锂负极也面临着诸多挑战[8-9]:①体积变化。金属锂在电化学沉积/脱嵌过程中发生游离态和化合态的相互转变,在此过程中体积变化巨大,易引起电池内压力变化和电极/电解质界面不稳定;②锂枝晶的形成。由于负极表面形貌不平整,电流分布不均匀,导致负极表面锂离子分布极不均匀,容易发生锂离子的局部沉积,形成锂枝晶。锂枝晶的持续生长可能会刺穿隔膜,造成电子短路,带来火灾或爆炸等安全事故;③与电解液发生副反应带来容量损失。锂金属化学性质活泼,在锂/电解质界面会自发反应生成电子绝缘但导离子的固态电解质界面层(SEI)。在时间空间上分布不均匀,化学、电化学和力学性质都不稳定,也会随着电池充放电反复的断裂/再生,消耗大量的电解液和金属锂,降低电池的库仑效率。因此,很难实现锂金属负极存在下的低电解质/硫比(E/S比),而低E/S比的构筑对于发挥Li-S电池高能量密度的优势至关重要。Zhao 等[10]报道的研究结果显示,在硫面载量(单面)高于4 mg/cm2的情况下,必须将E/S 比控制在3.0 μL/mg 以下,才能获得低成本和高能量密度(500 W·h/kg)的Li-S电池(图1),然而如此低的E/S比在目前商业化电池生产中是很难实现的。

图1 具有不同硫面载量的电池的能量密度随E/S比的变化[10]Fig.1 Energy density as a function of E/S ratio with different areal sulfur loadings[10]
针对硫单质正极的穿梭效应问题,研究人员尝试了多种方法来限制中间产物多硫化物的溶解及在其电解液中的传输。比如通过多孔碳材料和导电聚合物来捕获正极中的多硫化物,或在硫基正极和隔膜之间构建阻挡层,阻碍多硫化物向负极扩散。针对负极锂枝晶的生长问题,研究人员通常在两个维度上进行设计,采用骨架结构建立起纵向上的锂离子通道,以及界面调控等方法在界面处稳定锂离子流,引导锂离子的沉积/剥离行为,抑制锂枝晶的产生[11-12]。虽然针对上述问题已进行了大量探索,但液态Li-S电池的循环稳定性和安全问题仍是限制其大规模应用的主要瓶颈。其实际能量密度也远低于理论值,因此,在实现Li-S电池规模化应用的道路上,需要探索新的方法,彻底解决穿梭效应和锂枝晶生长等问题,实现高比能电池的构建。而固态电解质替代有机电解液有望同时解决安全问题和穿梭效应。与液态Li-S电池相比,固态Li-S电池有着显著的优势:①避免了长链多硫化物在液态电解液中的溶解和穿梭效应[13];②消除了金属锂与有机电解液的副反应,高杨氏模量的固态电解质提高了负极侧锂金属不均匀沉积造成危害的包容度,避免了锂金属持续消耗电解液[14];③固态电解质具有更高的热稳定性,可以避免高温胀气和漏液等安全隐患,从而显著提高安全性[15-16]。
尽管固态Li-S电池具有巨大的发展潜力,但其仍旧面临着诸多挑战[17]:①固态电解质存在本征缺陷。如氧化物固态电解质空气稳定性好,但其硬度大且与电极接触较差,所以很难通过简单的冷压减小电解质/硫基材料界面阻力和晶界阻力。虽然高温球磨对降低界面阻抗和提高离子电导率有较大的作用,但因高温下的硫正极不稳定。氧化物电解质难以单独应用在固态Li-S电池中;另外,不同种类的固态电解质存在各自的问题,比如硫化物固态电解质化学和电化学稳定性差、聚合物基体电解质室温离子电导率低等;②固态电解质/电极界面不稳定。虽然无机固态电解质不可移动,可以从根本上避免了穿梭效应,但因多硫化物的缺失会增加正极/电解质的离子传输阻力,降低电池的倍率性能。再者,充放电过程中的体积变化易使固-固界面电子、离子受阻,极大地降低电化学反应动力学过程。因此,设计合成一种综合性能优异的固态电解质,并在电解质/电极界面构筑稳定的离子传输网络,对固态Li-S电池的工业化具有重要的意义[18]。
本文总结了固态Li-S 电池近年来的研究进展,对比了不同固态电解质应用在固态Li-S电池体系中的优缺点,总结了缓解电解质/电极固-固界面接触问题的常用策略,并对其未来的发展方向做出了展望。
1 固态电解质
固态Li-S电池中理想的电解质应同时满足室温下离子电导率高、化学和电化学稳定性好、热稳定性好、与正负极相容性好和电化学窗口宽等特点[19]。目前在固态Li-S电池体系中应用最多的固态电解质类型主要有硫化物电解质和聚合物基体电解质。
1.1 无机硫化物电解质
相比氧化物电解质中的O2-,硫化物电解质中的S2-具有更大的离子半径,S2-的存在可以拓宽Li+的传输通道,提高对Li+的传输能力。同时由于S2-半径大,相对于O2-更容易被极化,相应的阴离子骨架(如PS4、P2S7、GeS4等)与Li+的作用力减弱,有利于Li+的迁移,从而使硫化物电解质展现出更好的离子传导特性[20]。这些优势使得大多数硫化物电解质的室温离子电导率较高。表1为常用无机硫化物固态电解质的室温离子电导率[21-38]。此外,硫化物电解质具有易冷压成型、与硫正极相容性好的优点,是目前固态Li-S电池研究中报道最多的固态电解质类型。按照硫化物固态电解质晶体结构和组成的不同,一般将其分为Li2S-P2S5玻璃及玻璃陶瓷、阴离子掺杂的Li2S-P2S5和thio-LISICON 类固溶体3类。
1.1.1 Li2S-P2S5玻璃及玻璃陶瓷
Li2S-P2S5玻璃在固态Li-S电池领域中研究很广泛,通过将其退火得到的玻璃陶瓷可以提高电解质的离子电导率。Hayashi 等[23,39]通过高能球磨法得到玻璃相硫化物电解质80Li2S·20P2S5,其室温离子电导率为2×10-4S/cm,通过在250 ℃加热退火,提高了电解质的结晶度,室温离子电导率提高到9×10-4S/cm,与活性材料为CuS的复合正极组装成固态Li-S电池,首圈具有650 mA·h/g的可逆比容量(图2)。Yue等[40]将摩尔分数为75%的Li2S和25%的P2S5在室温下球磨40 h,得到的Li3PS4电解质有较高的离子电导率。此电解质借助Kevlar 纤维作支撑,机械强度大幅提升,同时采用液相法将Li2S/C/Li3PS4复合正极材料做成膜,冷压在不锈钢SS 集流体上(图3)。通过高面载量、薄电解质层的结构设计发挥了固态Li-S电池高能量密度的优势,在负载量为7.64 mg/cm2下能量密度达到370.6 W·h/kg(25 ℃)。因这类电解质离子电导率的局限(10-4~10-3数量级),限制了电池能量密度的提升。因此很多研究工作开始集中在元素掺杂提升其离子电导率方面,阴离子掺杂Li2S-P2S5就是其中一种方式。
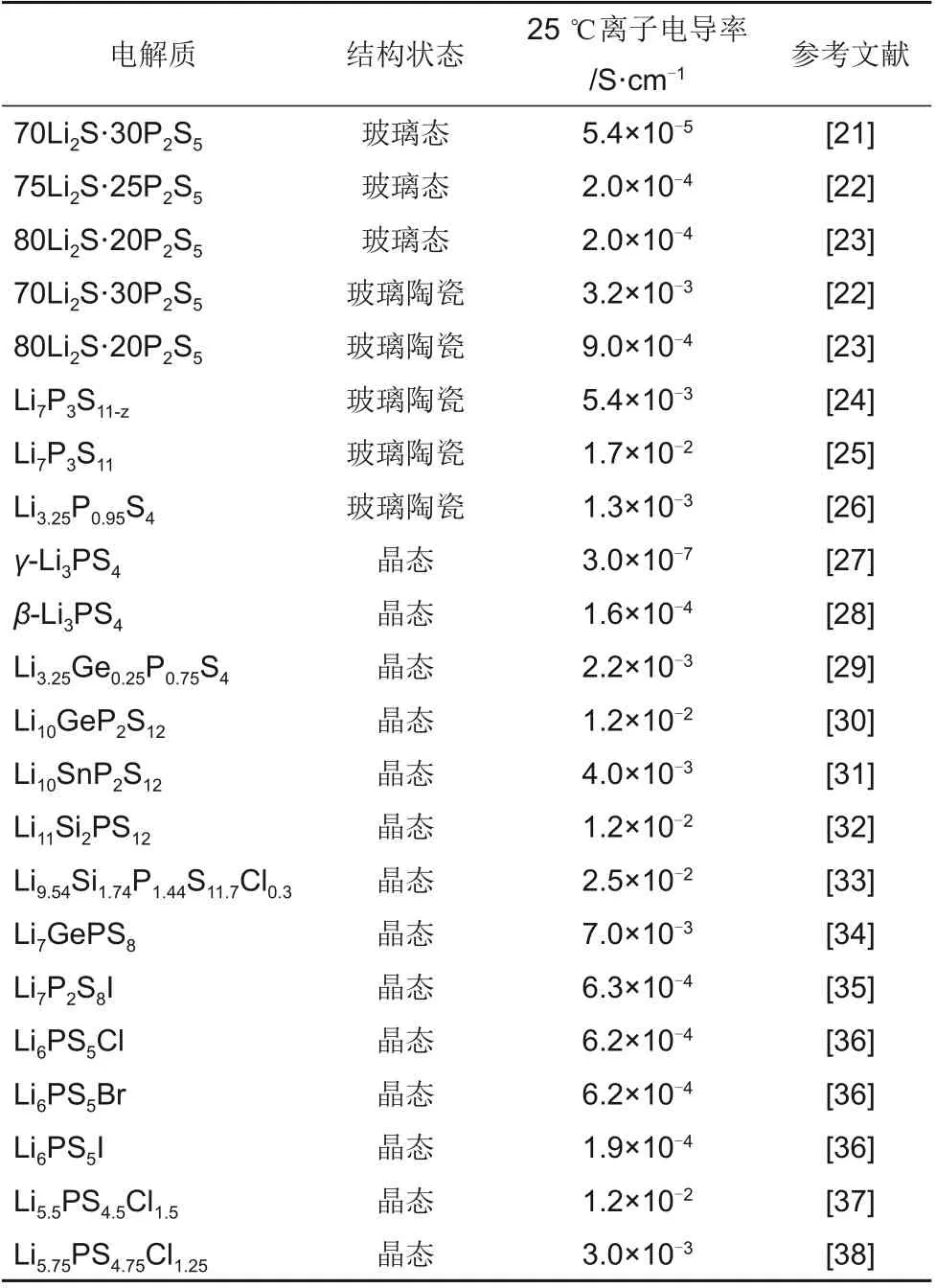
表1 常用无机固态电解质的室温离子电导率Table 1 Ionic conductivity of commonly used inorganic solid electrolyte at room temperature

图2 S-Cu/80Li2S-20P2S5/Li-In固态电池的首圈充放电曲线(室温)[39]Fig.2 Charge-discharge curves of the first cycle of S-Cu/80Li2S-20P2S5/Li-In solid-state battery(at room temperature)[39]
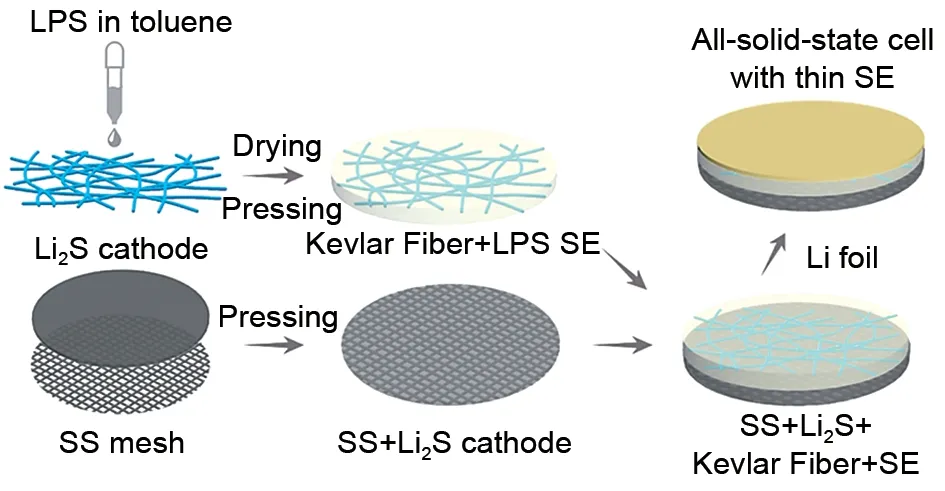
图3 正极-支撑的固态Li-S电池示意图[40]Fig.3 Schematic diagram of cathode-supported solid-state Li-S battery[40]
1.1.2 阴离子掺杂的Li2S-P2S5
通过向Li2S-P2S5玻璃中掺杂卤化锂(LiX,X=Cl、Br、I)的方式可以提高其离子电导率(室温离子电导率达10-4S/cm),且离子电导率的提高与卤化物的极性正相关[41],这种方法称为“混合离子效应”。UJiie 等[42-43]对硫化物电解质掺杂LiI 时发现,掺杂量不同时,不同类型电解质的离子电导率升降趋势不同。(100-x)(0.7Li2S·0.3P2S5)·xLiI 玻璃的离子电导率与LiI 含量呈正相关的趋势,(100-x)(0.7Li2S·0.3P2S5)·xLiI 玻璃陶瓷的离子电导率呈下降的趋势[图4(a)],而(100-x)(0.8Li2S·0.2P2S5)·xLiI玻璃陶瓷的离子电导率随着LiI 含量的上升先升高后降低,在x=5时达到峰值2.7×10-3S/cm[图4(b)]。Rangasamy 课题组[35]证实了卤化锂的掺杂在提升硫化物电解质离子电导率的同时,还可以提高电解质的稳定性。通过高温处理的方式将I-很好地融入到β-Li3PS4中,合成了新相态的Li7P2S8I,其电化学窗口高达10 V(vs.Li/Li+),I-的存在同时提高了电解质与金属锂的稳定性,但其离子电导率提升的程度有限。这一结果对基于硫化物电解质的固态Li-S电池实际应用具有重要的意义。
1.1.3 Thio-LISICON类固溶体
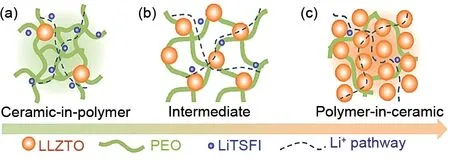
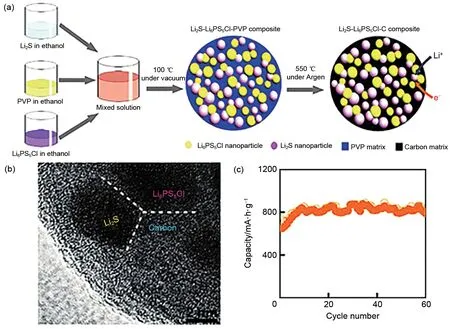
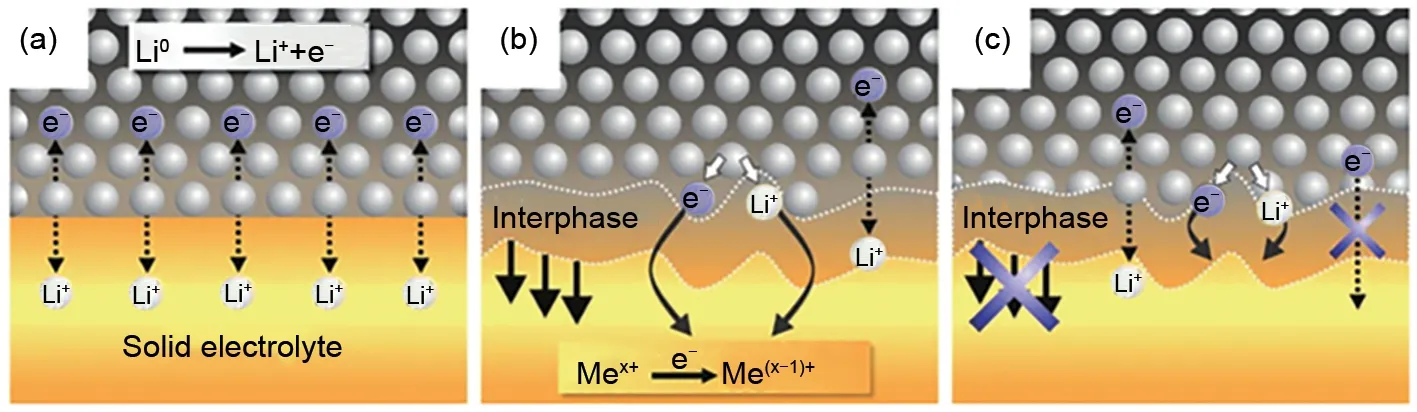
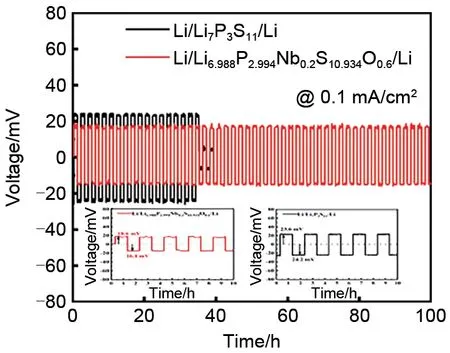
Thio-LISICON 型固溶体是硫化物固态电解质中最为典型的一类,其化学通式为Li4-xA1-yByS4(A=Si、Ge,B=Zn、Al、P)。因其较高的离子电导率,很多研究人员将其应用于固态Li-S电池中。2001年,Kanno课题组[44]最早报道了thio-LISICON类固溶体(Li2S-GeS2、 Li2S-GeS2-ZnS、 Li2S-GeS2-Ga2S3),并测试了其离子电导率,经研究发现,异价元素的取代可以提高其离子电导率。Li4GeS4在室温下的离子电导率仅为2×10-7S/cm,然而通过用Ga3+和Li+取代Ge4+得到Li4.275Ge0.61Ga0.25S4,其室温电导率提高到6.5×10-5S/cm,从而认为离子电导率的提升归功于异价元素取代所形成的Li+空穴。在此基础上,Kanno 等[29]又进一步用P5+取代Ge4+和Li+得到thio-LISICON类固溶体Li4-xGe1-xPxS4(0 图5 (a)S/CMK-3和(b)230 ℃热处理后S/CMK-3复合电极的全固态电池充放电曲线[45]Fig.5 Charge-discharge curves of all-solid-state batteries with composite electrodes of(a)sulfur/CMK-3 and(b)sulfur/CMK-3 heat treated at 230 ℃[45] 接下来,通过构筑纳米离子通道减小充放电过程中的离子传输阻力,实验采用不同尺寸的SiO2球为模板制备得到三维孔道结构的碳复型材料(CR12、CR40、CR100 分 别 对 应 于 孔 径9.2、42.8、107.9 nm),进一步利用气相混合得到S/CR复合物,再与Li3.25Ge0.25P0.75S4球磨后得到正极材料。结果表明,孔径为8.6 nm的碳材料为导电剂时电化学性能最优,在25 ℃、电流密度0.065 mA/cm2下循环20 次容量保持为366 mA·h/g,而采用孔径为42.2 nm和117.2 nm的碳材料为导电剂组装的固态Li-S电池在相同测试条件下容量衰减较快[图6(a)][46]。随着电流密度的增大,电极的放电比容量减小,但S/CR12 一直保持着较高的容量,与上述S/CMK-3复合正极容量相当[图6(b)]。 图6 采用S/CR12、S/CR40和S/CR100复合电极全固态电池的(a)循环性能与(b)倍率性能[46]Fig.6 (a)cycle characteristics,and(b)rate characteristics of the all-solid-state batteries using composite electrodes of S/CR12,S/CR40,and S/CR100[46] Kamaya 等[30]在硫化物固态电解质离子电导率方面实现了突破,制备了一种具有锂离子三维扩散通道的电解质Li10GeP2S12(LGPS),室温下离子电导率可达1.2×10–2S/cm,已经达到液态电解液水平,图7为LGPS的晶格结构。Ngata等[47]研究了基于此电解质不同导电剂对固态Li-S电池电化学性能的影响,实验分别以乙炔黑(AB)、Ketjenblack(KB)或活性炭(AC)为导电剂,采用Li-In负极组装成固态Li-S 电池,结果发现以AB 为导电剂的电池无法正常充放电,而以AC为导电剂的电池在6.4 mA/cm2的电流密度下初始放电比容量约为1600 mA·h/g,以AB 为导电剂的Li-S 电池容量是以AC 为导电剂的0.9倍,该文作者认为这可能是由于AC具有更高的比表面积,与硫的接触更充分。近年来Kanno课题组[33]在提高固态电解质离子电导率方面又取得了重大的进展,开发了离子电导率(2.5×10-2S/cm)高于液体电解液的硫化物电解质Li9.54Si1.74P1.44S11.7Cl0.3,是目前报道的离子电导率最高的固态电解质,但其依旧存在硫化物固态电解质的共性问题——电化学和化学性质不稳定。 硫化物固态电解质Li-S电池虽然可以从根本上避免多硫化物的穿梭效应,但由于其不可流动以及S和Li2S的离子、电子绝缘,固态电解质的电子和离子传输通道很大程度是隔离的,这样导致锂离子很难达到电化学反应的活性位点,局部电荷堆积而阻碍电极反应。除此之外,大多数的硫化物固态电解质对水分十分敏感,空气中的水分将硫化物水解会生成有害的H2S 气体,从而加速硫化物的降解,产生安全和成本问题。据报道,在所有Li2S-P2S5二元体系中,75Li2S·25P2S5玻璃和玻璃-陶瓷体系在环境大气中生成的H2S 最少,结构变化可忽略不计。进一步的研究发现,用Li2O 代替Li2S 或P2O5代替P2S5形成氧硫化物玻璃可以提高电解质的稳定性、抑制H2S的产生,然而这种取代方式会在固相中引入硫氧化物和PO4的结构单元,而这些非桥接的氧化物会束缚住锂离子,导致电解质的离子电导率下降[48-49]。此外,可通过硬软酸碱理论(HSAB)设计对空气稳定的硫化物,其中硬酸倾向于与硬碱形成较强的键,而软酸倾向于与软碱形成较强的键。因此,具有比磷更软的酸性元素(如Sn、As、Nb)的硫化物电解质在空气中的化学稳定性应比硫代磷酸盐更好。它们倾向于与软碱(硫)而不是硬碱(氧)形成更强的键,包括Li4SnS4、As 取代的Li4SnS4、Li2SnS3、Li4SnS4-LiI 和Li3SbS4。综 上 所 述,已 有很多报道提出有效策略来提高硫化物固态电解质在潮湿空气中的化学稳定性。但就固态锂硫电池体系而言,对电化学和化学稳定的硫化物固态电解质的研究报道较少,且对空气不稳定的原因以及基于不同类型的硫化物对水分子的反应性还需要进一步的系统研究。此外,空气稳定性的提高可能会牺牲材料的电化学性能,因此在材料设计时需要考虑各种性能之间的平衡。 在Li-S电池体系中,高硫面载量的正极材料在充放电过程中易存在较大的体积变化,聚合物固态电解质可以缓解活性材料体积变化从而防止电极结构破碎,而且能够抑制锂枝晶的生成、力学性能优异,易成膜,此类聚合物电解质一般以聚合物为基体,并将锂盐溶解在基体中以实现电解质的离子导通[50]。 图7 Li10GeP2S12的晶格结构[30]Fig.7 Lattice structure of Li10GeP2S12[30] 图8 基于(a)AC和(b)KB复合正极的全固态Li-S电池在25 ℃时的放电曲线[47]Fig.8 Discharge curves of all-solid-state lithium sulfur(Li/S)cells containing positive composite electrodes based on(a)AC and(b)KB at 25 ℃[47] 图9 PEO基电解质Li+传导机制示意图[51]Fig.9 Diagram of Li+conduction mechanism of PEObased electrolyte[51] 目前,聚氧化乙烯(PEO)聚合物基体在固态Li-S电池中的研究最为广泛。其中PEO 被公认的离子传输机理:Li+和PEO 链上的—C—O—C—不断地发生络合-解络合反应,通过PEO的链段运动完成Li+的迁移(图9)[51-52]。其他的聚合物基体包括聚甲基丙烯酸甲酯(PMMA)[53]、聚丙烯腈(PAN)[54]、聚偏氟乙烯(PVDF)[55]等。2000 年,Marmorstein 等[56]对比了PEO 和聚氧化亚甲基乙烯(PEMO)基聚合物电解质应用于固态Li-S电池的电化学性能,PEO基聚合物电解质在90 ℃下离子电导率达4.9×10-4S/cm,其组装的固态Li-S 电池在电流密度为0.1 mA/cm2时的初始放电比容量为1620 mA·h/g,接近硫的理论比 容 量1675 mA·h/g。从23 ℃升 温 到60 ℃,PEMO基电解质的离子电导率提高3倍,电池电化学性能大幅提高,但当温度再次降至23 ℃时,极化电压增加、放电比容量衰减较快、电池性能变差。除了聚合物基体,合适的锂盐对构建稳定的离子传输通道和电池的循环性有着重要意义。Ma等[57]选用(氟磺酰)(三氟甲基磺酰)亚胺锂(LiFTFSI)作为PEO 基电解质的锂盐通过溶液浇铸法制备了PEO-LiFTFSI聚合物电解质,其室温离子电导率为10-5S/cm,耐高温,与以S 和介孔碳(CMK3)复合材料为正极组装成Li-S电池,其在60 ℃、0.1 C下首次放电容量为881 mA·h/g,30圈后容量保持率为73.4%。Liu 等[58]制备了B-Sucrose/PEO/LiTFSI 聚合物电解质,其室温离子电导率高达4.28×10-4S/cm,电池0.1 C 下的初始放电比容量达1302.7 mA·h/g,循环250 圈后容量依然保持在620 mA·h/g,该电解质与正负极有良好的界面相容性、成本低,具有大规模商业化的应用前景。 在聚合物基体中掺杂无机填料是一种有效提升电解质离子电导率的方式。其综合了机-无机电解质的优点,优异的力学性能也能有效缓解锂枝晶的生长,但其离子电导率提高的机理存在争议。Jayathilaka等[59]推测无机电解质颗粒表面的基团相当路易斯酸,与锂盐的阴离子相互作用并将其固定,增加了可以自由移动的锂离子。Croce 等[60]持不同的观点,其认为无机填料与聚合物链段交联,降低了聚合物基体的结晶度,提高了Li+的传输能力。Goodenough 等[61]发现无机填料所占复合电解质比例不同,电解质的离子电导率也不同,并有一个最优的陶瓷颗粒比例得到的复合电解质离子电导率最高,这一比例定义为“渗透阈值”。如图10所示,在复合比例低于渗透阈值时,聚合物的链段运动决定着复合膜的离子电导率,此时增大陶瓷颗粒比例可以降低聚合物结晶比例,提高其离子电导率;在渗透阈值时,离子传输通过聚合物链段运动和陶瓷颗粒共同传输;大于渗透阈值时,会因陶瓷颗粒发生团聚影响复合膜的离子电导率。 图10 (a)低于渗透阈值;(b)渗透阈值;(c)大于渗透阈值时的复合电解质离子传输示意图[61]Fig.10 Schematic diagram of ion transport of composite electrolyte(a)lower than the permeability threshold(b)permeability threshold(c)larger than the permeability threshold[61] 根据是否为离子导体,无机填料通常分为惰性填料(SiO2、TiO2等)和活性填料(Li3N、LLTO 等)两大类[62]。相比于尺寸较大的惰性填料,纳米尺寸的惰性材料对复合电解质离子电导率提高的效果更显著。Hassoun 等[63]将纳米惰性填料ZrO2颗粒加入PEO/LiCF3SO3中形成复合电解质,70 ℃时,其离子电导率达到10-4S/cm,由此组装的固态Li-S 电池在80 ℃、0.05 C 时放电比容量达900 mA·h/g,库仑效率接近100%,说明此聚合物基体电解质在高温下具有良好的离子传导性与稳定性。复合聚合物电解质的离子电导率相较于纯聚合物电解质有所提高,但即使优化后的组分在70 ℃下离子电导率仅能达到10-4S/cm 数量级,导致固态Li-S 电池在高温下才能工作,且存在较快的容量衰减,因而不能满足Li-S电池的实际应用。 活性填料相比于惰性填料,一般具有较高的离子电导率,可以显著提高聚合物电解质的力学性能和离子电导率。氧化物固态电解质因其优异的力学性能常用来作填料,与聚合物固态电解质复合来抑制锂枝晶的生长,Tan等[64]将钛酸锂(LTO)纳米粒子作为填料制备了PEO-LiClO4-LTO 电解质,其室温离子电导率为5.31×10-5S/cm,组装得到的Li-S电池在90 ℃下初始放电比容量为1596.4 mA·h/g,性能优于不含活性填料的PEO-LiClO4固态Li-S电池。Zhao 等[65]采用另一种氧化物电解质LATP,将其掺入PEO聚合物中,将复合物置于多孔聚酰亚胺(PI)中得到PI-PEO-LATP 电解质,此电解质与金属锂稳定,与CNT 中间层结合组装的电池在35 ℃、0.1 C 时初始放电容量为1212 mA·h/g,循环100圈后仍可获得800 mA·h/g。PEO 与氧化物电解质复合电解质的研究已经逐渐成熟,但其在固态Li-S电池中的应用关键在于如何提高室温下的离子电导率,使电池发挥出高能量密度的优势。 此外,无机硫化物活性材料离子电导率较高,Yang 课题组[66]将其掺杂在聚合物基体中,改善电解质的离子电导率。实验结果证实了硫化物固态电解质的加入能提高电解质的离子迁移数,有利于构建稳定的离子传输通道。实验采用溶液浇铸法制备了PEO-1%Li10SnP2S12(LSPS)电解质,其力学性能优异,在60 ℃下离子电导率为1.69×10-4S/cm,基于此电解质的Li-S 电池在60 ℃初始放电比容量为1000 mA·h/g,库仑效率接近100%,40 圈后容量保持率高达90%(图11)。但硫化物电解质化学性质不稳定,在整个操作过程中都要避免其与水分的接触。 图11 基于PEO-1%LSPS(a,c)和PEO/LiTFSI(b,d)电解质的固态Li-S电池在60 ℃下的充放电曲线(a,b)和循环性能(c,d)[66]Fig.11 Charge-discharge curves(a,b)and cycling performance(c,d)of the Li-S cells with the PEO-1%LSPS electrolyte(a,c)and the PEO/LiTFSI electrolyte(b,d)at 60 ℃[66] 综上讨论,有机/无机复合电解质具有化学和电化学稳定性高、力学性能好等优点,是固态Li-S电池理想的电解质材料,然而其室温离子电导率并未实现大的突破,且活性填料价格昂贵、制备工艺复杂、容易发生团聚,难以满足固态Li-S电池的规模化应用。 与液态电池不同,界面接触问题是固态电池面临的最大挑战之一。固态Li-S 电池中固-固界面的接触面积有限,且固态电解质不可移动,不利于电荷在界面处的传输,因而产生了较大的界面电阻。其次,电极/电解质界面存在严重的副反应,稳定性不足。因此,构建一个有效且稳定的电解质/电极界面对于提高固态Li-S 电池电化学性能至关重要[17]。 硫正极/电解质界面稳定性是开发固态电池器件的关键问题之一。在固态Li-S电池中,正极中的活性材料在充放电过程中体积不断变化,由此产生的应力会导致材料粉末化,破坏电解质离子扩散通道,增大界面阻抗,降低电池的循环稳定性。不同于电解液良好的浸润性,固态电池中的电荷传输完全依赖于固态电解质与活性材料之间的固/固界面,因此增大界面接触面积和提高界面稳定性是实现固态Li-S电池优异电化学性能的关键。 针对硫正极/电解质界面,目前很多研究从纳米化角度出发,构建正极和界面间的微纳米结构,提高活性材料的利用率。Nagao等[67]通过高能球磨法来降低Li2S颗粒的尺寸,再与其他组分复合得到正极。结果表明,球磨后的活性材料在正极材料中分布均匀,并且可以提供更多的活性位点,有效地提高了电池的库仑效率和循环稳定性。这是因为纳米结构的高比表面积有效地提高了正极与电解质的接触,并且由于正极活性物质与其放电产物的绝缘性限制了电化学的反应深度,通过构建纳米通道可以有效提高活性物质利用率。Han等[68]通过选用高比面积和孔体积的BP-2000碳,实现电子的快速传输和体积膨胀调节,增加了S@BP-2000正极/电解质的稳定性,在0.2 C初始放电比容量高达1391.3 mA·h/g,并在高电流密度下表现出优异的循环稳定性。这种高比面积的活性材料虽可带来优异的电化学性能,但离子在界面处的迁移速率本质上并没有提高。 图12 (a)核壳纳米复合材料的制造示意图;(b)活性物质的离子电导率[69]Fig.12 (a)fabrication diagram of core-shell nanocomposites;(b)ionic conductivity of the active material[69] 活性材料表面原位生长或涂覆固态电解质,可以有效提升界面离子迁移速率、增强电解质/正极间的相容性、降低界面阻抗。早期,Liang 等[69]通过液相法制得纳米尺寸的Li2S,并在四氢呋喃溶剂中在其表面与P2S5反应,生成一种离子电导率较高的固态电解质Li3PS4(图12),这种以Li2S 为核,Li3PS4为壳的核壳结构活性材料,减小了正极空间电荷层效应,首圈放电比容量达1000 mA·h/g(Li2S),并且表现出了优异的循环稳定性。这种原位反应增加了Li2S和Li3PS4的接触,是改善电解质/硫正极界面接触问题的一种有效方式。 图13 (a)Li2S纳米复合材料的制造示意图;(b)Li2S-Li6PS5Cl-C的透射电镜图像;(c)50 mA/g时电池循环性能[15]Fig.13 (a)the fabrication of Li2S nanocomposites;(b)transmission electron microscopy images of Li2S-Li6PS5Cl-C;(c)cell cycle performance at 50 mA·g-1[15] 基于此研究,很多研究人员受到启发。Xu等[70]通过原位液相法在MoS2上均匀涂覆Li7P3S11,采用MoS2/Li7P3S11复合材料为正极在0.1 C下首次放电比容量为868.4 mA·h/g,60圈后仍可达547.1 mA·h/g。Aso等[71]通过玻璃陶瓷态硫化物80Li2S-20P2S5包覆的NiS-VGCF 正极优化固/固界面,与Li-In 合金组装的固态Li-S 电池在1.3 mA/cm2的电流密度下首次放电比容量为590 mA·h/g,其电化学性能远优于未包覆的NiS 正极。Han 等[15]将Li2S、聚乙烯吡咯烷酮和Li6PS5Cl溶解在乙醇中,然后进行共沉淀和高温碳化[图13(a)],纳米尺寸的Li2S 和Li6PS5Cl在软碳基体中原位生长[图13(b)],形成的纳米复合材料提供了较大的缓冲空间,不仅可以减轻充放电过程中的应力/应变,也可以促进锂离子的快速转移,在60 圈后放电比容量仍可达到830 mA·h/g[图13(c)]。这种在活性物质上包覆高离子导体的方法常用来改善硫基正极/电解质界面,效果显著。 金属锂具有较高的比容量(3860 mA·h/g)和较低的氧化还原电位(-3.04 V,vs.H+/H2),被认为是高比能电池理想的负极材料。在固态Li-S 电池中,根据金属锂/固态电解质界面的形成特征,Wenzel等[72]将其分为三种情况:①理想状态的完美接触,两者不发生任何反应,形成完美的2D 热力学稳定界面,目前暂未报道[图14(a)];②两者接触发生副反应,由于金属锂比较活泼,会形成3D 热力学不稳定界面,但会生成稳定的SEI膜[图14(b)];③界面导离子电子能力都很强,SEI层厚度随时间变化,逐渐产生锂枝晶,穿透电解质,最终导致电池失效[图14(c)]。在固态Li-S电池负极侧,电解质与锂负极会发生反应生成不稳定的中间层,这对电解质与锂金属的进一步反应起到了阻碍作用,但这层电解质在充放电循环中会遭到破坏。随后Wenzel 等[73]探究了Li7P3S11电解质与锂负极界面的稳定性,根据EIS测试发现,随着硫化物电解质与金属锂接触时间的延长,室温下测得的阻抗越来越大,离子电导率逐渐下降,通过原位XPS对S 2p和P 2p元素分析,可以发现电解质与金属锂接触后发生了化学反应,被分解成Li3P 和Li2S,形成几个纳米厚的SEI,其随着电池充放电过程不断破坏/生成(图15)。 图14 金属锂/固态电解质界面的界面情况[72]Fig.14 Interface of lithium metal/solid electrolyte interface[72] 图15 Li7P3S11电解质与金属Li接触前后S 2p元素和P 2p元素变化[73]Fig.15 Changes of S 2p and P 2p elements before and after contact between Li7P3S11 electrolyte and Li metal[73] 简单的使用固态电解质并不能有效抑制锂枝晶的生长,电解质内部晶界和缺陷导致金属锂沉积不均匀,为锂枝晶的生长提供活性位点,其次SEI膜与电解质离子电导率的差异也会促使枝晶生长。Han 等[74]对硫化物电解质Li3PS4进行中子深度剖面(NDP)获得锂枝晶生长的实时观察结果,发现锂枝晶在电解质内部成核和生长,这归因于此电解质较高的离子电导率。研究者通常通过修饰电解质、引入人工SEI膜或采用锂合金等方法优化锂负极/电解质界面。通过掺杂含锂化合物来调节电解质的组成,不仅可以提高其化学稳定性和离子电导率,还能增强结构稳定性并抑制锂枝晶的生长。Yang等[18]通过向Li7P3S11掺杂LiNbO3得 到Li6.988P2.994Nb0.2S10.934O0.6,室温离子电导率高达2.82×10-3S/cm,同时提高了电解质的化学稳定性和电化学窗口(图16)。此外,Li2S/Li6.988P2.994Nb0.2S10.934O0.6/Li-In 电池的界面电阻低于Li7P3S11电解质电池的界面电阻,基于此电解质的固态Li-S电池在25 ℃、电流密度为0.060 mA/cm2时循环50 圈后容量为530.9 mA·h/g,容量保持率为98.88%,库仑效率接近100%。Tu 等[75]同样采用Nb 和O 共掺杂的方式得到改性后的电解质Li7P2.88Nb0.12S10.7O0.3,室温离子电导率为3.59×10-3S/cm,且提高了电解质对金属锂的电化学稳定性,这归因于界面上Nb和Li2O的形成,能诱导锂的均匀沉积,防止进一步副反应的发生。基于该电解质的固态Li-S电池在25 ℃、0.05 C下初始比容量接近800 mA·h/g,循环100圈后容量保持率在75%以上,并表现出了优异的倍率性能。 图16 0.1 mA/cm2下锂对称电池的恒流充放电电压曲线[18]Fig.16 Galvanostatic charge/discharge voltage profiles of the Li/SEs/Li symmetric cells at 0.1 mA·cm-2[18] 除了优化电解质,引入人工SEI将是防止锂金属与固态电解质直接接触发生副反应的另一个选择。Liu 等[76]通过原子层沉积技术ALD 在固态电解质LATP 表面涂覆15 nm 厚的Al2O3,避免了Li 和LATP 之间的副反应,循环600 h 仍保持稳定,而未进行保护的LATP,Li-Li 对称电池的过电势急剧增大。Xu 等[76]在锂负极表面涂覆LiI 并组装锂对称电池,在0.5 mA/cm2的电流密度下进行充放电测试,循环200圈后仍保持较低的过电位,LiI涂层优化了锂负极的界面性能。除无机层外,在锂负极/固态电解质界面采用有机-无机杂化层也可以阻止界面电子转移和抑制锂枝晶的形成[77]。如用丁二腈基塑料晶体电解质保护的锂负极与硫-聚丙烯腈(S-PAN)复合正极组装的Li-S 电池有较高的容量保持率[78]。实验室也常用Li-In合金代替金属锂作为负极来提高负极/电解质界面稳定性,但电池的放电电压会降低,不利于获得高能量密度的固态Li-S 电池[15,79]。Sun 等[80]借助于X 射线扫描和能量色散衍射观察到充放电过程中不均匀的锂沉积/剥离,在Li-In 合金/Li10SnP2S12电解质界面连续产生空隙和空穴,电池的比容量衰减严重。过去几十年,Kanno课题组研究了一系列的Li-M合金,包括LiAl箔[81]、LiAl粉[82]、LiSi和LiSn箔[83]等,这些Li-M合金都在一定程度上能减少电解质/锂负极界面副反应的发生,提高界面稳定性。 固态Li-S电池高安全性、高能量密度等优势吸引了研究人员的广泛关注,但其电化学性能还远未达到液态Li-S电池的水平,依旧存在很大的发展空间。近几年来,研究人员对固态Li-S电池投入了大量精力,已经取得了很大进展,但依旧没有消除固态电解质的本征缺陷和电解质/电极等诸多界面问题。基于本文的总结理解,为进一步解决这些问题,本文作者提出了两个主要研究方向[84]。①改善固态电解质的本征缺陷。基于固态电解质的种类,针对性地解决其对应缺陷。关于硫化物电解质,虽然其离子电导率已达到液态电解液水平,但其化学和电化学性质不稳定。有研究通过氧元素掺杂形成氧硫化物玻璃或通过Sn、As、Nb元素取代电解质中的P元素,有效提高了电解质的稳定性,但在一定程度上损害了电解质的离子电导率。除此之外,目前针对Li-S电池体系中能够稳定的硫化物电解质的研究较少。未来可针对这一体系,探讨如何在保证电解质高离子电导率的前提下,提高其化学和电化学稳定性,发挥硫单质的高比容量优势,实现固态Li-S电池优异的电化学性能;对于聚合物基体电解质,通过离子电导率较高的活性填料掺杂其室温电导率依旧保持在较低的水平(相比液态电解质),通常在高温下才能发挥其优异的性能,而高温下工作是不切实际的,未来可设计开发室温下离子电导率高的聚合物电解质,还可与无机陶瓷电解质复合充分发挥有机-无机复合电解质的协同作用。②电极/电解质界面结构设计。高效的电池系统需要正极、电解质和负极各个部件的兼容,在固态Li-S电池体系中,简单的叠合很难实现稳定的电子/离子传输网络。上述已有大量的研究工作对正(负)极/电解质界面进行改善,并取得了较好的成果。在此基础上,在正极侧还应合理地设计硫基正极结构,缓解体积变化引起的正极材料中三相界面接触失效导致的正极/电解质界面接触失效;对于负极侧,研究应集中于锂金属与电解质的稳定性、锂离子在界面的迁移和锂金属的均匀剥离/沉积等方面,并结合科学的模拟深入研究离子在固态电池中界面间的传输机制,从理论和实际解决固态Li-S电池的关键问题。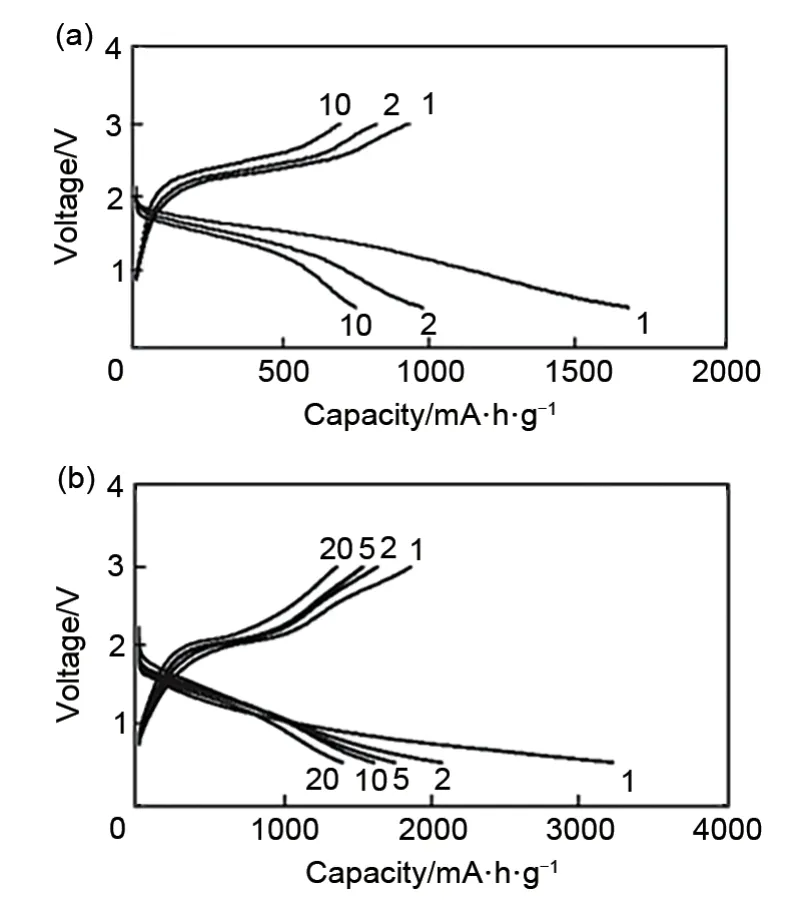

1.2 聚合物基体电解质




2 固-固界面接触问题
2.1 硫正极/电解质界面

2.2 锂负极/电解质界面

3 总结与展望
