美罗培南不同给药方案有效性与耐药风险的蒙特卡洛模拟*
2021-05-26邹雅敏张迪董亚琳
邹雅敏,张迪,董亚琳
(1.西安交通大学医院药械科,西安 710049;2.西安交通大学第一附属医院药学部,西安 710061)
革兰阴性菌(gram-negative bacteria,GNB)为医院感染主要病原菌,其中最常见的菌株分别为大肠埃希菌(Escherichiacoli,EC)、肺炎克雷伯菌(Klebsiellapneumonia,KP)、铜绿假单胞菌(Pseudomonasaeruginosa,PA)及鲍曼不动杆菌(Acinetobacterbaumannii,AB)[1]。美罗培南是II类碳青霉烯类抗菌药物[2-4],在临床上应用普遍,是防治GNB感染的重要药物,但耐美罗培南菌株不断涌现,耐药形势十分严峻。美罗培南的大量使用对微生物菌群产生的选择性压力,是其耐药性日趋严重的重要原因。然而,选择性压力是个较为抽象的概念,如何量化评估和管理,仍是个悬而未决的难题。
蒙特卡罗模拟(Monte Carlo simulation,MCS)是一种基于“随机数”的计算方法,其基本原理是从不同变量的函数分布中随机抽样,并代入数据模型,以获得研究问题的近似解。近年来,药动学/药效学(PK/PD)模型结合MCS的新模式,在没有临床转归研究的情况下,综合考虑特定菌群的最低抑菌浓度(MIC)分布与患者药动学变异,为给药方案的评价、比较、优化提供了重要参考[5-6]。目前该模式更多地聚焦于临床疗效,笔者尚未发现有研究用于对临床治疗方案引起的耐药突变风险的评估。
本研究运用PK/PD模型结合MCS的模式,依据医院非重症监护室(intensive care unit,ICU)与 ICU 中微生物菌种和MIC分布,分别模拟非危重和危重患者美罗培南对EC、KP、PA及AB感染的15种给药方案的有效性及抑制耐药突变的达标概率(probability of target attainment,PTA)和累积反应分数(cumulative fraction of response,CFR),比较不同给药方案的有效性,并尝试对现有美罗培南临床暴露的耐药风险进行初步量化评估,旨在为美罗培南的合理应用提供参考。
1 资料与方法
1.1微生物数据的采集收集2017年某三甲综合教学医院检验科微生物室临床送检标本(包括血液、无菌体液、痰液、尿液、伤口渗出液和厌氧标本)的相关数据。同一患者重复样本和来源于社区、门诊或急诊室中的菌株被排除。所有的样本都储存在-80 ℃中,以进行药物敏感性试验。药物敏感性试验用仪器MIC法测定。PA(ATCC 27853)、EC(ATCC 25922)和SA(ATCC 25923)为质量控制菌株。敏感、中介或耐药的折点依据2017年版美国临床实验室标准协会文件确定[7]。
1.2确定需模拟的给药方案查阅药品说明书及临床常用方案,确定0.5,0.75,1 和2 g分别每12 h给药一次(q12 h)、每8h给药一次(q8 h)和每6 h给药一次(q6 h)的12种方案。另外,TACCONE等[8]报道,治疗泛耐药(extensively drug-resistant,XDR)-PA引起的感染性休克患者,使用美罗培南3 g、q6 h治疗,日剂量高达12 g。因此,确定3 g q12 h、q8 h和q6 h 3种给药方案。所有方案均模拟传统输注法给药,即为0.5 h静脉滴注给药。
1.3PK参数的确定根据文献获得美罗培南的 PK 参数,非危重患者以健康志愿者的PK参数模拟[9-10],危重患者以脓毒症患者(肝酐清除率>3 L·h-1)PK参数模拟[11],具体PK参数见表1。
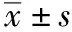
表1 美罗培南的PK参数
1.4PD指标的确定
1.4.1有效性目标靶值的确定美罗培南是时间依赖性抗菌药物,常以给药间隔内游离血药浓度超过致病菌MIC的时间(% T>MIC)作为PK/PD参数。普遍认为%T>MIC>40%才能维持其杀菌活性;也有学者认为,对于危重患者%T>MIC>100%或%T>4MIC>50%才能更好地达到临床和病原学治愈[12]。因此,本研究中,非危重患者以%T>MIC>40%作为预测有效性的目标靶值,危重患者以%T>MIC>100%、%T>4MIC>50%作为预测有效性的目标靶值。
%T>MIC按照公式(1)计算。
Dose:给药剂量;f:游离药物比例;Vd:表观分布容积;CL:清除率;DI:给药间隔。
1.4.2抑制耐药突变目标靶值的确定研究表明,若要预防耐药性传播,需维持谷浓度与MIC比率(Cmin/MIC)达到4以上[13-15]。因此,非危重和危重患者均以%T>4MIC>100%作为抑制耐药突变的目标靶值。
1.4.3蒙特卡洛模拟应用 Oracle Crystal Ball(V11.1.2.3.0版)软件对美罗培南不同给药方案治疗4种GNB(EC、KP、PA及AB)感染进行MCS。计算各 MIC 值对应给药方案的有效性、抑制耐药突变的PTA,进而计算各给药方案的CFR,见公式(2)。
PTAi:在给定 MIC 值的中靶估计概率,Fi:在群体菌株中各个MIC 分布的相对概率。
2 结果
2.1微生物数据及MIC分布非ICU共检出9303株,其中,检出的EC、KP、PA及AB分别为5711,1603,1274,715株,占比分别为61.4%,17.2%,13.7%和7.7%。ICU共检出4244株,其中EC、KP、PA及AB分别为758,836,930,1720株,占比分别为17.9%,19.7%,21.9%和40.5%。非ICU和ICU美罗培南对常见GNB的MIC分布见表2。
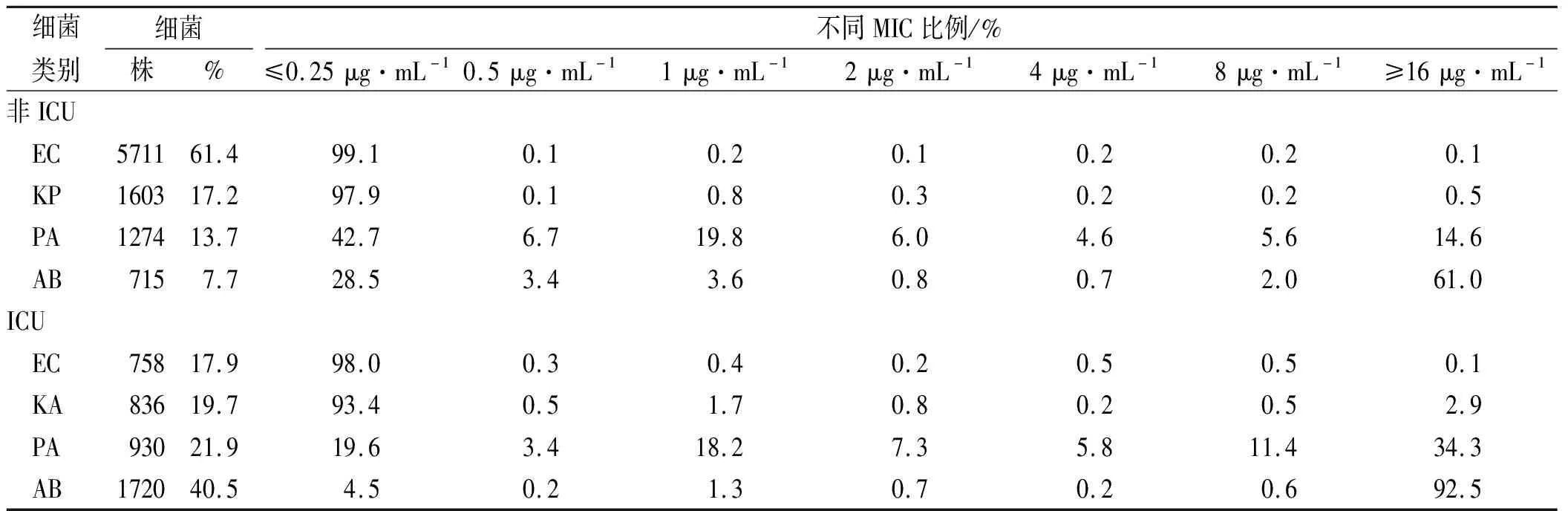
表2 非ICU 和ICU中4种常见GNB检测株数及对美罗培南不同MIC的分布
2.2不同给药方案有效性的MCS
2.2.1非危重患者非危重患者以%T>MIC>40%为目标靶值,不同给药方案对EC、KP、PA及AB的CFR见表3。对于EC和KP,仅0.5 g、q12 h的方案CFR不能达到90%,其余方案CFR均>90%。对于PA,只有2 g、q6 h和3 g、q6 h的CFR能达到90%。对于AB,只有3 g、q6 h的CFR能达到90%。
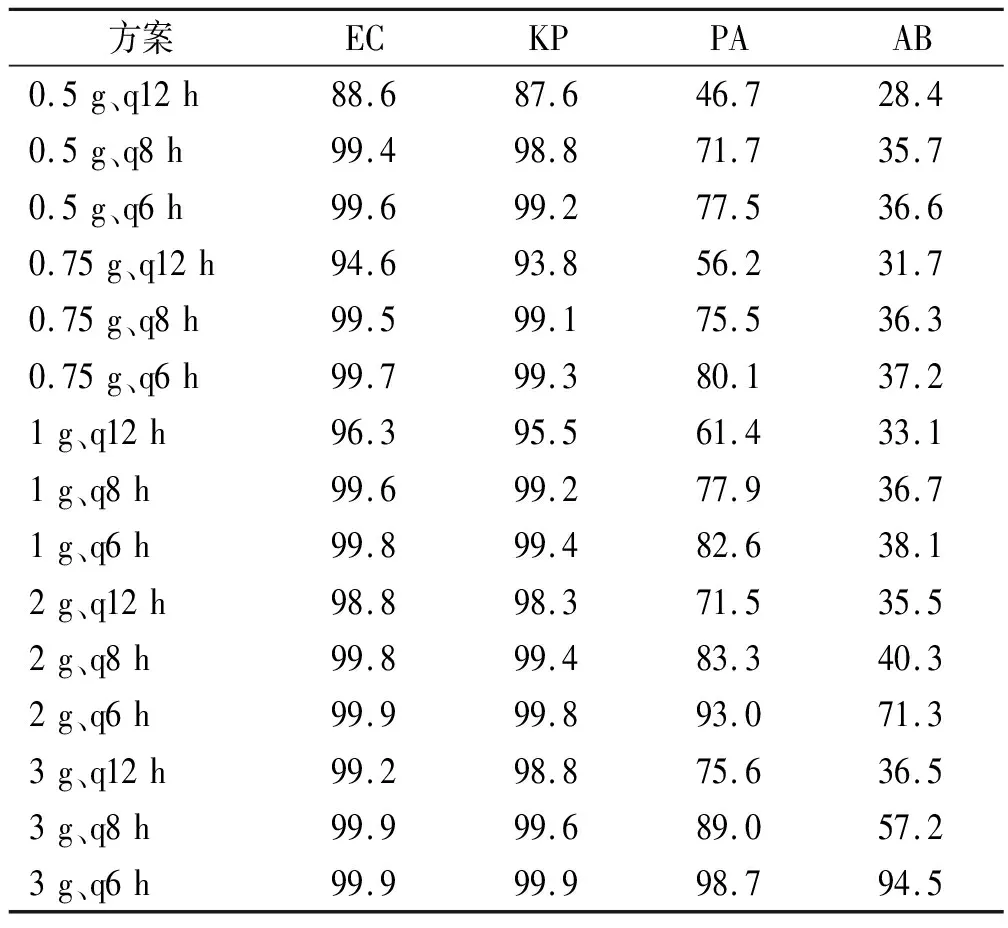
表3 非危重患者不同给药方案对4种GNB累计反应分数(以%T>MIC >40%为目标靶值)的蒙特卡洛模拟
2.2.2危重患者危重患者以%T>MIC>100%为目标靶值,不同给药方案对EC、KP、PA及AB的CFR见表4。对于EC和KP,0.5 g、q6 h,0.75 g、q6 h,1 g、q6 h,2 g、q8 h,2 g、q6 h,3 g、q8 h和3 g、q6 h的方案CFR能达到90%,其余方案均不能达标。对于PA及AB,所有方案CFR均不能达到90%,PA最高(3 g、q6 h)仅能达到67.7%,AB最高(3 g、q6 h)仅能达到31.1%。
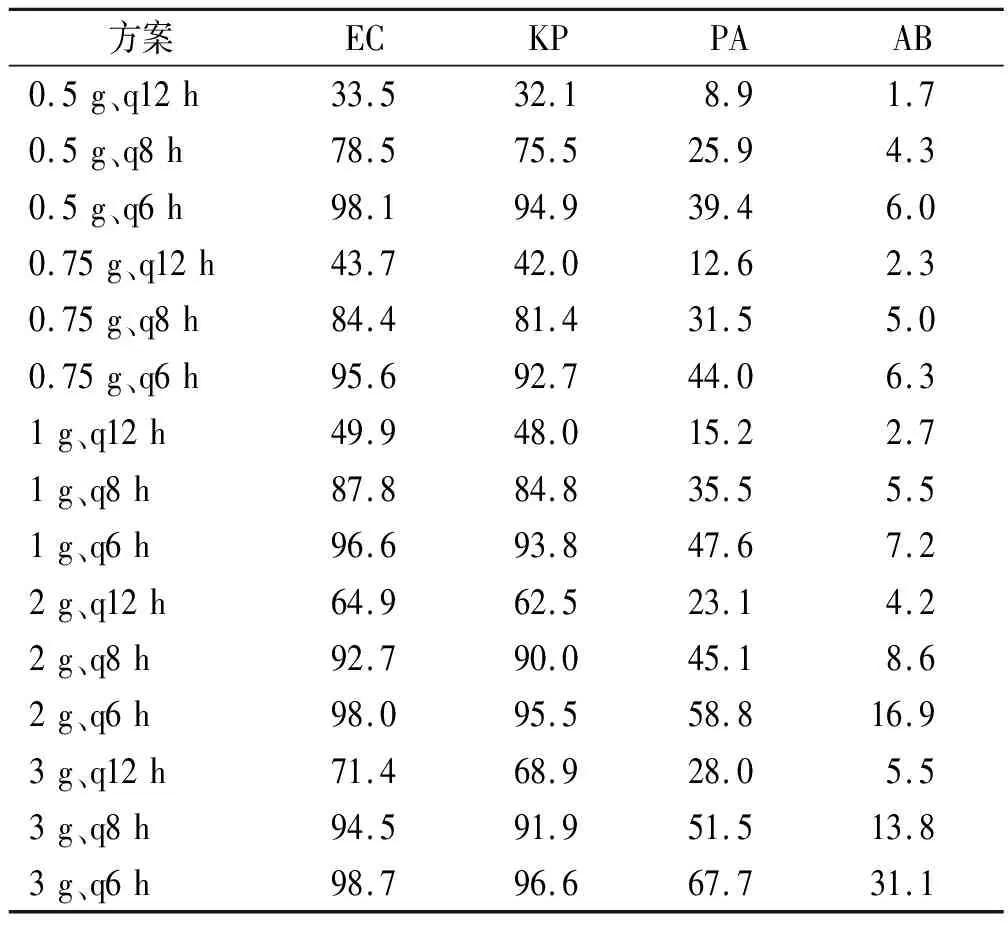
表4 危重患者不同给药方案对4种GNB累计反应分数(以%T>MIC >100%为目标靶值)的蒙特卡洛模拟
以%T>4MIC>50%为目标靶值,不同给药方案对EC、KP、PA及AB的CFR见表5。对于EC,除了0.5 g、q12 h,0.75 g、q12 h,1 g、q12 h,其余方案CFR均能达到90%。对于KP,仅0.5 g、q12 h,0.5 g、q8 h,0.75 g、q12 h,1 g、q12 h不能达标,其余方案均能达标。对于PA及AB,所有方案CFR均不能达到90%,PA最高(3 g,q6 h)仅能达到62.6%,AB最高(3 g,q6 h)仅能达到11.2%。
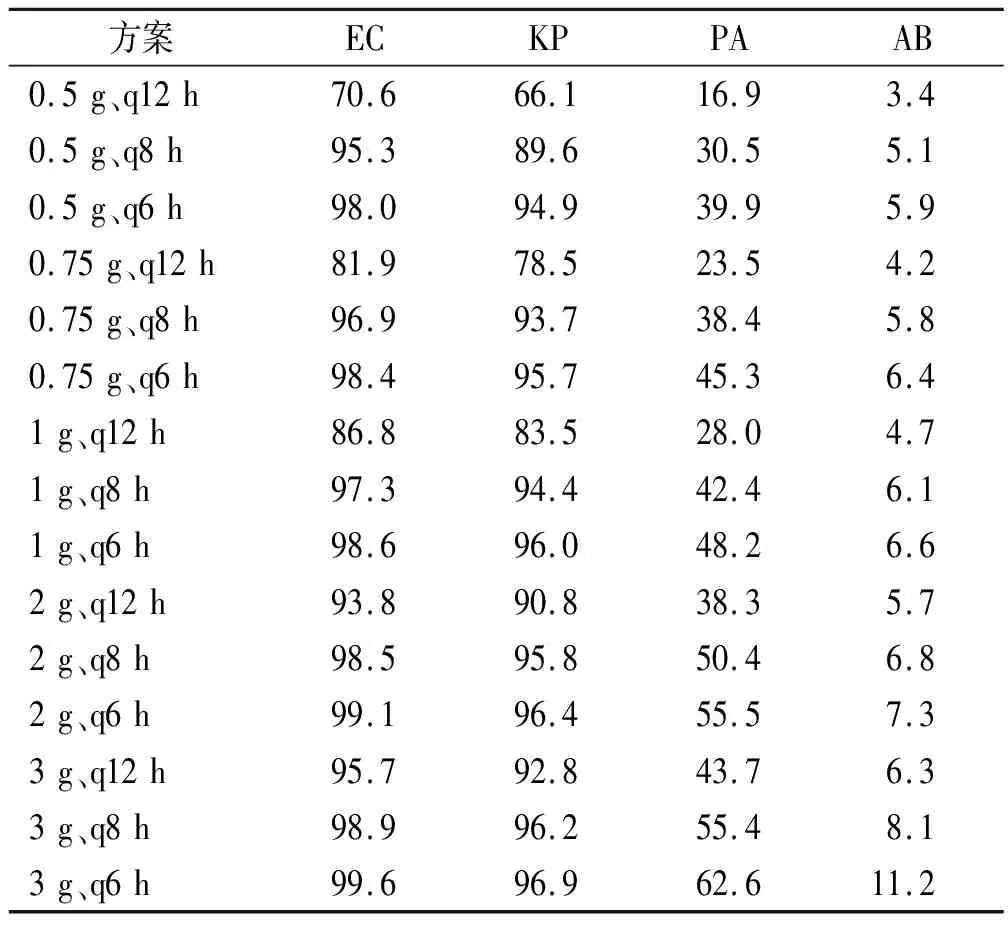
表5 危重患者不同给药方案对4种GNB的累计反应分数(以%T>4MIC >50%为目标靶值)的蒙特卡洛模拟
2.3不同给药方案抑制耐药突变的MCS
2.3.1非危重患者以%T>4MIC>100%计算非危重患者抑制耐药突变的CFR,不同给药方案对EC、KP、PA及AB的CFR见表6。
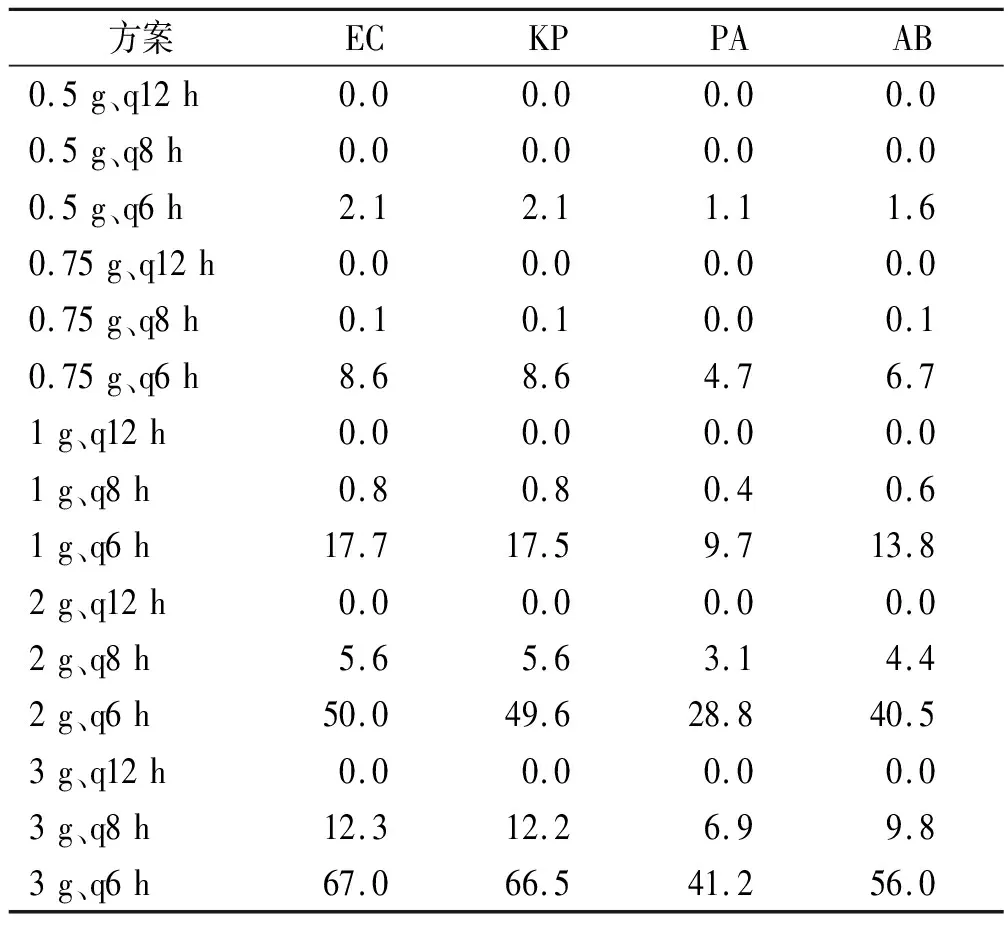
表6 非危重患者不同给药方案对4种GNB的累计反应分数(以%T>4MIC >100%为目标靶值)的蒙特卡洛模拟
2.3.2危重患者同样以%T>4MIC>100%计算危重患者抑制耐药突变的CFR,不同给药方案对EC、KP、PA及AB目标治疗的CFR,见表7。
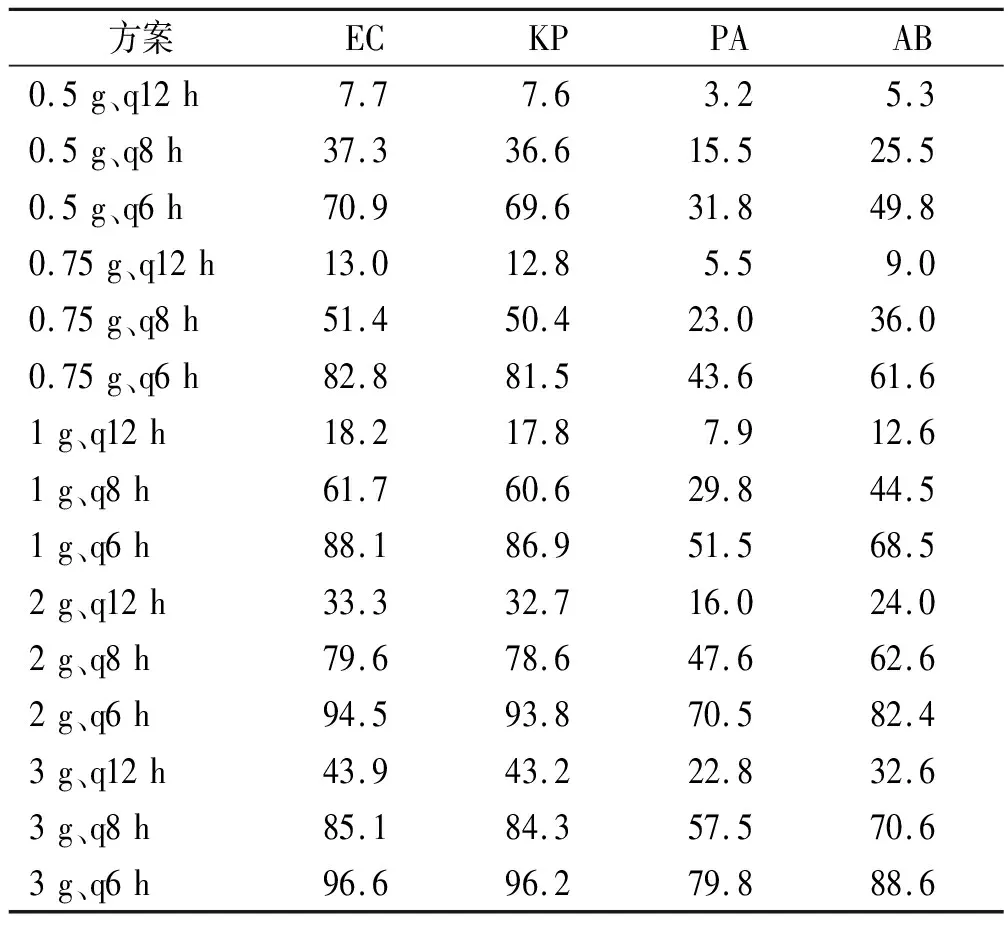
表7 危重患者不同给药方案对4种GNB的累计反应分数(以%T>4MIC>100%为目标靶值)的蒙特卡洛模拟
3 讨论
美国疾病控制和预防中心估计美国每年有200万人发生耐药菌感染,其中,23 000人因耐药菌感染致死[16]。有专家认为全球每年约70万人死于耐药菌感染,预计2050年将超过1000万人[16-17]。据2017年CHINET的监测结果显示,国内主要地区34 所医院临床分离的190 610株菌中,KP对亚胺培南和美罗培南的耐药率分别从2005年的3.0%和2.9%上升到了2017年的20.9%和24.0%,耐药率上升幅度高达8倍,与此同时,KP每年的分离率亦呈稳步上升趋势。PA对亚胺培南和美罗培南的耐药率分别为23.6%和20.9%。不动杆菌属(AB占91.5%)对亚胺培南和美罗培南的耐药率分别为66.7%和69.3%[18]。尽管如此,碳青霉烯类抗菌药物仍被誉为临床防治GNB感染的最后一道防线,其临床地位依然无可替代。目前能够帮助改善严重GNB感染的疗效唯一可行的策略就是使可用药物达到最佳利用。
目前,临床上美罗培南的用药方式有3种:传统输注法、延长输注法和持续静脉滴注法。3种方式各有利弊。迄今为止,既能达到有效性的目标靶值,又能延缓耐药性进展的给药方案,在临床上尚未达成共识并广泛开展。
对于非危重患者,以%T>MIC>40%作为有效性目标靶值,根据MCS结果,对于EC和KP,除0.5 g、q12 h的方案,其余方案CFR均>90%。对于PA,只有2 g、q6 h和3 g、q6 h的CFR能达到90%。对于AB,只有3 g、q6 h的CFR能达到90%。但同时,15种方案均不能有效地抑制耐药突变(以%T>4MIC>100%作为抑制耐药突变的目标靶值,CFR<90%)。对于危重患者,分别以%T>MIC>100%和%T>4MIC>50%作为有效性目标靶值,结果相似。对于EC和KP,只有部分方案CFR能达到90%。而对于PA和AB,所有方案CFR均不能达到90%,即使3 g、q6 h的方案治疗PA的CFR也仅能达到62.6%,治疗AB的CFR亦仅能达到11.2%。同时,危重患者仅有3 g、q6 h方案对EC和KP目标治疗能较好地抑制耐药突变(以%T>4MIC>100%作为抑制耐药突变的目标靶值,CFR≥90%)。由此可见,美罗培南目前的传统输注模式是增加其耐药风险的重要因素。需要综合考虑患者的生理病理状态、病原菌、MIC分布等数据,建立适宜的PK/PD模型,进一步优化当前的用药模式,尤其是危重患者推荐基于治疗药物监测采取延长输注或持续静脉滴注的方式以提高血药谷浓度的达标率,才能获得满意的治疗效果,同时将耐药突变风险最小化。
评估基于以下几个假设。
第一,PK参数的假设。根据文献获得美罗培南的 PK 参数,非危重感染患者以健康志愿者的PK参数模拟,危重患者以脓毒症患者PK参数模拟。而其他特殊的生理病理状态,例如老年患者、儿童及新生儿、肥胖患者、肾脏损伤患者、肝损伤患者、脓毒症及脓毒症休克患者、低蛋白血症等,PK参数均有差异,不能一一评估和罗列;而脓毒症患者是危重患者中一种典型而重要的病理状态,因此本研究仅选取PK参数明确并被引用较多的健康受试者和脓毒症患者两类人群进行实验室模拟,从而初步评估不同给药方式的优劣。
第二,菌种分布的假设。仅统计了分离率最高的4个菌种,即EC、KP、PA及AB,其他菌种耐药性不是特别突出,且所占比例较少,为便于模拟,忽略不计。
第三,给药方案的确定。本研究为美罗培南给药方案优化的系列研究之一,本部分研究仅模拟了使用最多的传统输注法,即均为0.5 h静脉滴注给药。延长输注法和持续静脉滴注法将在其他部分研究中详细讨论,本部分未纳入评估。美罗培南在临床相关指南中推荐常用量为每次0.5~1 g,每8~12 h给药一次;细菌性脑膜炎患者可增至2 g、q8 h给药,每日最大剂量不得超过6 g。美罗培南3 g、q6 h方案在指南中并未做出推荐,而是来自于1例70岁泛耐药铜绿假胞菌感染性休克患者的个案报道[8],患者,男,120 kg,美罗培南用量高达100 mg·kg-1·d-1。本研究对3 g,q12 h、q8 h和q6 h 3种给药方案也进行了模拟,将传统输注法的各个剂量方案一一列举,从而初步总结和阐述目前传统输注法的弊端,即使是使用3 g、q6 h的大剂量方案也难以达到兼顾有效性和抑制耐药突变的双重目标。
目前,PK/PD原理结合MCS制定给药方案的模式更多地聚焦于临床疗效。而本研究尝试利用该模式,首次制定了更为严苛的目标靶值(即T>4MIC>100%),从抑制耐药突变能力的角度,评估美罗培南传统输注法不同给药方案的耐药风险。本研究分别对15种给药方案抑制耐药突变的PTA和CFR进行MCS。除危重患者3 g、q6 h方案对EC和KP目标治疗,其余方案均不能达到抑制耐药突变的目标(CFR<90%)。因此,传统输注法的给药方案存在较大的耐药突变风险,需要进一步优化当前的用药模式,例如采取基于治疗药物监测的延长输注或持续静脉滴注的方式,建立给药方式与群体药动学之间的数理关系,并加以验证,尝试构建简单可行、便于临床接受的剂量调整的优化方案,将用药引起的耐药突变风险最小化。这些有待于更深入的研究。
需要说明的是,菌种与MIC分布、PK参数的偏倚以及PK/PD目标靶值的差异均可对MCS结果产生影响。因此,在临床实践中,要充分考虑本地区本医疗机构的细菌耐药情况、患者的生理病理状态对给药方案做出调整。然而,在缺乏微生物及PK数据的初始经验性用药时,本研究仍具有重要的参考价值。此外也需要多专业科室和研究机构合作,由检验科及时提供药物敏感试验数据及更新MIC 数值,由药动学专家建立和细化更合理的PK/PD模型,以达到合理化给药服务于患者的目标。
总之,美罗培南目前的给药模式是增加其耐药风险的重要因素,需要进一步优化当前的用药模式,才能获得满意的治疗效果,同时将用药引起的耐药突变风险最小化。
