沙棘熊果酸对酒精性肝病模型大鼠的保护作用*
2021-05-26李可欣张男男侯瑞丽张文龙高龙苗晓涵戈娜
李可欣,张男男,侯瑞丽,张文龙,高龙,苗晓涵,戈娜
(1.包头医学院营养与食品健康研究所,包头 014040;2.包头医学院第一附属医院骨外科,包头 014010)
酒精性肝病(alcoholic liver disease,ALD)是指长期和(或)大量酒精摄入所导致的肝脏损伤,肝细胞凋亡、脂肪变性、炎症、坏死等是它的主要表现形式[1-2]。世界卫生组织(WHO)在2018年《全球酒精与健康报告》中指出,全世界每年因饮酒而死亡的人数占全部死亡人数的5.3%,约300万人,其中2013年北京302医院接诊的ALD患者人数是2002年的2倍[3]。因此积极寻找一种预防及辅助治疗ALD的天然活性物质具有重要意义。沙棘(HippophaerhamnoidesL.)蒙名其察日嘎纳,含多种生物活性成分,是珍贵的药食两用植物[4]。本课题组前期从沙棘中提取的熊果酸是一种天然植物化合物,近年来已被广泛应用于食品、药品及化妆品中[5]。熊果酸具有保肝、抗炎、抗氧化、抗肿瘤等多种作用[6]。因此,本实验以沙棘熊果酸为研究对象,通过酒精诱导大鼠肝损伤模型,探讨沙棘熊果酸对酒精诱导性肝损伤的改善效果及可能的作用机制,为酒精诱导肝损伤的防治提供参考。
1 材料与方法
1.1材料沙棘果由内蒙古农业大学于呼和浩特市和林县境内野生沙棘林采集、提供,经内蒙古农业大学生命科学学院王玉珍教授鉴定(Shaji-2012-1215),分离纯化由内蒙古科技大学进行,并应用红外光谱、氢核磁共振谱(1H-NMR)和碳核磁共振谱(13C-NMR)鉴定为五环三萜类化合物[7]。熊果酸分子式为C30H48O3,相对分子质量为456.68,含量93.8%。
1.2主要试剂和仪器无水乙醇购自西陇科学股份有限公司;丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、三酰甘油(TG)试剂盒均购自南京建成生物工程研究所;TUNEL细胞凋亡检测试剂盒购自Roche公司(批号:11684817910);鼠抗GAPDH多克隆抗体购自美国Santa Cruz Biotechnology公司(批号:sc-47724);BCA蛋白浓度试剂盒(批号:P0012)、超敏电化学发光试剂盒(批号:P0018FS)、RIPA裂解液(批号:P0013B)、苯甲基磺酰氟(批号:ST506)、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)蛋白上样缓冲液(批号:P0015)均购自江苏碧云天生物技术研究所;羊抗兔Bcl-2(批号:MABC573)、Bax(批号:AB2915)、cleaved caspase-3(批号:ABC495)多克隆抗体购自美国Millipore公司;辣根酶标记山羊抗兔IgG(批号:ZB-2301)、辣根酶标记山羊抗小鼠IgG(批号:ZB-2305)均购自北京中杉金桥生物技术有限公司。
RM2135型石蜡切片机(德国LEICA公司);CX41照相显微镜(日本Olympus公司);BAYGENE电泳仪(北京百晶生物技术有限公司);550型全自动多功能酶标仪(美国BIO-RAD公司);UVP-GDS-8000凝胶成像分析系统(美国BIO-RAD公司)。
1.3实验动物与分组SPF级雄性Wistar大鼠50只,体质量(190±10)g,购自山东鲁抗医药股份有限公司,动物生产许可证号:SCXK(鲁)2014-0001。大鼠于室温(23±2)℃、相对湿度50%~60%、12 h光照循环的条件下进行饲养。
将适应性饲养7 d后的大鼠根据随机数字表进行完全随机分组,分为正常对照组、模型对照组和熊果酸小、中、大剂量组,共5组,每组10只。给药方式参考马浩然等[2]报道的方法,即模型对照组参考给予50%(V/V)乙醇8 mL·kg-1·d-1×2周+12 mL·kg-1·d-1×6周;正常对照组给予等体积的0.9%氯化钠溶液;熊果酸小、中、大剂量组分别给予熊果酸50,100,150 mg·kg-1·d-1,1 h后给予和模型对照组等体积乙醇。持续灌胃8周,最后一次灌胃后禁食不禁水12 h,将大鼠称重后用3%戊巴比妥钠30 mg·kg-1麻醉。腹主动脉取血,将血清以3000 r·min-1离心15 min(r=15 cm);留取肝组织,将部分肝组织进行固定,其余组织均置于-80 ℃冰箱中冻存。
1.4指标检测
1.4.1苏木精-伊红(HE)染色法观察每组大鼠肝组织病理情况将0.9 cm×0.9 cm×0.5 cm新鲜肝大叶组织放置于10%甲醛中固定,石蜡包埋切片,HE染色,中性树胶封片,光学显微镜下观察各组大鼠肝组织形态结构的改变。
1.4.2沙棘熊果酸对各组大鼠血清转氨酶及肝组织TG含量的影响各组大鼠ALT和AST水平检测严格按照ALT/AST测定试剂盒说明书进行,用酶标仪测量505 nm处吸光度(A值)并计算ALT和AST的含量。
取新鲜肝组织1 g,经过漂洗,拭干,剪碎后,加入适量磁珠及0.9%氯化钠溶液900 μL匀浆5 min,经3000 r·min-1离心15 min(r=15 cm)后取上清液,检测方法严格按照TG说明书进行,用酶标仪测量500 nm处A值,样本含量与A值成正比,以mmol·g-1表示。
1.4.3TUNEL染色法检测各组大鼠肝细胞的凋亡情况取新鲜肝脏组织做石蜡切片,严格按照TUNEL细胞凋亡试剂盒进行操作,光镜下(×200)观察,以凋亡细胞核内为黄色或棕黄色颗粒沉淀物为判定标准,计算肝细胞总数、凋亡肝细胞数、肝细胞凋亡率,分析大鼠肝细胞凋亡情况。
1.4.4免疫印迹法(Western blotting)测定每组大鼠肝组织Bcl-2、Bax及cleaved caspase-3的蛋白表达量 裂解大鼠肝组织提取总蛋白,12 000 ×g离心20 min,并收集上清液,采用BCA法测定蛋白浓度。按5份样品体积与1份loading buffer混匀,100 ℃孵育3 min,上样体积为10~20 μL,经5%~12% SDS-PAGE分离样品后将蛋白转至硝酸纤维素膜上,以5%脱脂奶粉封闭2 h,按操作加入相应的一抗(GAPDH抗体1:800、Bcl-2抗体1:1000、Bax抗体1:1000、cleaved caspase-3抗体1:1000)及适当稀释倍数的二抗。凝胶成像系统摄相分析。以GAPDH作为内参,用靶蛋白积分吸光度(IA)值/GAPDH(IA)值显示靶蛋白相对水平。
2 结果
2.1沙棘熊果酸对酒精诱导肝损伤大鼠肝组织病理改变的影响HE染色结果显示,正常对照组肝细胞轮廓完整且结构紧密、以中央静脉为中心向四周呈放射状分布;模型对照组肝细胞排列紊乱,且细胞质内散在空泡,肝组织内炎症细胞聚集,肝细胞呈现片状坏死;而熊果酸小、中、大剂量组肝细胞索排列均有不同程度的改善,炎症细胞浸润程度及坏死区域降低明显(图1)。
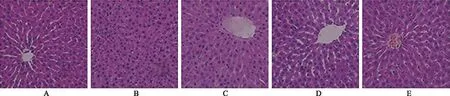
A.正常对照组;B.模型对照组;C.熊果酸大剂量组;D.熊果酸中剂量组;E.熊果酸小剂量组。
2.2沙棘熊果酸对酒精所致肝损伤大鼠血清ALT、AST及肝脏TG含量的影响见表1。模型对照组大鼠血清ALT、AST及肝脏TG含量均明显高于正常对照组(P<0.05);而熊果酸中、大剂量组大鼠血清ALT、AST的活力及肝脏TG含量均明显降低(P<0.05),且逐渐接近于正常对照组,熊果酸小剂量组大鼠血清ALT、AST的活力及肝脏TG含量与模型对照组差异无统计学意义(P>0.05)。
表1 5组大鼠血清ALT、AST及肝脏TG含量比较
2.3沙棘熊果酸对酒精诱导肝损伤大鼠肝细胞凋亡的影响TUNEL结果显示,正常对照组染色较淡,偶见凋亡细胞;模型对照组染色不均匀,可见大量棕褐色固缩或呈碎片状的细胞核,且染色的阳性细胞多集中在肝小叶、中央静脉肝附近,肝细胞凋亡率高达77%,与正常对照组比较,明显增高(P<0.05);与模型对照组比较,熊果酸小、中、大3个剂量组染色阳性细胞逐渐减少,染色变浅,核碎裂现象明显降低,凋亡率分别为63%,47%和30%,且熊果酸小剂量组与熊果酸大剂量组比较,肝细胞凋亡率明显升高(P<0.05)(图2和图3)。
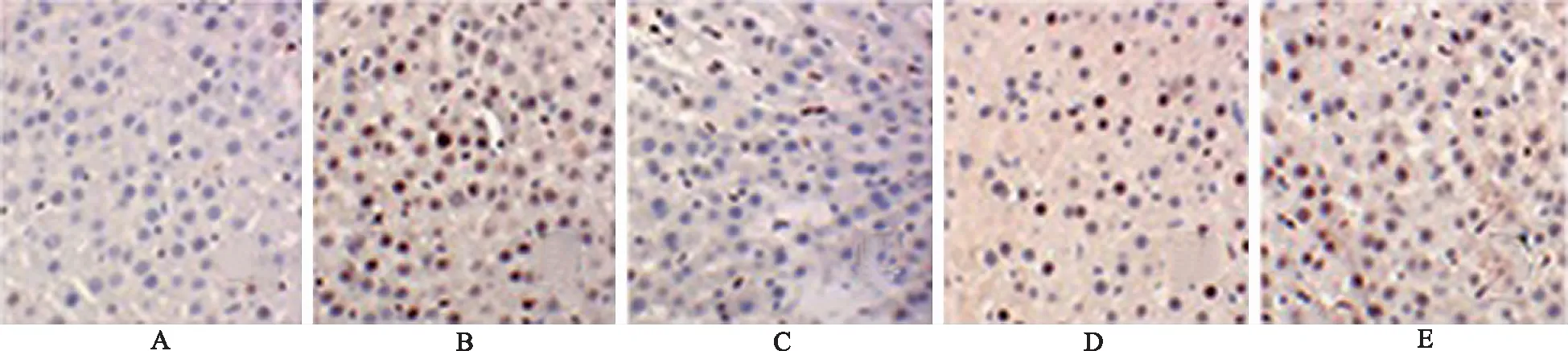
A.正常对照组;B.模型对照组;C.熊果酸大剂量组;D.熊果酸中剂量组;E.熊果酸小剂量组。
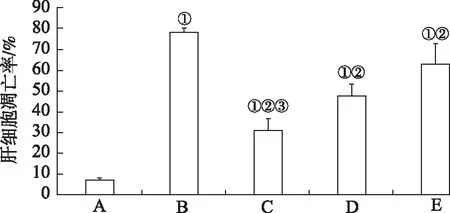
A.正常对照组;B.模型对照组;C.熊果酸大剂量组;D.熊果酸中剂量组;E.熊果酸小剂量组。①与正常对照组比较,t=-69.823~-9.457,P<0.05;②与模型对照组比较,t=3.561~17.611,P<0.05;③与熊果酸小剂量组比较,t=-6.767,P<0.05。
2.4沙棘熊果酸对ALD大鼠肝组织Bcl-2、Bax、cleaved caspase-3蛋白表达的影响 与正常对照组比较,模型对照组大鼠肝组织中Bcl-2蛋白表达量降低明显(P<0.05),Bax及cleaved caspase-3蛋白表达量均明显增高(P<0.05);熊果酸中、大剂量干预的大鼠相较模型对照组而言,肝组织Bcl-2蛋白表达量明显增高(P<0.05),而熊果酸小剂量组大鼠肝组织Bcl-2蛋白表达量无明显差异,熊果酸大剂量组大鼠肝组织Bax蛋白表达量明显减少(P<0.05),熊果酸小剂量组、中剂量组大鼠肝组织Bax蛋白表达量与模型对照组差异无统计学意义(P>0.05),熊果酸中、大剂量组大鼠肝组织cleaved caspase-3蛋白表达量较模型对照组明显降低(P<0.05),但熊果酸小剂量组差异无统计学意义(P>0.05)。见图4。
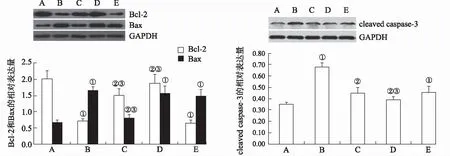
A.正常对照组;B.模型对照组;C.熊果酸大剂量组;D.熊果酸中剂量组;E.熊果酸小剂量组;①与正常对照组比较,t=-19.682~12.778,P<0.05;②与模型对照组比较,t=-14.409~20.195,P<0.05;③与熊果酸小剂量组比较,t=-11.288~15.734,P<0.05。
3 讨论
目前关于大鼠酒精致肝损伤的造模方式有4种:自由饮用模型、胃内喂养模型、腹腔注射模型及酒精灌胃模型[8],但由于饮用量无法控制、摄入途径不符合等不可控因素,本研究选用酒精灌胃方式,与酒精诱导肝损伤的生理生化和病理特征及人的饮酒习惯相结合,给予阶梯式灌胃,成功建立酒精致肝损伤大鼠模型[9]。HE染色观察肝组织变化是临床上反映肝脏损伤程度的金标准[10],ALT和AST是检测肝脏损伤的敏感指标[11],其活性水平的高低可在一定程度上体现生物体内肝细胞损伤的情况[12]。实验表明,慢性酒精中毒可引起肝细胞中TG不能正常输出,导致肝脏中TG的堆积[13]。本研究表明,模型对照组血清ALT、AST及肝组织TG含量均明显升高,肝细胞部分呈现片状坏死,肝细胞索排列不规则,且存在大量脂肪空泡,这与肝损伤导致TG堆积互相印证。而经熊果酸干预8周后,大鼠肝细胞坏死程度明显降低,肝细胞索排列较为整齐,血清ALT、AST及肝组织TG含量均有不同程度下降。
长期摄入酒精可致生物体内肝细胞异常凋亡,其凋亡程度与酒精致肝损伤程度呈正相关[14],故如何减轻肝细胞凋亡程度对ALD的预防与治疗具有重要意义。参与肝细胞凋亡发生发展的基因有许多,与其关系最密切的调控基因为Bcl-2家族的Bcl-2及Bax基因[15]。Bcl-2基因具有抗肝细胞凋亡的作用,而Bax基因可促进肝细胞凋亡,这对基因分别以同源及异源二聚体存在[16]。当Bcl-2过表达时形成异源二聚体Bcl-2-Bax,可有效减轻多因素诱导的肝细胞凋亡;当Bax过表达时形成Bax同源二聚体,可直接诱导肝细胞发生凋亡[17]。因此,Bcl-2与Bax的表达在体内常呈现一种平衡状态。一旦失衡,将对肝细胞的存活或凋亡产生影响。通过增加Bcl-2的表达可抑制caspase-3的激活而减缓肝细胞凋亡的进程[18]。细胞凋亡的程序启动大多由天冬氨酸的特异水解酶(caspase)引发,caspase-3是caspase家族中细胞凋亡促进过程中最主要的执行者[19]。caspase-3在一般情况下以无活性的酶原(Pro-caspase)形式存在,当肝细胞凋亡程序被激活时,Pro-caspase将转变为有活性的裂解caspase-3,其可促进肝细胞的凋亡过程[20]。所以,cleaved caspase-3常被作为判断肝细胞凋亡情况的重要指标之一。caspase-3激活将使Bcl-2的功能由抑制凋亡转变为触发凋亡,而阻止caspase-3的激活将抑制Bcl-2的降解[21]。本研究结果显示,熊果酸组大鼠肝组织中Bax蛋白表达明显受到抑制,而Bcl-2蛋白的表达明显增加,阻止caspase-3的活化。提示熊果酸可能通过调节肝组织中Bcl-2、Bax、cleaved caspase-3蛋白的表达起到抗凋亡作用,进而发挥防治ALD的作用。
综上所述,沙棘熊果酸能够明显改善ALD,其机制可能为调节抑凋亡蛋白Bcl-2、促凋亡蛋白Bax和执行凋亡蛋白cleaved caspase-3的表达,进而降低肝细胞异常凋亡。因此,沙棘熊果酸可作为一种具有潜在保肝作用及药用价值的天然植物化合物,值得进一步开发和研究。
