人肺腺癌细胞A549低温保存优化研究
2021-05-26杜羽琨周新丽
杜羽琨,周新丽
(上海理工大学 医疗器械与食品学院,上海 200093)
人肺腺癌细胞A549既有肺泡上皮细胞的形态及特性,又表现出典型的肺腺癌恶性特征,广泛用于体外肺癌发病基因筛查、药物筛选等临床研究[1-2],因此,临床研究工作对高质量肺癌细胞样本有较大的需求。低温保存是样本库长期储存大量肺癌细胞的常用方法,可以在需要时提供大量高质量样本用于临床基础研究,以及其他医学研究,例如,扩增生物样品、培养细胞微团、建立人源肿瘤异种移植模型(patient-derived tumor xenograft,PDX)或培养类器官。目前,样本库中大多数细胞样本采用传统慢速冷冻方法进行低温保存,具体方法是采用10%(体积分数) me2SO作为低温保护剂,将装有细胞悬液以及保护剂的冻存管放入程序降温盒中,再将程序降温盒放入−80℃冰箱中,24 h后转移至液氮中保存。然而,使用这种方法,复苏后细胞回收率还不够高,细胞活力相对新鲜细胞较差,且不同的细胞所适宜的冷冻方法和条件有较大差异[3-6],所以,有必要针对样本库中人肺腺癌细胞A549,研究其适宜的低温保存方式以及低温保护剂。
传统的慢速冷冻降温过程中,低温保护剂会出现过冷的现象,溶液结晶释放潜热使样品温度迅速回升,导致样品温度与冷源温度的温差较大,使溶液结冰速率过快,细胞没有足够长的脱水时间,形成胞内冰损伤,不利于细胞低温保存。“置核”是目前最有希望解决过冷问题的方法之一,通过人为的操作,在溶液内部形成小范围低温区,以此引发晶核的形成,消除溶液过冷。Huang等[7]通过在容器外形成局部冷点诱发成核的置核方法,并配合无Me2SO低温保护剂对NIH 3T3小鼠成纤维细胞实现了成功的低温保存,复苏后细胞回收率为78.1 ± 4.8%,与传统慢速冷冻组复苏后的细胞回收率无显著差异。Zhang等[8]通过手工置核的方法,对牛卵巢组织进行低温保存,复苏后原始卵泡的存活率为76.9%±3.5%。目前的置核方法大多需要手动植冰,增加了样本污染的风险,同时不便于进行大批量细胞的置核。非接触置核是采用瞬时改变冷源温度造成管壁外接触面局部过冷,在接触面内形成稳定的晶核,无需采用手动植冰,改变冷冻设备的冷冻程序实现大批量的置核。Diener等[9]采用瞬时改变程序降温仪的降温速率的方法,先将箱体内温度以2℃/min降温至−8℃,再在6 s内将箱体温度降温至−28℃,在这期间冻存管内溶液实现了非接触置核,并使用该方法对肝实质细胞进行低温保存,复苏后细胞相对新鲜组存活率(86±5%)高于传统慢速降温组相对新鲜组存活率(79±5%)。
10%(体积分数)Me2SO是样本库中低温保存肺癌细胞的常用保护剂。虽然Me2SO能够降低保存液的冰点,减少胞内冰晶形成[10],但是,Me2SO单独使用对细胞具有毒性作用,Me2SO通过干扰细胞代谢、酶活性、细胞周期等影响细胞的生长和功能,导致细胞死亡[11],因此,寻找更安全的冷冻替代方案越来越重要。Kasai等[12]通过对小鼠胚胎的研究表明乙二醇(EG)的毒性小于Me2SO,但对细胞膜的渗透性,Me2SO好于EG[13]。可将两种渗透性保护剂按一定比例联用,减小保护剂的毒性,该组合被广泛用于卵母细胞的深低温保存[14],其效果明显优于单独使用Me2SO和EG[15-16]。海藻糖是一种非渗透性保护剂,它的添加一方面可避免低温环境对细胞膜蛋白质和脂质的损伤,另一方面可将细胞膜的蛋白质分子进行包裹,使之不易变形,抑制细胞膜融合,降低细胞膜的通透性。
本文首先对肺癌细胞A549低温保存方法进行了优化,在降温过程中通过快速改变程序降温仪的降温速率的方法实现非接触置核,并与传统的慢速冷冻降温程序的过冷度以及细胞冻存效果进行比较。再对肺癌细胞A549低温保护剂进行优化,筛选联用EG,Me2SO的体积分数以及添加海藻糖的最佳浓度,通过检测复苏后肺腺癌细胞的回收率,采用流式细胞仪检测细胞凋亡情况、聚合酶链式反应(polymerase chain reaction,PCR)检测细胞的凋亡相关基因表达,对肺癌细胞A549的低温保存方案进行评估。研究结果可为冻存大量肺腺癌细胞提供一种操作简便且效果好的冷冻方案。
1 材料与方法
1.1 材料与试剂
人肺癌细胞A549、胎牛血清(fetal bovine serum,FBS)、胰蛋白酶、DMEM培养基(上海励瑞生物科技有限公司);二甲基亚砜(Me2SO)(GIBCO公司);乙二醇(EG)、海藻糖(中国医药集团上海化学试剂公司);青霉素、链霉素(Sigma公司)。细胞凋亡检测试剂盒(上海元象医疗器械有限公司)、RNAiso Plus、反转录试剂盒、实时荧光定量PCR试剂盒(宝日医生物技术(北京)有限公司)。
1.2 细胞培养
将肺癌细胞A549用含10% FBS、1%(体积分数)青霉素的DMEM完全培养液接种于T75培养瓶中,置于37℃,5%CO2,70%湿度的培养箱中培养。培养至细胞融合度达到80%~90%时,进行消化传代,以备进行后续实验。
1.3 低温保护剂配置
配制16组不同的低温保护剂配方。1−4组分别为5%,10%,20%,50%(体积分数)Me2SO;5−8组为5%,10%,20%,50%(体积分数)EG;9−11组为7.5%(体积分数)Me2SO+2.5%(体积分数)EG,5%(体积分数)Me2SO+5%(体积分数)EG,2.5%(体积分数)Me2SO+7.5%(体积分数)EG;12−16组为7.5%(体积分数)Me2SO+ 2.5%(体积分数)EG分别添加100,200,300,500,1000 mmol海藻糖。将配制好的低温保护剂用0.22 μm针式滤器过滤除菌,用封口膜封住瓶口,放置于4℃冰箱备用。
1.4 细胞低温保存与复苏
肺癌细胞用胰蛋白酶消化后从培养瓶中吸出至离心管中,将离心管放置在离心机中以200 g离心5 min,然后重悬于3 mL冻存液中,细胞密度为1×106个/mL,分别取1 mL细胞悬液加入3支2 mL冻存管中。
传统慢速冷冻方法:将装有细胞悬液的冻存管在4℃平衡10 min后,放入程序降温盒(Nalgene,上海励瑞生物科技有限公司),再放入−80℃冰箱。该程序降温盒在−80℃冰箱内的降温速率为1℃/min,24 h后放入液氮中进行长期储存。
非接触置核慢速冷冻方法:在Diener等[9]降温程序基础上进行修改,将装有细胞悬液的冻存管在4℃下平衡10 min,随后将冻存管放入程序降温仪(赛默飞世尔生物化学制品有限公司,上海)中,首先将样本以1℃/min降温至−9℃;随后仓体内温度以50.0℃/min 降温至−50℃,再立刻以15.0℃/min升温至−25℃并平衡3 min;再将样品以1.0℃/min 降温至−50℃;样本以10.0℃/min降温至−90℃,最后放入液氮中进行长期储存。降温过程中使用程序降温仪内热电偶对舱体温度以及样本中心温度进行实时监测。
复苏时,从液氮中取出冻存管,在37℃水浴锅中轻轻快速摇晃冻存管,直至管内细胞悬液完全融化。室温下轻轻吹打细胞悬液后,立即进行活性检测。
1.5 AO/PI染色
将冻存前和复温后的细胞吹打混匀,取15 μL细胞悬浮液和15 μL吖啶橙、碘化丙啶(acridine orange/propidium iodide,AO/PI)溶 液,混 匀 静 置1 min后,滴加在细胞计数板上,放入细胞计数仪(Countstar Rigel S2,睿钰生物科技有限公司,上海)进行统计。细胞回收率A按以下公式进行计算:

式中:α为复温后活细胞数;β为冻存前活细胞数。
1.6 流式细胞术
将冻存前和复温后的细胞悬液离心,并用磷酸缓冲盐溶液(phosphate buffer saline,PBS)清洗细胞2次以备使用。按照细胞凋亡检测试剂盒的操作说明添加试剂,1 h内使用流式细胞仪(FACS Calibur TM,碧迪医疗器械有限公司,上海)进行测试。流式细胞仪可根据荧光将正常细胞、早期凋亡细胞、晚期凋亡细胞以及死细胞区分,并根据筛选细胞总数计算处于各个时期的细胞百分率。
1.7 实时荧光定量PCR(RT-PCR)
将冻存前和复温后的细胞悬液离心,并用PBS缓冲液清洗细胞2次以备使用。按照PCR TB Green®Premix Ex TaqTMII(宝日医生物技术有限公司,北京)试剂盒的操作说明,对样本的抑制细胞凋亡基因Bcl-2以及促凋亡基因Bax,Bad进行测定,以β-actin为内参基因。
1.8 数据分析
采用SPSS 18.0软件的ANOVA(analysis of variance)对数据进行方差分析、Duncan多重比较。使用Excel和Origin 9.0进行绘图。
2 结果与分析
2.1 传统慢速冷冻与非接触置核慢速冷冻方法的比较
采用传统慢速冷冻与非接触置核慢速冷冻方法低温保存肺癌细胞A549,低温保护剂采用10%(体积分数)Me2SO,复苏后细胞回收率如表1所示。使用传统慢速冷冻法冻存复苏后细胞回收率为76.06±3.49%。使用非接触慢速冷冻程序冻存复苏后细胞回收率为86.72±3.86%。结果表明,使用非接触式置核慢速冷冻程序的细胞冻存效果明显好于使用传统慢速冷冻程序的细胞冻存效果。

表1 不同低温保护剂的细胞回收率Tab.1 Cell recovery rate with different cryoprotectants
对传统慢速冷冻和非接触置核慢速冷冻法的温度变化进行测定。传统慢速冷冻法程序降温盒中的液体温度、样本温度如图1(a)所示,当样品温度降温至−19.4℃时,样本中低温保护剂出现结晶,样本温度上升,回温至−10.8℃,溶液过冷度为8.6℃,此时环境温度为−34.5℃,样品与冷源温差为23.7℃。样本中溶液结晶后,样本温度先快速降低后缓慢降低,最后跟随环境温度逐渐降低。

图1 温度变化曲线Fig. 1 Temperature change curve
非接触置核慢速冷冻降温过程中的舱体温度、样本温度如图1(b)所示,样品在4℃停留10 min以加载低温保护剂,之后以1℃/min降温至−9.0℃,在该温度进行非接触置核。调整程序降温仪舱体降温速率,将舱体迅速降温至−50℃,在管壁接触面制造局部冷点,在接触面形成稳定的晶核,样本中溶液出现结晶并迅速回温至−5℃,溶液过冷度为4℃,相对传统慢速冷冻,低温保护剂的过冷度较低,此时与样品温度差为45℃。样本温度出现短暂停滞后迅速下降,与此同时舱体温度上升至−25℃,避免样本因降温速率过快,导致细胞不能及时脱水而造成冰晶损伤。舱体温度在−25℃平衡3 min,随后环境温度缓慢降低,样本温度先快速降低,在与环境温度不断接近后,跟随舱体温度缓慢降低。
传统慢速冷冻和非接触置核慢速冷冻法样本温度变化对比如图1(c)所示。传统慢速冷冻方法低温保护剂在−19.4℃开始结晶,由于低温保护剂的过冷度较大,造成大量细胞外冰晶形成,且冰晶生长迅速,极有可能对低温保护剂中的细胞造成机械损伤[17-18]。细胞外冰晶的快速形成,导致细胞内水分来不及脱出,造成细胞内溶液过冷形成冰晶对细胞造成损伤。温度的暂时升高也可能导致重结晶,加剧冰晶损伤[19]。此外,随着环境温度接近−80℃,样本温度的降温速率不断降低,较慢的降温速率不利于细胞内的溶液非晶态固化。非接触式置核慢速冷冻下低温保护剂在−9℃开始结晶,由于过冷度较低,形成的冰晶数量少且生长较慢,从而使细胞内水分能够充分脱出,同时在样本温度达到−50.0℃后样本温度变化较快,较快的降温速率可使细胞内溶液实现或接近玻璃态固化,从而减少降温过程中的冰晶损伤。显然,非接触置核慢速冷冻法更符合两步法对细胞冻存的保护机理。
2.2 不同保护剂对肺癌细胞A549低温保存效果的影响
目前低温保护剂种类繁多,它们的毒性和渗透性有很大差别[20],合理地选择和配制低温保护剂至关重要。使用AO/PI染色对复温后细胞回收率进行检测,用不同低温保护剂冻存细胞,复苏后细胞回收率结果如表1所示。在DMEM中只添加Me2SO作为低温保护剂(1−4组),Me2SO体积分数为10%时,细胞回收率为86.72±3.86%,低温保存效果最佳。Me2SO体积分数在20%及以上时,细胞回收率显著降低(P<0.05),Me2SO体积分数为50%时,细胞回收率为0.95±0.77%。Me2SO含量越多,保护剂对细胞的渗透及毒性损伤越大,细胞受损越严重。在DMEM中只添加EG作为低温保护剂(5−8组),EG体积分数为10%时,细胞回收率为82.40±5.40%,保存效果明显好于其他组(P<0.05),EG体积分数为50%时,回收率为3.46 ±1.11%。
由于EG的毒性小于Me2SO,使用Me2SO,EG的最优体积分数同为10%,所以,在渗透性保护剂体积分数恒定的情况下,考虑使用EG取代一部分Me2SO,以此减小低温保护剂的毒性。对比2,6,9−11组,在联用Me2SO,EG添加在DMEM中作为低温保护剂时,7.5% me2SO + 2.5% EG细胞回收率为88.14±0.61%,保存效果优于其他配比。
因使用7.5% me2SO + 2.5% EG配比的保护剂保存效果明显好于其他组,所以,在此基础上优化海藻糖浓度,进一步提升低温保存效果。对比9,12−16组,结果发现,随着海藻糖浓度的增加,细胞存活率无显著差异(P>0.05),但细胞回收率先增大后逐渐减小。在海藻糖浓度为100 mmol/L时,细胞回收率为88.75±1.99%,与不添加海藻糖组无显著差异(P>0.05),说明低浓度海藻糖不能很好地发挥保护细胞膜的作用。在海藻糖浓度为200 mmol/L时,细胞回收率为91.59±1.51%,显著高于其他浓度下的细胞回收率(P<0.05)。
在自然界中,海藻糖是一种重要的小分子,通过维持渗透压平衡来保护细菌和植物在干燥环境中生存[21-23],Kempf等[24]使用10%(体积分数)Me2SO+200 mmol海藻糖作为低温保护剂,采用慢速冷冻方法低温保存人胚胎干细胞,得到了较高的细胞回收率,且使未分化基因得到很好保护。添加海藻糖,一方面,降低了Me2SO体积分数,使得产生的毒性降低;另一方面,适当添加海藻糖有利于平衡渗透压,细胞的渗透性损伤和细胞结构及骨架的损伤较小,从而保护细胞膜不破裂,同时减少冰晶的形成。实验中发现,海藻糖浓度过低时,对细胞膜和蛋白质的保护作用不明显,添加200 mmol以上海藻糖时,细胞回收率显著降低,说明较高浓度海藻糖可能会影响细胞膜表面酶的活性,使EG和Me2SO不易进入细胞,导致细胞脱水直至死亡[25]。
2.3 肺癌细胞A549凋亡情况
选取新鲜组以及DMEM,10%(体积分数)Me2SO,10%(体积分数)EG,7.5%(体积分数)Me2SO + 2.5%(体积分数)EG,7.5%(体积分数)Me2SO + 2.5%(体积分数)EG +200 mmol海藻糖这5组溶液保存的细胞进行流式检测,分析细胞凋亡情况。如图2所示,新鲜对照组的正常细胞比率为94.44±0.43%,晚期凋亡和坏死细胞为3.68±0.29%。经过冷冻后实验组的正常细胞比例都显著降低(P<0.05),表明无论添加哪种保护剂,低温造成的细胞损伤都是不可避免的。未添加保护剂,只使用DMEM冷冻后的正常细胞比率为2.11±0.71%,10%(体积分数)Me2SO实验组的正常细胞比率为88.32±0.57%,晚期凋亡和坏死细胞比率为10.59±0.92%,10%(体积分数)EG实验组的正常细胞比率为84.61±3.16%,晚期凋亡和坏死细胞比率为12.49±1.73%。7.5%(体积分数)Me2SO + 2.5%(体积分数)EG实验组的正常细胞比率为88.63±1.11%,晚期凋亡和坏死细胞比率为9.36±2.06%,7.5%(体积分数)Me2SO+2.5%(体积分数)EG+200 mmol 海藻糖实验组的正常细胞比率为91.26±0.69%,晚期凋亡和坏死细胞比率为6.66±1.12%,与新鲜组相比差异较小。
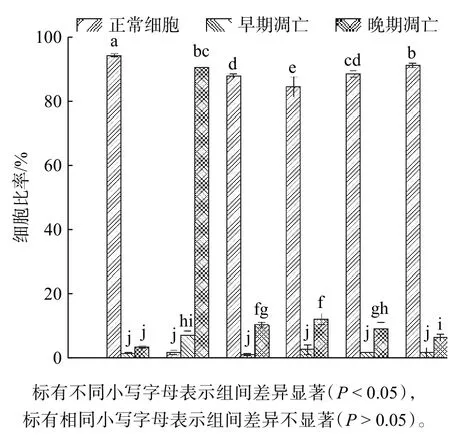
图2 各个时期细胞比率Fig.2 Cell ratio at various stages
2.4 肺癌细胞A549的凋亡相关基因表达
通过RT-PCR检测,使用7.5%(体积分数)Me2SO + 2.5%(体积分数)EG + 200 mmol 海藻糖低温保护剂,冷冻前、后肺癌细胞A549凋亡相关基因(Bcl-2,Bax 和Bad)表达量的变化如图3所示。RT-PCR分析结果表明,低温保存处理组的RNA表达量的差异较大。Bcl-2基因是一类抑制凋亡基因,对肿瘤细胞的凋亡起抑制作用。如图3所示,与新鲜组相比,Bcl-2 基因表达量显著增加(P<0.05)。Bax基因和Bad基因是一类促凋亡基因,与新鲜组相比,冷冻后的各实验组Bax,Bad基因表达量显著增加(P<0.05)。

图3 细胞凋亡相关基因表达量Fig. 3 Apoptosis-related gene expression
相对于新鲜组细胞,7.5%(体积分数)Me2SO +2.5%(体积分数)EG + 200 mmol 海藻糖组低温保存后Bax,Bad基因表达量显著增加,表明低温环境以及低温保护剂诱导细胞中Bax,Bad基因过表达,加剧了细胞凋亡。同时Bcl-2基因过表达,且明显高于Bax,Bad基因。Joensuu等[26]发现在癌变组织内Bcl-2的高表达可延长乳腺癌患者的生命。表明7.5%(体积分数)Me2SO + 2.5%(体积分数)EG + 200 mmol 海藻糖可以有效地抑制细胞凋亡,提高A549细胞抗凋亡能力。
3 结 论
对肺癌细胞A549的低温保存方法及低温保护剂进行优化,研究结果表明:
a.非接触式置核慢速冷冻可将低温保护剂过冷度降低为4℃,使用该低温保存方法的低温保存效果优于传统的慢速冷冻,非接触式置核慢速冷冻和传统慢速冷冻的细胞回收率分别为86.72±1.86%,76.06±3.49%。
b.7.5%(体积分数)Me2SO+2.5%(体积分数)EG+200 mmol海藻糖作为肺癌细胞A549低温保护剂的细胞回收率(91.59±1.51%)高于使用10%(体积分数)Me2SO作为肺癌细胞A549低温保护剂的细胞回收率(86.72 ±1.86%)。
c.流式细胞、RT-PCR结果显示,使用7.5%(体积分数)2SO+2.5%(体积分数)EG+200 mmol 海藻糖作为低温保护剂,正常细胞比例最高,且可以很好地抑制细胞凋亡。
肺癌组织研究价值极高,将病变组织与新鲜组织的蛋白表达、基因序列进行检测,可用于探究其发病机理以及制作类器官等研究。所以,未来研究应更关注肺癌样本库中细胞微团、肿瘤组织的活性及质量,这对样本库的建立具有十分重要的意义。
