白内障超声乳化手术中不同切口的应用及对角膜地形图与角膜散光的影响刘萍萍
2021-05-26管怀进卞洪俊张靖东姜瑾
管怀进 卞洪俊 张靖东 姜瑾
白内障是由于先天或后天性各种因素导致晶状体混浊,视力逐渐下降并最终造成失明的一种疾病。近年来,由于白内障摘除手术的广泛开展,白内障致盲率明显下降[1]。手术形式由原来的大切口转变为小切口再到现在的的超声乳化术,手术本身也得到了质的提高。1976年,Kelman完成首例超声乳化术,该手术具有切口小、术后恢复快、术后散光小等诸多优势,利用流体动力学,以灌注与抽吸所产生的负压破碎混浊晶状体核并吸除皮质[2]。随着现阶段超声乳化技术的日益完善,白内障手术正逐步从复明手术向屈光手术转变,由手术切口所导致的角膜散光问题也越来越受到临床工作者重视,如何最大限度减少手术源性散光,帮助患者更好地恢复视功能,成为眼科医生最关心的问题之一[3,4]。本研究通过比较不同切口的应用对超声乳化术后患者角膜地形图与角膜散光的影响,旨在为正确选择手术切口方向以达到较好的视觉质量提供依据。
资料与方法
一、一般资料
回顾性分析本院2018年9月至2019年12月共181例(200只眼)行白内障超声乳化手术患者临床资料,依照患者切口,行强轴角膜切口的患者62例(70只眼)纳入A组,将行颞侧透明角膜切口57例纳入B组(62只眼),行右上方透明角膜切口62例纳入C组(68只眼)。A组包括男性33例,女性29例;年龄50~80岁,平均(64.76±6.05)岁;以 Emery 标准进行晶状体硬度分级,Ⅰ级核5只眼,Ⅱ级核33只眼,Ⅲ级28只眼,Ⅳ级核4只眼。B组包括男性30例,女性27例;年龄53~79岁,平均(64.95±5.88)岁;以 Emery 标准进行晶状体硬度分级,Ⅰ级核4只眼,Ⅱ级核29只眼,Ⅲ级24只眼,Ⅳ级核5只眼。C组包括男性32例,女性30例;年龄50~80岁,平均(64.76±6.05)岁;以 Emery 标准进行晶状体硬度分级,Ⅰ级核5只眼,Ⅱ级核30只眼,Ⅲ级29只眼,Ⅳ级核4只眼。3组患者一般资料比较(P>0.05)。
二、纳入标准
(1)年龄相关性白内障,患者矫正视力眼前指数至0.3;(2)年龄 45~80岁;(3)患者配合相关检查;(4)晶状体核分级为Ⅰ~Ⅳ级。
三、排除标准
(1)合并严重的高血压或糖尿病等全身性疾病影响手术进行;(2)合并高度近视,玻璃体液化及晶状体韧带脆弱;(3)合并眼外伤;(4)角膜曲率<40 D 或>50 D;(5)角膜出现白斑,角膜混浊影响成像;(6)术后创口漏水使用创口缝线进行缝合;(7)既往眼部手术史;(8)术前角膜内皮细胞计数水平<1800 个/mm2;(9)合并青光眼等并发症。
四、方法
A组行强轴角膜切口,切口的部位是最大角膜屈光力子午线轴位,B组行颞侧透明角膜切口手术,沿颞侧角膜缘内0.5~1.0 mm(左眼:3点钟方位;右眼:9点钟方位);C组行右上方透明角膜切口,沿右上方角膜缘0.5~1.0 mm(左眼在鼻侧,右眼在颞侧);使用3.0 mm角巩膜穿刺刀,垂直角膜进行穿刺约 0.5 mm,角膜板层中移行1.75 mm左右,穿刺进入前房,注入1.0%透明质酸钠,连续环形撕囊,直径约为5.5 mm,核上水分离、层间水分离结合充分水分离皮质及核,当晶状体核可以自由旋转后,吸出晶状体核与皮质,前房内注入1.0%透明质酸钠,扩大切口,囊袋中植入合适的丙烯酸酯折叠型人工晶状体,将黏弹剂吸出,前房重建,闭合切口。
五、观察指标
1.视力恢复情况:通过国际标准视力表,测定患者术前1 d,术后1周、1个月、3个月视力水平,所有患者均由专业人员测定,每个患者测量3次,取平均值。
2.角膜内皮细胞丢失率:术前1 d,术后1周、1个月、3个月,通过非接触式角膜内皮镜测量患者角膜内皮细胞计数水平,患眼适量使用人工泪液以防止泪膜分布不均,影响结果,自然瞳孔下,定位、对焦,选择角膜内皮细胞形态以及分布状况良好的区域,重复测量3次,取平均值,计算角膜内皮细胞丢失率。角膜内皮细胞丢失率=(术前角膜内皮细胞计数-术后角膜内皮细胞计数)/术前角膜内皮细胞计数。
3.角膜地形图:术前1 d,术后1周、1个月、3个月,通过日本TMS-4N角膜地形图测量系统检测,每次采集4次图像,选最好的一次记录角膜散光度、表面不对称指数(surface asymmetry index,SAI)、表面规则指数(surface regularity index,SRI)。
六、统计学方法
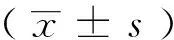
结 果
一、两组视力恢复情况比较
3组患者术后裸眼视力均高于术前(P<0.05);3组患者术后裸眼视力比较(P>0.05)。见表1。

表1 3组视力恢复情况比较
二、两组角膜内皮细胞丢失率比较
A组、B组术后1周、1个月、3个月角膜内皮细胞丢失率低于C组(P<0.05)。见表2。

表2 3组角膜内皮细胞丢失率比较
三、两组散光性质比较
A组术后1周、1个月、3个月顺逆性散光与术前比较(P>0.05);B组术后1周、1个月、3个月顺规比例较术前升高,C组逆规比例较术前升高(P<0.05)。见表3。
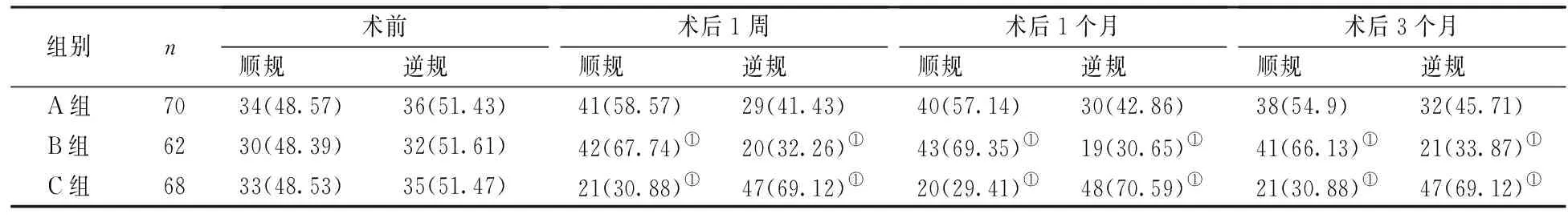
表3 3组散光性质比较
四、两组角膜散光度比较
3组术后角膜散光度均较术前升高(P<0.05);A组术后1周、1个月、3个月角膜散光度均低于B组,B组低于C组(P<0.05)。见表4。

表4 3组角膜散光度比较
五、两组角膜地形图比较
分析术前与术后的角膜地形图变化,患者术后切口部位角膜周边均变平坦、凹陷,平坦区域呈尖端指向角膜中央楔形,中央区的角膜曲率轻度改变,且小于周围角膜,术后可见表面不规则改变随时间推移以及切口的修复,角膜曲率大致同术前水平。3组术后1周,SAI、SRI均较术前增高,术后1个月,A组SAI、SRI降低至术前水平,术后3个月,B组、C组患者SAI、SRI降至术前水平,A组术后1周、1个月SAI、SRI水平低于B组,B组低于C组(P<0.05);两组术后3个月 SAI、SRI水平比较(P>0.05)。A组患者角膜地形图改变小于B组,B组小于C组,A组对角膜表面形态的影响较小,角膜变形恢复较早。

表5 3组不同时期SAI、SRI水平比较
讨 论
现代超声乳化白内障手术多使用透明角膜切口,其可选择不同切口位置,尤其是对于眼窝较深的患者可选择易接触的颞侧切口[5,6]。颞侧透明角膜切口不受眉弓以及左、右眼的影响,可有效减少贝尔现象,与此同时颞侧切口角膜隧道和虹膜面相互平行,利于手术操作[7]。
Kim等[8]研究结果表明不同切口超声乳化术无论是巩膜隧道切口或透明角膜切口,患者术后视力均得到不同程度的提高,获得良好视觉质量,本研究中术后患者视力水平均优于术前,与其研究结果一致,且不同时间点比较均无明显差异。角膜是眼球屈光的重要组成部分,其结构和形态的完整性是术后维持角膜透明的关键[9]。角膜内皮细胞层作为维持角膜正常生理功能的重要组织结构,损失后只能通过周围细胞移行以及扩大覆盖后弹力层来进行代偿,损失过多可导致角膜水肿、大泡性角膜病的发生,严重时可导致视力的丧失[10,11]。白内障手术中使用的超声乳化针头振动所产生的热量以及晶状体核碎片不可避免引起不同程度角膜内皮损害。本研究中A组术后1周、1个月、3个月角膜内皮细胞丢失率低于B组,B组低于C组,这一方面是是由于右上方透明角膜切口距离角膜手术中心较近,对前房扰动较大有关,另一方面角膜上方切口容易产生逆规性散光, 而颞侧切口则会导致顺规性散光[12]。
角膜地形图可较为精确、全面、客观显示角膜形态、屈光分布等,是有效了解角膜屈光状态的有效定量分析手段。本研究中A组患者角膜地形图改变小于B组,B组小于C组,强轴切口对角膜表面形态的影响最小,角膜变形恢复较早,其次为颞侧切口,Ranjini等[13]研究结果支持本结论。分析其原因,一方面强轴切口在术后愈合过程中对角膜原有结构影响较小,能较好的保持角膜原有形态结构。上方透明角膜切口受到眼睑压迫,这种压力不利于患者角膜表面形态恢复,此外上方透明角膜切口受眉弓与眼窝深浅的影响,切口进路陡峭进入前房,切口受到较大张力,造成角膜变形,引起角膜表面形态变化[14]。
综上所述,强轴切口、颞侧透明角膜切口、右上方透明角膜切口白内障超声乳化手术,患者术后视力均可得到有效恢复,强轴切口患者角膜内皮细胞丢失率低,对角膜散光度的影响较小,角膜表面形态恢复较快。
