穿龙薯蓣种子离体再生体系构建及其组培苗解剖结构特征
2021-05-25党裳霓高润梅石晓东张雨晴李红月
党裳霓,高润梅,石晓东,张雨晴,李红月
(山西农业大学 林学院,山西太谷 030801)
穿龙薯蓣(Dioscoreanipponica)属薯蓣科(Dioscoreaceae)薯蓣属(Dioscorea)多年生草质藤本,广泛分布于中国东北、华北、西北(除新疆)及河南、山东、安徽、浙江、江西 (庐山)、陕西 (秦岭以北)、四川等地[1]。穿龙薯蓣的根状茎俗称穿山龙,主要活性成分是皂苷类化合物,是提取药用成分薯蓣皂甙的重要原料[2-3]。近年来随着对药源材料的需求持续增加,连年的过度采挖,导致该种的野生资源急剧减少。穿龙薯蓣产地不同,根状茎的薯蓣皂苷元含量差异较大,品质参差不齐[4-5],因此传统的繁殖方式存在许多不足。组织培养技术可满足大规模育苗的需要以及加快优良品种的推广[6]。穿龙薯蓣木质化程度较高,愈伤组织产生较困难,以营养器官(幼根、茎段、叶片)为外植体产生愈伤时褐化严重,出愈率不高,有些器官根本不产生愈伤组织[7]。根状茎常年生于地下,表面积累大量外源菌,消毒困难,接种后期还多会出现内源菌污染,造成离体培养失败;而以茎段与叶片为外植体诱导愈伤组织会存在不同程度褐化,严重影响了愈伤组织的生长。因此,本研究以穿龙薯蓣的种子为试材,分析消毒时间、培养基激素配比对愈伤组织、腋芽诱导和生根培养等的影响,以期初步建立稳定和高效的穿龙薯蓣离体再生体系。同时,本研究进行了实生苗和组培苗解剖结构的比较,以期探讨穿龙薯蓣在不同培养环境下的形态可塑性,衡量该种对环境的适应能力[8-9],旨在为后期的炼苗移栽及工厂化育苗提供科学理论依据。
1 材料和方法
1.1 植物材料
穿龙薯蓣种子采集于关帝山庞泉沟自然保护区。2018年秋季采集穿龙薯蓣成熟种子,风干后冰箱4 ℃冷藏。2019年6月选取饱满均匀的种子,蒸馏水浸泡3 d后转入200 mg/L的赤霉素溶液中浸泡 24 h,然后用镊子去掉边缘的种翅,置于含饱和洗衣粉溶液的烧杯中,流水持续冲洗30 min,再用蒸馏水冲洗3遍。将供试种子材料,放入超净工作台进行消毒[10]。
1.2 外植体消毒
将作为外植体的种子经75%酒精表面消毒1 min后,以2% NaClO进行消毒处理,分别设置12、15、18和21 min的处理时间,期间不断振荡;消毒结束后,用无菌水冲洗3次后平铺在不添加激素的MS培养基表面,25 ℃暗培养。比较不同时间处理的消毒效果,接种15 d后,统计种子的死亡率、污染率和萌芽率。其中外植体无污染、未褐变视之为成活。
1.3 外植体离体培养
试验所用的培养基中均添加蔗糖30 g·L-1,琼脂7 g·L-1,pH调至6.0,121 ℃高压灭菌30 min。所有培养物均于(25±1)℃的恒温培养箱中培养,光照强度1 500 Lx,光、暗时间各12 h。
1.3.1 愈伤组织诱导愈伤组织选用激素6-BA+NAA(2,4-D)组合来诱导,采用单因素区组试验,6-BA浓度为1.0 mg·L-1,NAA、2,4-D各设置0.2、0.5、1.0 和2.0 mg·L-1等4个水平,共组成8个处理组合。每种处理培养基接种10瓶,每瓶接种3个外植体,接种30 d后统计愈伤组织诱导率,出愈率(%)=出愈外植体数/接种外植体数×100%。
1.3.2 不定芽诱导不定芽的诱导采用激素6-BA与NAA组合来进行,各设置3个水平,6-BA分别为1.0、2.0 和3.0 mg·L-1,NAA分别为0.2、1.0 和2.0 mg·L-1,采用双因素完全区组试验,共组成9个配比处理组合。每种处理培养基接种30瓶,进行差异显著性分析。
1.3.3 生根培养苗高3 cm以上时,进行生根诱导以获得完整再生植株,结合前人研究结果,探究生长素NAA对生根诱导的影响[6-7,11-12]。以1/2MS为基本培养基添加不同浓度的激素,进行生根培养。其中,NAA选取0.1、0.2、0.5和1.0 mg·L-1等4个浓度水平,6-BA浓度为0.5 mg·L-1,IBA浓度为0.5 mg·L-1,设置单一NAA处理(0.1、0.5 mg·L-1)及其与6-BA、IBA组合处理(0.5 mg·L-1NAA+ 0.5 mg·L-16-BA;1.0 mg·L-1NAA+0.5 mg·L-16-BA;0.2 mg·L-1NAA + 0.5 mg·L-1IBA)。每种处理培养基接种15瓶,每瓶接种2株,60 d后观察不同处理的幼苗生长状况及生根率、根数等情况。生根率(%)=生根苗数/接种苗数×100%。
1.4 实生苗和组培苗解剖结构观察
供试材料为1/2MS+0.5 mg·L-1NAA生根培养基培养60 d的组培苗,选取顶端以下的第3片叶、茎和根状茎作为试验材料,同时以室外培养60 d的实生苗为对照,比较二者在结构上的差异。其中,叶片剪取中部含主脉0.5 cm×0.5 cm的方块,放入50% FAA固定液中固定24 h;分别剪取缠绕茎与根状茎长0.5 cm的小段,放入70% FAA固定液中固定24 h。固定材料采用常规石蜡切片,切片厚度12 μm,番红-固绿对染,中性树胶封片[13]。在NikonEclipse50i光学显微镜下观察叶片、茎和根状茎切片解剖结构并拍照,采用Image-ProPlu5.0测量统计。
1.5 数据分析
试验数据整理和图表绘制采用Excel软件完成。采用SPSS软件对试验数据进行统计分析,并用最小显著性差异法(Duncan)对其处理后的数据进行显著性差异多重比较,显著水平为0.05。
2 结果与分析
2.1 消毒时间对外植体萌发的影响
由表1可知,2% NaClO消毒时间对外植体种子萌发指标(死亡率、污染率和萌芽率)有显著影响(P<0.05)。其中,随着消毒时间的增加,外植体的污染率逐渐降低,消毒15~21 min 处理均显著低于消毒12 min处理,而其余处理间无显著差异;外植体的萌芽率随消毒时间延长而先升后降,并在消毒15 min和18 min分别为63.33%和70.00%,显著高于其余处理。同时,随消毒时间延长,外植体死亡现象逐渐加重,成活率显著下降,死亡率在消毒21 min时达43.33%,显著高于其余处理,而其余处理间则无显著差异。可见,采用2% NaClO作为种子消毒剂的消毒时间以15~18 min为宜,萌芽率高,污染率和死亡率低。
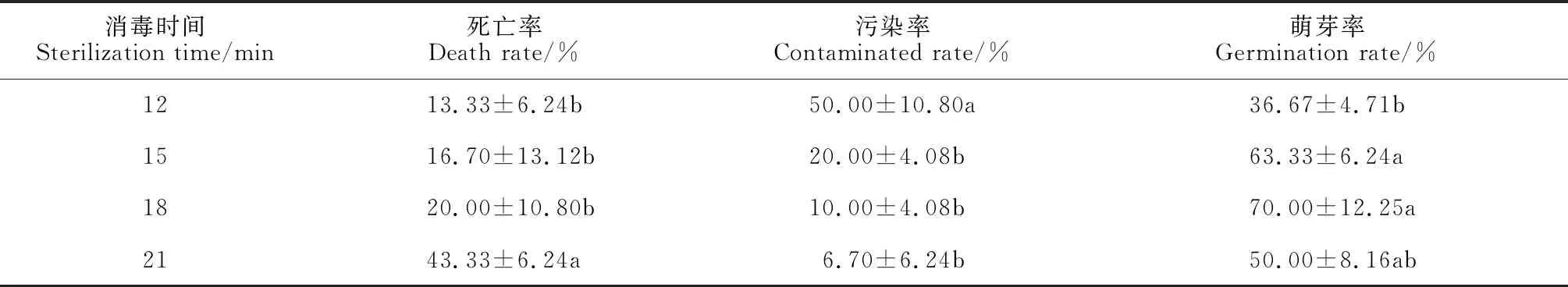
表1 不同消毒时间对外植体的处理结果Table 1 Treatment results of external implants at different disinfection times
2.2 激素NAA、2,4-D浓度对愈伤组织诱导的影响
待种子发芽后,接着转至含不同激素种类和浓度的培养基中。一周左右胚轴的基部膨大,逐渐有愈伤组织形成,前期出现大量带芽的愈伤组织。30 d后出愈率调查结果(表2)显示。2,4-D对愈伤组织的诱导作用明显优于NAA。在1.0 mg·L-16-BA基础上,同浓度2,4-D的愈伤组织诱导率显著高于NAA,并且愈伤组织的生长质量差别明显,具体表现为添加NAA的愈伤组织生长缓慢,致密较硬(图版Ⅰ,A);添加2,4-D的愈伤组织生长较快,松散柔软(图版Ⅰ,B、C)。另外,随2,4-D浓度升高,外植体出愈数和出愈率均逐渐增加。其中,在1.0 mg·L-16-BA基础上,当2,4-D浓度为2.0 mg·L-1时,外植体出愈率最高达到83.33%。可见,2,4-D处理的愈伤组织诱导率和生长质量均优于NAA,且适当提高2,4-D浓度有助于愈伤组织的形成。

表2 不同浓度NAA、2,4-D诱导下外植体种子出愈率Table 2 The seed healing rate of explanst under different concentrations of NAA and 2,4-D
2.3 激素6-BA/NAA配比对不定芽诱导率的影响
选取诱导获得的优质愈伤组织转接到各种诱导不定芽的培养基中,经过1周培养,淡绿色愈伤组织形成很多突起,近而形成多芽体,增殖培养过程中,不定芽基部有毛状根产生(图版Ⅰ,D、E)。9种浓度6-BA/NAA组合处理对腋芽诱导效果(表3)存在差异,愈伤组织不定芽诱导率存在显著差异(P<0.05)。其中,培养基中添加2.0 mg·L-16-BA+0.2 mg·L-1NAA时,不定芽诱导率最高(90.00%±8.20%),芽苗长势好,叶色浓绿(图版Ⅰ,F);激素组合3.0 mg·L-16-BA+0.2 mg·L-1NAA处理效果次之,诱导率为83.33%±4.71%,芽苗生长较快,叶黄绿,茎粗壮且长,出现毛状根(图版Ⅰ,G);激素组合2.0 mg·L-16-BA+1.0 mg·L-1NAA和3.0 mg·L-16-BA+1.0 mg·L-1NAA处理下,不定芽诱导率处于63.33%~73.33%之间;在2.0 mg·L-16-BA+2.0 mg·L-1NAA和1.0 mg·L-16-BA+2.0 mg·L-1NAA处理下,不定芽的诱导率稍高于50%;其余3种激素组合处理的不定芽诱导率均低于50%。

表3 不同6-BA/NAA配比培养基中不定芽诱导与生长的情况Table 3 The adventitious bud induction and growth states in the medium with different 6-BA/NAA ratios
2.4 激素浓度及配比对组培苗生根的影响
将经继代培养后高达3 cm的小植株,接种于添加不同激素的1/2MS生根培养基上。10 d左右开始出现白色根原基,20 d左右组培苗茎段底部逐渐出现白色根,1个月后小苗生根趋于稳定。统计结果(表4)表明,各激素组合处理组培苗的生根数和生根率差异显著(P<0.05)。

表4 不同激素及其组合培养基中组培苗生根情况Table 4 The rooting culture status of seedling in medium with different hormones and their combinations
其中,1/2MS生根培养基中单一添加0.5 mg·L-1NAA时,组培苗平均生根数为13.2条,生根率为86.70%,显著高于不添加激素的对照,也明显高于其余添加激素处理;培养基在添加0.5 mg·L-1NAA基础上,再添加0.5 mg·L-16-BA时,组培苗的平均根数为10.7条,生根率为73.33%,与添加0.1 mg·L-1NAA处理的接近,但前者组培苗生长良好,后者组培苗茎较细弱,叶小黄绿(图版Ⅰ,K);培养基添加0.5 mg·L-16-BA,同时加入1.0 mg·L-1NAA时,组培苗生根数大幅下降,与对照处于相同水平,其生根率也明显下降,但仍显著高于对照;培养基添加0.2 mg·L-1NAA+0.5 mg·L-1IBA时,组培苗生根数更少,仅有对照的45.95%,生根率大幅下降,稍低于对照(图版Ⅰ,I)。可见,组培苗适宜生根培养基为1/2MS+0.5 mg·L-1NAA和1/2MS+0.5 mg·L-1NAA+0.5 mg·L-16-BA(图版Ⅰ,H、J)。

图版Ⅰ 穿龙薯蓣组织培养中愈伤组织、不定芽、生根及组培苗和实生苗A.添加NAA形成的愈伤组织;B、C.添加2,4-D形成的愈伤组织;D.愈伤组织诱导出芽;E.毛状根;F.2.0 mg·L-1 6-BA+0.2 mg·L-1 NAA不定芽诱导培养基;G.3.0 mg·L-16-BA+0.2 mg·L-1 NAA不定芽诱导培养基;H.1/2MS+0.5 mg·L-1 NAA组培苗根部;I.1/2MS+0.2 mg·L-1 NAA+0.5 mg·L-1IBA组培苗根部;J.1/2MS+0.5 mg·L-1 NAA生根培养基;K.1/2MS+0.1 mg·L-1 NAA生根培养基;L.实生苗Plate Ⅰ Callus,adventitious bud,rooting,tissue culture seedling and seedling of Dioscorea nipponicaFig.A.Callus formed by adding NAA;Fig.B,C.Callus formed by adding 2,4-D;Fig.D.Callus induced budding;Fig.E.Hairy root;Fig.F.2.0 mg·L-1 6-BA+0.2 mg·L-1 NAA adventitious bud induction medium;Fig.G.3.0 mg·L-1 6-BA+0.2 mg·L-1 NAA adventitious bud induction medium;Fig.H.1/2MS+0.5 mg·L-1 NAA the roots of tissue culture seedlings;Fig.I.1/2MS+0.2 mg·L-1 NAA+0.5 mg·L-1 IBA the roots of tissue culture seedlings;Fig.J.1/2MS+0.5 mg·L-1 NAA rooting medium;Fig.K.1/2MS+0.1 mg·L-1 NAA rooting medium;Fig.L.Seedling
2.5 组培苗和实生苗营养器官解剖结构比较
穿龙薯蓣组培苗的叶片、缠绕茎和根状茎在解剖结构上与实生苗存在差异(表5)。首先,叶片厚度、上表皮厚度、主脉维管束面积都表现为实生苗显著高于组培苗;栅栏组织厚度二者之间差异不明显,但组培苗的海绵组织厚度极显著高于实生苗,导致二者的栅栏组织厚度/海绵组织厚度(P/S)差异显著;组培苗叶片主脉维管束面积较小(1 779.81 μm2),约为实生苗的1/2(图版Ⅱ,A、B;表5)。
其次,组培苗和实生苗在解剖结构的差异以缠绕茎尤为显著。组培苗缠绕茎的内径、导管面积和维管束数量均小于实生苗,但其维管束面积较大,但导管面积/维管束面积较小(0.06),为实生苗的1/2(表5)。实生苗缠绕茎皮层比例小,根据细胞形态可明显区分为厚角组织、厚壁组织与薄壁组织,棱角处厚角组织发达(2~3层),环状厚壁组织由2~3层细胞组成(图版Ⅱ,C);组培苗皮层比例大,且无厚角组织,厚壁组织分化不甚完全,未形成明显环带,多数为排列疏松的薄壁细胞,细胞内富含淀粉粒(图版Ⅱ,D)。实生苗缠绕茎维管束2轮,均为有限维管束,其中靠近皮层一侧的维管束较小,为外韧维管束,排列疏松;靠近髓部的维管束较大,为双韧维管束,排列紧密,与外侧的外韧维管束相互间隔排列(图版Ⅱ,E);组培苗缠绕茎仅有双韧维管束,排列极为分散(图版Ⅱ,F)。

表5 组培苗和实生苗营养器官结构比较Table 5 Comparison of vegetative organ structure between tissue culture seedlings and seedlings
另外,根状茎由周皮、基本组织和散生其中的外韧维管束组成(图版Ⅱ,G、H)。组培苗和实生苗根状茎解剖结构差别不大,维管束数和维管束面积在实生苗与组培苗之间差异均不显著(表5)。

图版Ⅱ 组培和实生苗营养器官解剖结构比较Xy.木质部;Ph.韧皮部;Vb.维管束;Co.厚角组织;Sc.厚壁组织;Pa.薄壁组织;Pc.薄壁细胞A.实生苗叶中脉;B.组培苗叶中脉;C.实生苗缠绕茎表皮;D.组培苗缠绕茎表皮;E.实生苗缠绕茎;F.组培苗缠茎;G.实生苗根状茎横切;H.组培苗根状茎横切Plate Ⅱ Anatomical structure comparison of vegetative organ between tissue culture and live seedlingsXy.Xylem;Ph.Phloem;Vb.Vascular bundle;Co.Collenchyma;Sc.Sclerenchyma;Pa.Parenchyma;Pc.Parenchymal cellFig.A.Midvein of seedling leaf;Fig.B.Midvein of tissue culture seedling leaf;Fig.C.Entangled stem epidermis of seedlings;Fig.D.Entangled stem epidermis of tissue culture seedlings;Fig.E.Seedlings entangled stem;Fig.F.Tissue culture seedlings entangled stem;Fig.G.Seedling rhizome transverse;Fig.H.Rhizome of tissue culture seedlings are transverse
3 讨 论
3.1 穿龙薯蓣再生体系建立
愈伤组织诱导是建立植物再生体系或进行遗传转化等的重要途径,在快速繁殖、育种、转基因、脱毒苗生产等方面均有极大的应用价值[14]。彭金环等[15]对穿龙薯蓣愈伤组织诱导研究中,以不同外植体为材料诱导愈伤组织,发现各种营养器官均能诱导出愈伤组织,但外植体存在不同程度的褐化,严重影响了愈伤组织的生长。利用种子诱导出的愈伤组织,生长速度快,出愈率比较高,而且因为没有机械损伤,很大程度上抑制了褐化的发生。但在愈伤组织诱导过程中,种子须先平铺于MS培养基中,待种子长出芽和胚轴再将其接种到诱导愈伤培养基中。如若直接接种至愈伤组织培养基中,出愈率很低,2,4-D会干扰生长素的分布模式,使整个胚胎中的生长素信号变强,对植物胚轴形成有抑制作用[16]。培养基中添加的激素类型及浓度对体外繁殖有重要影响。植物激素是影响薯蓣愈伤组织诱导和分化再生植株的重要因素,不同的外植体诱导率和生长差异很大,植物激素的种类和配比浓度也要随之变化。张数鑫[17]在试验中发现穿龙薯蓣不同外植体的诱导率和生长差异很大,并以茎尖诱导率最高,茎段次之。
陈凤清[18]采用无菌带芽茎段为外植体,通过多芽体诱导、微块茎形成、根诱导和增殖成功建立了再生体系。同时提出,激素的协同作用影响芽、根的形成,不同浓度激素适当组合对组织培养更有利。在植物生长调节剂中,生长素和细胞分裂素是影响离体试管苗生芽和生根的主要决定因素。植物细胞培养中的器官发生(类型和范围)取决于生长素与细胞分裂素的比例[19]。细胞分裂素,如KT和6-BA,已被证明能促进细胞分裂、芽增殖、芽形态发生和抑制根部形成;而生长素,如NAA和2,4-D通常用于刺激愈伤组织产生和细胞生长,启动萌芽和生根,诱导体细胞胚胎发生,并刺激茎尖和茎段的生长[20-23]。本研究以种子为外植体诱导愈伤组织最适培养基为MS+1.0 mg·L-16-BA+2.0 mg·L-12,4-D,形成愈伤组织长势好,分化能力强,在6-BA浓度相同的情况下,2,4-D诱导作用优于NAA,这与彭金环研究结果一致;愈伤组织分化的适宜培养基为MS+2.0 mg·L-16-BA+0.2 mg·L-1NAA,芽苗长势好,叶色浓绿并且在诱导愈伤组织分化芽过程中产生了毛状根,后期生根培养中产生的根更加健壮。有研究发现,毛状根生长快,次生代谢产物含量高,遗传稳定,是工业化生产所向往的,可以实现药用植物次生代谢物的工厂化生产[17,24-25]。
3.2 穿龙薯蓣组培苗和实生苗营养器官解剖结构的差异
组培苗生长的培养瓶中环境条件与室外差别很大,小苗幼嫩,一直处于可控的环境下生长,抗性较低。因此,必须经过炼苗来提高组培苗对外界环境的适应性,达到提高移栽成活率的目的,而炼苗成功与否关系到整个组培过程能否成功完成[26]。本研究通过比较穿龙薯蓣组培苗和实生苗叶片、缠绕茎和根状茎的解剖结构发现,组培苗叶片形态、结构变异较大,叶片更薄,栅栏组织和海绵组织分化不完全,P/S值低,其原因可能是组培苗的培养光照较弱,但营养和水分充足,幼苗适应这样的生长条件作出相应的形态与结构调整[27]。而P/S值常被用作衡量植物抗寒[28]、抗旱[29-30]能力和光合速率高低[31]的重要指标,弱光下的组培苗叶片较薄,P/S值随之降低。因此在炼苗移栽初期要注意环境的通透性、保水性以及透光性。组培苗的缠绕茎解剖结构也与实生苗存在显著差异。很多植物通过增加茎的表皮厚度来降低蒸腾作用,减少水分蒸发,从而抵抗干旱[32-33]。本研究中穿龙薯蓣实生苗缠绕茎的表皮厚于组培苗,皮层分化出厚角组织与厚壁组织,维管束数量多,排列较紧密,而组培苗皮层分化简单,维管束数量少,排列分散,可能由于组培苗处于高湿的可控环境,水分营养充足,机械组织与输导组织的结构随之简化。
移栽驯化过程是组培苗组织结构分化发育日趋完善、逐渐适应外界环境的过程。也是组培苗由半自养半异养向完全自养转变的过程[34]。穿龙薯蓣组培苗和实生苗解剖结构表观特征的变化是其适应不同生态环境的具体表现,因此,试管苗在向大田移栽过程中,要想获得较高的成活率,使其能够适应外在自然环境,解剖结构特征发生相应的环境适应性非常重要,在移栽驯化初期应重点保障移栽小环境的湿度与光照,以提高其成活率。
4 结 论
本试验进行了穿龙薯蓣种子组培体系优化研究,并在此基础上开展组培苗和实生苗营养器官解剖结构的对比研究,旨在为后期研究穿龙薯蓣有效药用成分,以及实现穿龙薯蓣生产的产业化,促进穿龙薯蓣种植产业的健康发展提供技术支撑。结果表明:(1)2% NaClO作为种子诱导外植体消毒剂,消毒时间以15和18 min为佳。(2)MS+1.0 mg·L-16-BA+2.0 mg·L-12,4-D为愈伤组织诱导的最适培养基。(3)MS+2.0 mg·L-16-BA+0.2 mg·L-1NAA为愈伤组织分化芽的最适培养基。(4)1/2MS+0.5 mg·L-1NAA为最适生根培养基。(5)组培苗和实生苗解剖结构比较发现,组培苗炼苗移栽初期要注意环境的通透性、保水性以及透光性,使组培苗能够适应外在自然环境,从而提高其成活率。
