基于蛋白质组学方法对急性期中风的物质基础及相关机制的研究
2021-05-25刘涛唐涛
刘 涛 唐 涛
1.新疆维吾尔自治区中医医院博士后科研工作站,新疆乌鲁木齐 830000;2.中南大学湘雅医院中西医结合科,湖南长沙 830054
中风已成为导致人类死亡的第三大致死性疾病[1]。传统中医对“中风”的认识可追溯到《黄帝内经》,明确定义“中风”见于《金匮要略》,初步分类见于《医学衷中参西录》。随着CT等技术的引入,现代中医临床已将中风分为缺血性中风(IS)与出血性中风(ICH)。然而,中医药在急性期中风时采用相同的治法取得较好的疗效[2-3],而其共性物质基础研究未见报道。因此,运用基于相对和绝对定量同位素标记(iTRAQ)的定量蛋白质组学方法,研究IS和ICH模型大鼠整体蛋白质图谱,揭示急性期中风的共性物质基础及分子机制,为急性期中风治疗提供一定的理论依据。
1 材料与方法
1.1 实验动物
清洁级Sprague-Dawley(SD)雄性大鼠40只,6~7周龄,180~200 g,购于湖南斯莱克景达实验动物有限公司[许可证号:SCXK(湘)2013-0004]。所有动物寄养中南大学实验动物学部提供,采用“3只/笼”在标准实验室条件(50±10)%相对湿度,昼夜12 h循环,温度控制在22~25℃下进行分笼饲养,并自由进食、水。所有实验均得到中南大学动物伦理委员会的批准(201403164)。
1.2 主要试剂与仪器
Ⅶ型胶原酶(Sigma,批号C0773),8-plex iTRAQ试剂盒(AB Sciex,货号:4381664);立体定位仪(美国,Stoelting Co.,Chicago,IL);高效液相色谱(日本,岛津,LC-20AD);液相色谱(美国,Thermo Scientific,Ultimate 3000);质谱仪(美国,Thermo Scientific,Q Exactive)。
1.3 方法
1.3.1 分组 40只SD大鼠采用随机数字表法进行分组:IS假手术(Sham1)组、IS模型(IS)组、ICH假手术(Sham2)组和ICH模型(ICH)组,每组10只。IS组和Sham1组自由饮食后,24 h后生理盐水灌注后取脑;ICH组和Sham2组在48 h后,生理盐水灌注后取脑。每组4只大鼠进行蛋白质组学研究,剩余每组6只进行蛋白验证。
1.3.2 实验动物ICH及IS造模 ICH模型采用胶原酶来诱导的脑出血模型、IS大鼠模型采用线栓法制备缺血再灌注模型。整个造模过程参照前期研究标准[4-5]。
1.3.3 留取标本 大鼠称重后,按50 mg/kg腹腔注射3%戊巴比妥钠麻醉;麻醉后沿着剑突下行横向切口,钝性分离并暴露膈肌,剪开膈肌,勿损伤心脏,剪断左侧肋骨,暴露心脏。于心尖左缘向升主动脉方向进针,置入升主动脉,固定针头,钳夹腹主动脉。剪开右心耳,快速滴入生理盐水,直至右心耳流出清澈生理盐水后,开颅取脑。最后,将患侧一半脑组织迅速放入液氮速冻,随后转移至-80℃超低温冰箱保存备用。
1.3.4 脑组织样本处理 往脑组织中加入400 μL裂解液RIPA,反复吹打裂解细胞。裂解后予以超声处理(2%,1 s开,1 s关,超声5次后放于冰上冷却,上述过程重复8次),4℃,12 000 r/min,离心半径13.5 cm,离心20 min,收集上清液。进行BCA法蛋白质定量后,按照前期研究参数[5],收集管底部共得到100 μL酶解后的样品。
1.3.5 iTRAQ试剂标记的定量分析 取出8标iTRAQ试剂盒,平衡至室温,将iTRAQ试剂离心至离心管管底;向每管iTRAQ中加入150 μL异丙醇,振荡,离心至离心管管底;取50 μL样品(100 μg酶解产物)转移到新的离心管中;将iTRAQ试剂添加到样品中,振荡,4℃,12 000 r/min,离心半径13.5 cm,离心至离心管管底,室温反应2 h;加入100 μL超净水终止反应;混合标记后的样品,振荡,离心至离心管管底;真空冷冻离心干燥后,冷冻保存待用。
1.3.6 第一维高效液相分离 第一维高效液相分析采用75 μm ID×150 mm,2 μm,100 Å 色谱柱。A相:20 mmol/L HCOONH4,pH 10;B相:20 mmol/L HCOONH4,80%ACN,pH 10;紫外检测波长:214 nm/280 nm,流速:200 μL/min。从线性梯度开始收集组分,收集到24个EP管中,每分钟收集1管,轮流收集,梯度为90 min;根据峰型和时间共收取24个组分,用50%TFA酸化,真空干燥后,进行第二维反相液质联用分析。
1.3.7 第二维反相液质联用分析 酶解产物经nano-RSLC液相色谱分离后联用Q-Exactive质谱仪(Thermo Scientific)在线进行质谱分析。分析时长:65 min/样本,正离子检测模式,母离子扫描范围:unique pep tides m/z。一级质谱参数:分辨率:70 000,AGC靶:3E+6,最大离子注入时间(Max IT):40 ms,扫描范围:350~1800 m/z;二级质谱参数:分辨率:17 500,AGC靶:1E+5,Max IT:60 ms。标准化碰撞能量(NCE):28%,隔离窗口:2 m/z,动态排除时间:60 s。
1.3.8 蛋白质组数据分析 差异表达蛋白(DEPs)筛选标准:最优蛋白得分(Unused)≥1.3;差异倍数>1.3(上调)或<0.77(下调);伪发现率(FDR)<1%。采用基因功能(GO)和STRING10.5分析。
1.3.9 蛋白免疫印迹(Western blot)根据课题组前期实验方法[5]进行Western blot分析。具体如下:一抗孵育:神经丝蛋白轻链多肽(Nefl,1∶1000);酪氨酸羟化酶(Th,1∶3000);神经调制蛋白(Gap43,1∶1500);Atp6v1f(1∶1000);Atp6v1a(1∶2000);β-actin(1∶5000)。二抗[兔抗(R)1∶6000,鼠抗(M)1∶5000]。之后用ECL kit来检测抗原-抗体-过氧化物酶混合物的量,同时通过曝光到柯达胶卷可视化不同蛋白条带。最后,用Image Lab图像分析软件定量条带的灰度值,以确定Nefl、Th、Gap43、Atp6v1f和Atp6v1a的相对表达量。蛋白质的表达量以相对值与β-actin的比值表示。
1.4 统计学方法
采用SPSS 17.0进行数据处理,计量资料用均数±标准差()表示,方差齐时,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验;方差不齐时,多组间比较采用Kruskal-Wallis H检验,进一步两两比较采用Nemenyi法。以P <0.05为差异有统计学意义。
2 结果
2.1 急性期IS及ICH模型大鼠DEPs的变化
本研究共检测急性期IS疾病相关DEPs有345个,其中上调96个,下调249个;急性期ICH疾病相关DEPs有425个,其中上调248个,下调177个;急性期IS和ICH共性DEPs有57个,其中上调20个,下调37个。见表1。
2.2 DEPs的生物信息学分析
2.2.1 GO分析 在细胞组成分类中,外泌体、细胞浆、质膜和线粒体所占比例较高,而在富集分析中排序前三的是外泌体、髓鞘和神经突触(图1A、1B);在分子功能分类中,蛋白结合、相同蛋白结合、域蛋白的特异性结合和磷脂酰丝氨酸结合所占比例较高,而在富集分析中蛋白结合、磷脂酰丝氨酸结合和髓鞘结构成分排序前三(图1C、1D);在生物过程分类中,对药物反应、对缺氧反应和脂多糖应答所占比例较高,而在富集分析中神经丝束组装、丙烯酰胺的反应和中间纤维束的装配分别排序前三(图1E、1F)。
2.2.2 KEGG分析 本研究筛出17条信号通路,其中富集较多蛋白的有3条:代谢通路、肌萎缩侧索硬化症(ALS)通路和吞噬通路。根据ALS通路、集合管泌酸通路、丙酸代谢通路、酪氨酸代谢通路和丙酮酸代谢通路富集显著。见表2。综合分析后,ALS通路、丙酸代谢通路、酪氨酸代谢通路和丙酮酸代谢通路为急性期中风“异病同证”的主要信号通路。
2.2.3 DEPs验证 IS组和Sham1组的Nefl、Gap43、Atp6v1f、Th和Atp6v1a表达量比较,差异有统计学意义(P <0.05)。ICH组和Sham2组的Nefl、Gap43、Atp6v1f、Th和Atp6v1a表达量比较,差异有统计学意义(P <0.05)。其中,Nefl表达为上调,Gap43、Atp6v1f、Th和Atp6v1a表达为下调,此结果与蛋白质组学检测结果一致。见图2。
3 讨论
3.1 急性期中风的主要物质基础
Nefl属于神经丝蛋白的主要亚型之一,是神经元主要的细胞骨架结构蛋白,大量分布于轴突中[6-7]。Nefl亦是判断急性轴突损伤的重要指标[6]。在复发性多发性硬化症的临床研究中,Nefl作为药物抗炎治疗有效评价指标[8]。在本研究中,IS及ICH模型大鼠的Nefl表达水平较高,说明急性期中风存在急性的轴突损伤,可能与存在急性炎症有关。同时,Nefl水平亦可作为急性期中风的神经损伤判定指标之一。
Gap43又称为神经生长相关蛋白43或B-50,首次被发现来源于大鼠脑组织的突触体质膜的分离[9]。Gap43参与神经元的形成和再生的调控,Gap43的表达与突触结构可塑性之间关系密切[10]。Gap43磷酸化影响行为记忆,主要因为长时程蛋白诱导与增加Gap43的磷酸化密切相关[11]。在实验结果中,IS组及ICH组的Gap43表达水平较低,提示急性期中风神经元及轴突损伤明显,但再生及重塑水平低下。因此,在急性期中风的治疗中Gap43可作为重要的潜在靶点。
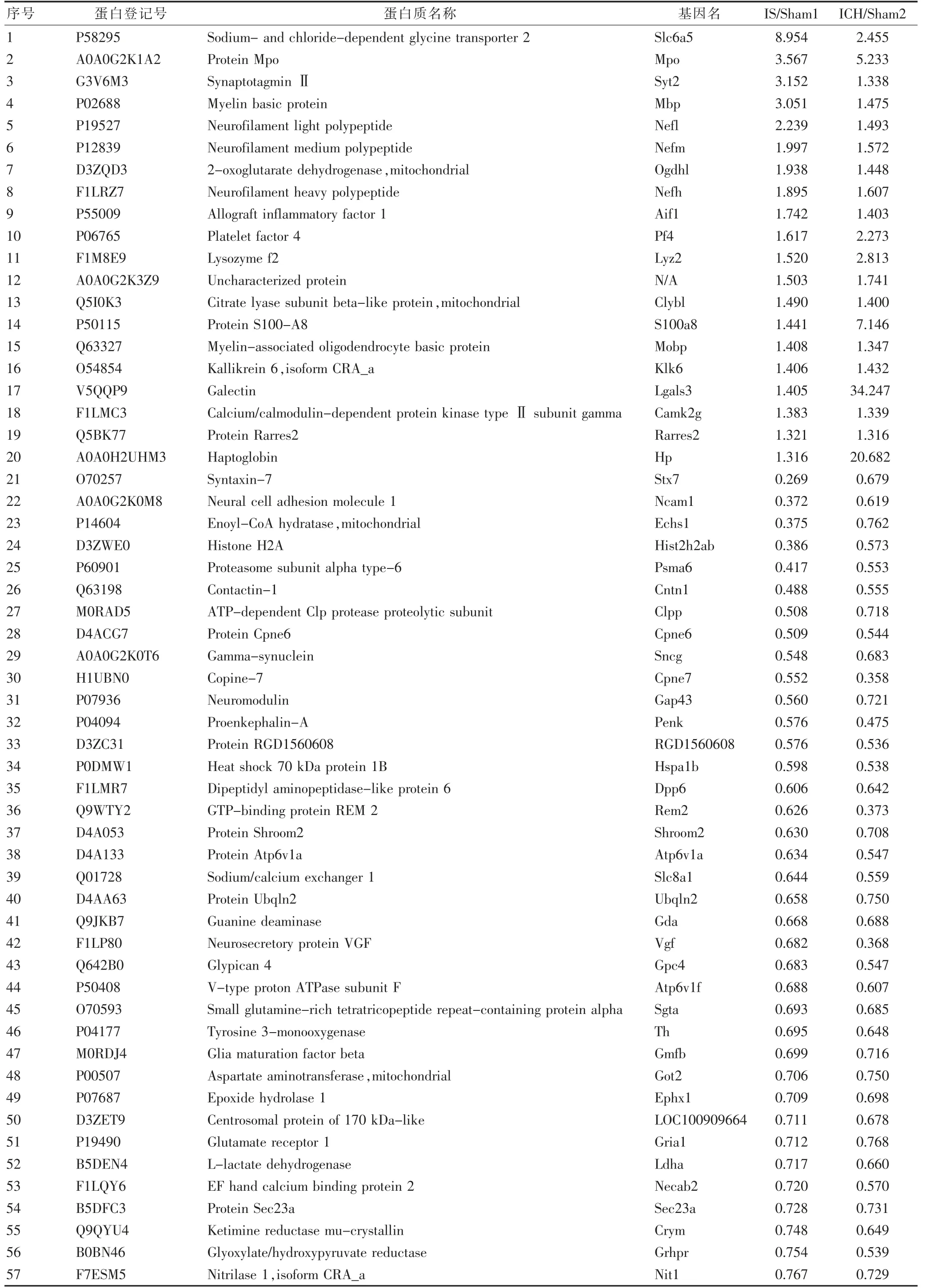
表1 急性期中风共性DEPs表达情况

图1 57个共性DEPs的Quick GO分析
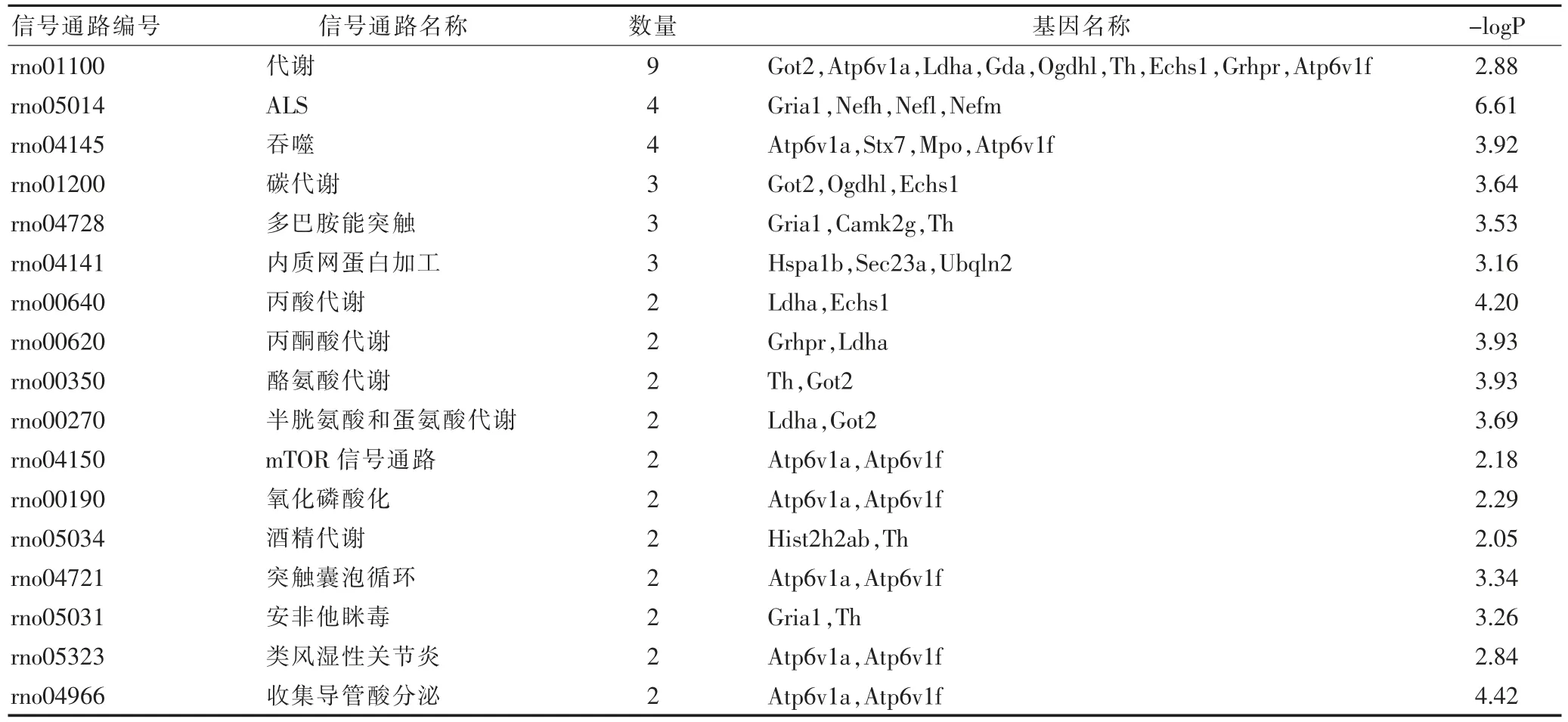
表2 57个共性DEPs所富集的所有信号通路
Th是一种蝶啶依赖性的单加氧酶。Th能在神经元细胞中表达,参与儿茶酚胺代谢[12]。研究表明,Th在脑组织蓝斑中的表达被确定为与抗应激的作用机制相关[13]。在蛛网膜下腔出血时,Th在黑质和纹状体中的表达均降低,提示多巴胺的产生减少[14]。本研究中,IS组及ICH组的Th表达水平较低,可以推测急性期中风时脑组织中多巴胺产生减少,最终通过多巴胺能突触产生对大鼠神经功能的影响。因此,多巴胺样效应低下的行为学可以作为急性期中风神经功能损伤判断的一种参考。
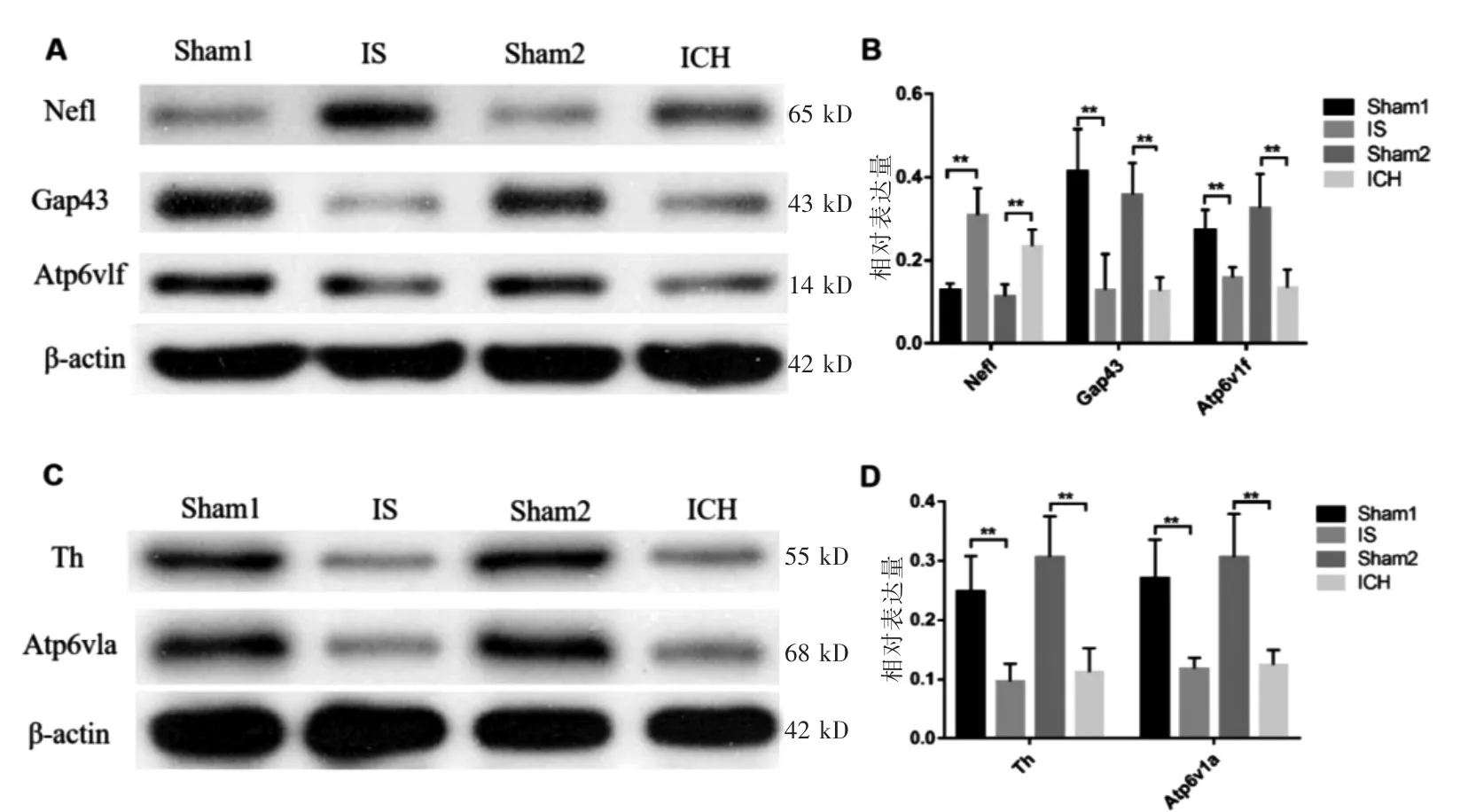
图2 DEPs的Western blot验证情况(n=6)
V-ATP酶是膜相关的多亚基蛋白复合物,功能是ATP驱动的质子泵,包括Atp6v1a和Atp6v1f亚型[15]。V-ATP酶利用ATP水解生成ADP的能量将质子泵过膜和调节囊泡室、细胞质和细胞外间隙的pH值[16]。Atp6v1a是V-ATP的催化亚基,它能使溶酶体酸化,并与雷帕霉素蛋白的机制靶标发生相互作用,在调节自噬中起着重要的作用[17]。Atp6v1f是V-ATP酶的一种类型,作用亦是介导酸化[18]。本研究中Atp6v1a和Atp6v1f在IS组及ICH组均显示下调,提示急性期中风涉及V-ATP酶功能是受损的情况。
3.2 急性期中风的主要信号通路
ALS通路是由54个基因构成。在ALS通路图上,共有35个蛋白质实体,包括膜受体、胞浆蛋白或分泌蛋白、激酶、磷酸酶、蛋白酶和蛋白通道,它们在ALS发病的不同阶段有不同程度的直接/间接作用,导致运动神经元的失活[19]。在本研究中谷氨酸受体1(Gria1)、Nefl、神经丝蛋白中链多肽(Nefm)和神经丝蛋白重链多肽(Nefh)等4个蛋白质富集在ALS通路中。Gria1也称作5α-氨基-3-羟基-5-甲基-4-异恶唑丙酸受体(AMPAR1),主要在小背根神经节中神经元表达,在初级感觉传入系统中起重要作用[20]。神经丝由Nefl、Nefm和Nefm三种不同大小的链组成,是轴突细胞骨架蛋白的主要组成部分[21]。因此,急性期中风的主要机制可能是通过调节ALS通路中Gria1、Nefl、Nefm和Nefh而产生。
丙酮酸代谢和丙酸代谢属于碳水化合物代谢,酪氨酸代谢为氨基酸代谢,因此均归能量代谢范畴。本研究中乙醛酸/羟基丙酮酸还原酶(Grhpr)和L-乳酸脱氢酶(Ldha)富集在丙酮酸代谢,L-乳酸脱氢酶(Ldha)和烯酰辅酶A水合酶(Echs1)富集在丙酸代谢,Th和天门冬氨酸氨基转移酶(Got2)富集在酪氨酸代谢。Grhpr是生物体内能量和物质代谢过程中的一种酶,能在NAD(P)+的条件下催化D-甘油酸为羟基丙酮酸。Ldha位于细胞的线粒体,在糖异生中发挥重要作用[22]。Echs1参与线粒体中缬氨酸到丙酰基辅酶A的降解过程[23]。Th在神经元细胞中表达,催化L-酪氨酸转变为L-DOPA,参与儿茶酚胺代谢[12,24]。Got2参与柠檬酸循环代谢过程,在脑能量代谢中发挥一定的作用[25]。因此,Grhpr、Ldha、Echs1、Th和Got2在能量代谢中起重要作用,构成了急性期中风的能量代谢通路。
