miR-4465靶向KPNA2调控宫颈癌细胞增殖、迁移及侵袭的机制研究
2021-05-25于利,张明,王迪
于 利,张 明,王 迪
(盘锦市中心医院 妇产科,辽宁 盘锦124000)
宫颈癌属于妇科常见恶性肿瘤,随着现代生活节奏的加快,我国宫颈癌发病率逐年上升,临床采用手术、放疗等治疗宫颈癌,但治疗效果不佳,患者5年生存率较低[1-2]。目前宫颈癌发生及转移的分子机制尚未阐明,因而探究宫颈癌发生发展的分子机制有助于提高治疗效果及改善患者预后。微小RNA(microRNA,miRNA)可通过调控下游靶基因表达从而调节肿瘤细胞增殖、迁移及侵袭等生物学行为,并可影响宫颈癌等肿瘤发生及发展过程[3-4]。微小RNA-4465(microRNA-4465,miR-4465)在结肠癌、乳腺癌等肿瘤呈表达下调,上调miR-4465表达可抑制肿瘤细胞增殖及转移,促进细胞凋亡[5-6]。但miR-4465在宫颈癌发生过程中的调控机制尚未阐明。生物信息学分析显示核转运蛋白基因α2(karyopherin subunit alpha 2,KPNA2)可能是miR-4465的靶基因,研究表明KPNA2在舌鳞癌中表达上调,沉默KPNA2表达可抑制肿瘤细胞迁移及侵袭[7]。但miR-4465是否可通过靶向KPNA2而参与宫颈癌发生发展过程尚未可知。本研究主要分析宫颈癌组织中miR-4465、KPNA2的表达,探讨miR-4465、KPNA2在宫颈癌细胞增殖、迁移及侵袭过程中的作用机制,旨在为进一步揭示宫颈癌发生发展的分子机制奠定理论基础。
1 材料与方法
1.1 材料与试剂
宫颈癌细胞株Hela购自美国ATCC细胞库;杜氏改良培养基(DMEM)、胎牛血清购自美国Gibco公司;胰蛋白酶购自美国Thermo Fisher公司;Lipofectamine2000购自上海润成生物科技有限公司;miR-4465寡核苷酸模拟物(miR-4465 mimics)及阴性对照mimic NC序列(miR-NC)、miR-4465特异性寡核苷酸抑制剂(anti-miR-4465)及其阴性对照(anti-miR-NC)购自上海吉玛制药技术有限公司;KPNA2小干扰RNA(si-KPNA2)、乱序无意义阴性序列(si-NC)购自广州锐博生物科技有限公司;pcDNA3.1购自上海柯雷生物科技有限公司;Trizol、反转录试剂盒、荧光定量PCR试剂盒购自北京天根生化科技有限公司;甲基噻唑基四唑(methylthiazolyl tetrazolium,MTT)购自北京索莱宝科技有限公司;Transwell小室购自美国Corning公司;Matrigel基质胶购自美国BD公司;双荧光素酶报告基因载体与荧光素酶活性检测试剂盒购自美国Promega公司;RIPA裂解液购自北京全式金生物技术有限公司;蛋白免疫印迹(Western blot)实验所需试剂购自上海生工生物工程股份有限公司;兔抗人KPNA2抗体购自上海安妍生物有限公司;兔抗人细胞周期蛋白1(CyclinD1)、p21抗体购自美国Santa Cruz公司;兔抗人基质金属蛋白酶-2(matrix metalloproteinases-2,MMP-2)、基质金属蛋白酶-9(matrix metalloproteinases-9,MMP-9)抗体购自美国CST公司;辣根过氧化物酶(HRP)标记的山羊抗兔二抗购自美国Abcam公司。
宫颈癌组织及癌旁组织标本来源:收集2017年3月至2018年12月于本院诊治的80例宫颈癌患者为研究对象,所有患者均经病理证实为宫颈癌,年龄50-70岁,平均年龄(65.24±7.15)岁,术前所有患者均未接受放疗或化疗,术中切取宫颈癌组织及癌旁组织(≥5 cm),将组织标本置于-80℃超低温冰箱保存。
1.2 方法
1.2.1细胞转染及分组
宫颈癌细胞Hela置于含有10%胎牛血清的DMEM完全培养基,放入37℃、5%CO2培养箱培养,待细胞生长融合度达到70%时进行传代培养。取对数期Hela细胞接种于6孔板,待细胞生长融合度达到70%时将培养基更换为不含血清的培养基,分别将miR-NC、miR-4465 mimics、si-NC、si-KPNA2、miR-4465与pcDNA、miR-4465 mimics与pcDNA-KPNA2转染至Hela细胞,分别记作miR-NC组、miR-4465组、si-NC组、si-KPNA2组、miR-4465+pcDNA组、miR-4465+pcDNA-KPNA2组,参照Lipofectamine2000转染试剂说明书进行操作,转染6 h后将培养基更换为含有血清的DMEM完全培养基,继续培养48 h,收集细胞。
1.2.2实时荧光定量聚合酶链反应(Quantitative Real-time PCR,qRT-PCR)检测miR-4465、KPNA2 mRNA的表达水平
采用Trizol法提取宫颈癌组织、癌旁组织与各组Hela细胞中的总RNA,应用Nanodrop2000c超微量分光光度计检测RNA浓度。miR-4465正向引物5’-CTCAAGTAGTCTGAC-3’,反向引物5’-GTGCAGGGTCCGAGGT-3’;KPNA2正向引物5’-CAACAAGAATCCTGCACCCC-3’,反向引物5’-GCAGGAGTCACAATTGGCAA-3’;U6正向引物5’-GCTTCGGCAGCACATATACT-3’,反向引物5’-GTGCAGGGTCCGAGGTATTC-3’;GAPDH正向引物5’-AACGGATTTGGTCGTATTG-3’,反向引物5’-GGAAGATGGTGATGGGATT-3’,引物由上海生工生物工程股份有限公司设计合成。按照反转录试剂盒制备反转录体系,反应条件:42 ℃ 15 min,95 ℃ 3 min。以cDNA为模板进行qRT-PCR反应,反应体系:10×PCR Buffer 2.5 μl,MgSO42.5 μl,dNTPs 2.5 μl,正反向引物各0.5 μl,cDNA 2 μl,RNase-Free ddH2O补足体系至25 μl;反应条件:95 ℃预变性2 min,95℃ 变性15 s,60 ℃退火30 s,72 ℃延伸30 s,共40次循环。miR-4465以U6为内参,KPNA2以GAPDH为内参,采用2-ΔΔCt法计算miR-4465、KPNA2 mRNA的相对表达量。
1.2.3双荧光素酶报告基因检测miR-4465的靶基因
StarBase预测显示KPNA2的3’UTR含有miR-4465的互补序列,将结合位点与突变位点分别插入荧光素酶报告基因载体分别构建野生型载体WT-KPNA2、突变型载体MUT-KPNA2,分别将WT-KPNA2、MUT-KPNA2与miR-NC、miR-4465 mimics共转染至Hela细胞,继续培养24 h,按照荧光素酶活性检测试剂盒检测各组荧光素酶活性。按照Lipofectamine2000试剂说明书分别将miR-NC、miR-4465 mimics、anti-miR-NC、anti-miR-4465转染至Hela细胞,Western blot法检测各组细胞中KPNA2蛋白相对表达量。
1.2.4MTT检测细胞增殖
收集各组对数期Hela细胞(密度3×104个/ml)接种于96孔板(100 μl/孔),每组设置3个复孔,每孔加入20 μl的MTT溶液(浓度5 mg/ml),继续培养4 h,弃上清,每孔加入150 μl二甲基亚砜(dimethylsulfoxide,DMSO),室温振荡孵育5 min,应用酶标仪检测各孔吸光度值(OD)。实验重复3次。
1.2.5Transwell小室实验检测细胞迁移及侵袭
细胞迁移实验:收集各组对数期Hela细胞,调整细胞密度3×104个/ml,接种于Transwell小室的上室(200 μl/孔),按照每孔600 μl的密度将含有10%胎牛血清的培养液加入Transwell小室的下室,37 ℃培养箱内培养24 h,PBS洗涤,多聚甲醛固定20 min,0.1%结晶紫染液染色10 min,显微镜下观察迁移细胞数。细胞侵袭实验:预冷培养基按照8∶1的比例稀释Matrigel基质胶,按照每孔40 μl的密度将Matrigel基质胶加入Transwell小室的上室,37 ℃培养箱孵育5 h,同时将各组对数期Hela细胞按照每孔200 μl的密度接种于Transwell小室的上室,后续实验步骤同细胞迁移实验,显微镜下观察侵袭细胞数。
1.2.6Western blot检测KPNA2、CyclinD1、MMP-2、MMP-9、p21蛋白表达
取冻存宫颈癌组织、癌旁组织与转染后的Hela细胞,加入400 μl RIPA裂解液,冰浴15 min,4 ℃条件下经3 000 r/min离心15 min,吸取上清。采用BCA法测定蛋白浓度,取40 μg蛋白样品加入SDS上样缓冲液,高温煮沸15 min,蛋白变性。采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白,转膜,封闭,孵育一抗稀释液(KPNA2稀释比1∶800,CyclinD1、MMP-2、MMP-9、p21稀释比1∶1 000),4 ℃孵育24 h,TBST洗涤,孵育二抗稀释液(稀释比1∶5 000),室温孵育1 h,TBST洗涤,暗室内曝光显影后应用ImageJ软件分析各条带灰度值。
1.3 统计学处理
2 结果
2.1 miR-4465和KPNA2在宫颈癌组织中的表达
qRT-PCR与Western blot检测结果显示,与癌旁组织比较,宫颈癌组织中miR-4465的表达水平显著降低(P<0.05),KPNA2 mRNA及蛋白表达量显著升高(P<0.05),见图1、表1。
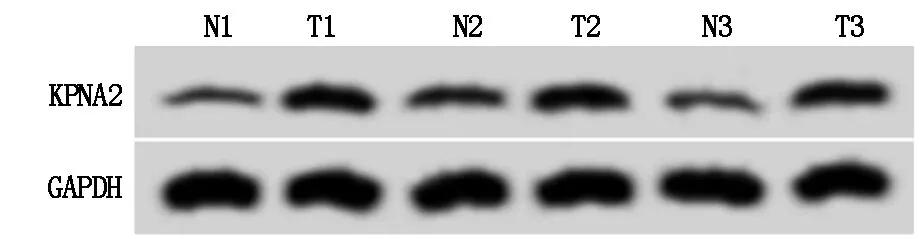
图1 KPNA2蛋白表达

表1 miR-4465和KPNA2在宫颈癌组织中的表达
2.2 miR-4465靶向调控KPNA2的表达
StarBase预测显示miR-4465与KPNA2存在结合位点,见图2A。双荧光素酶报告实验结果显示,转染野生型载体WT-KPNA2的细胞实验中,miR-4465组荧光素酶活性显著低于miR-NC组(P<0.05);转染突变型载体MUT-KPNA2的细胞实验中,miR-4465组荧光素酶活性与miR-NC组比较差异无统计学意义(P>0.05),见表2。Western blot检测结果显示,与miR-NC组相比,miR-4465组KPNA2蛋白相对表达量显著降低(P<0.05);与anti-miR-NC组相比,anti-miR-4465组KPNA2蛋白相对表达量显著升高(P<0.05),见图2B、表3。
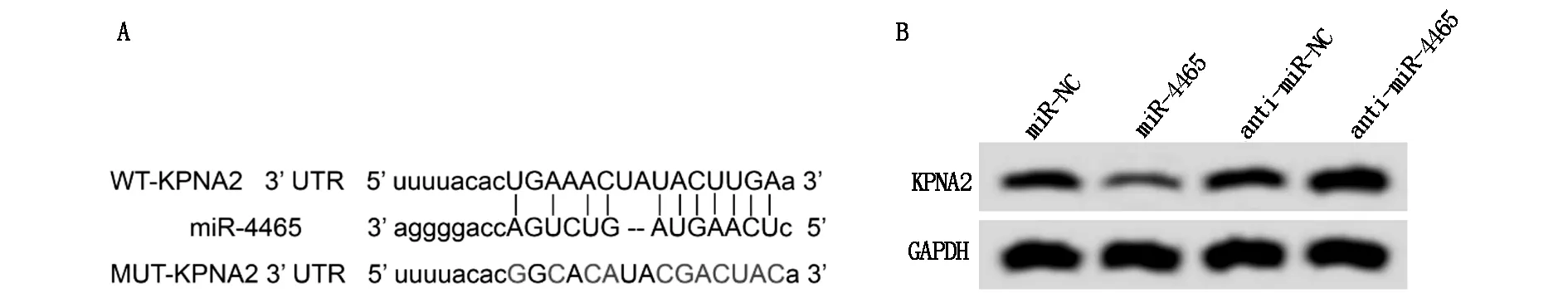
图2 miR-4465靶向调控KPNA2
表2 双荧光素酶报告实验
表3 miR-4465调控KPNA2蛋白表达
2.3 miR-4465过表达对宫颈癌细胞增殖、迁移侵袭的影响
与miR-NC组相比,miR-4465组细胞增殖活力显著降低(P<0.05),迁移细胞数与侵袭细胞数显著减少(P<0.05),CyclinD1、MMP-2、MMP-9蛋白相对表达量显著降低(P<0.05),p21蛋白相对表达量显著升高(P<0.05),见图3、表4。
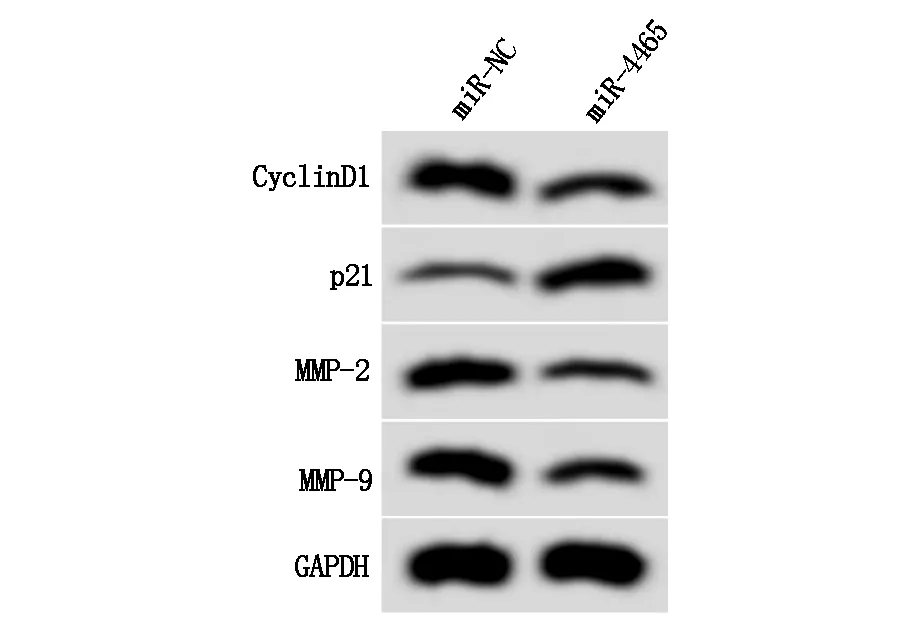
图3 增殖、迁移侵袭相关蛋白表达
表4 miR-4465过表达对宫颈癌细胞增殖、迁移侵袭的影响
2.4 干扰KPNA2表达对宫颈癌细胞增殖、迁移侵袭的影响
与si-NC组相比,si-KPNA2组细胞活力显著降低(P<0.05),迁移细胞数与侵袭细胞数显著减少(P<0.05),CyclinD1、MMP-2、MMP-9蛋白相对表达量显著降低(P<0.05),p21蛋白相对表达量显著升高(P<0.05),见图4、表5。
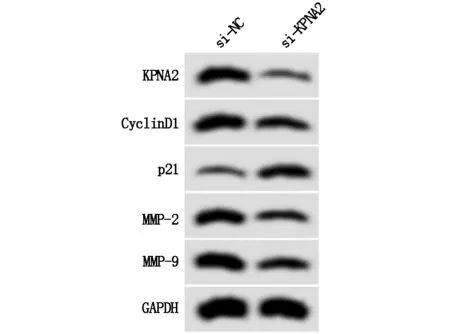
图4 KPNA2和增殖、迁移侵袭相关蛋白表达
表5 干扰KPNA2表达对宫颈癌细胞增殖、迁移侵袭的影响
2.5 KPNA2过表达逆转了miR-4465过表达对宫颈癌细胞增殖、迁移侵袭的作用
实验结果显示,与miR-4465+pcDNA组相比,miR-4465+pcDNA-KPNA2组细胞活力显著升高(P<0.05),迁移细胞数与侵袭细胞数显著增多(P<0.05),CyclinD1、MMP-2、MMP-9蛋白相对表达量显著升高(P<0.05),p21蛋白相对表达量显著降低(P<0.05),见图5、表6。

图5 KPNA2和增殖、迁移侵袭相关蛋白表达
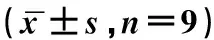
表6 KPNA2过表达逆转了miR-4465过表达对宫颈癌细胞增殖、迁移侵袭的作用
3 讨论
宫颈癌发生发展过程与多种基因、信号通路异常有关,既往研究显示miRNA在宫颈癌中表达异常,并可通过调控靶基因表达从而影响宫颈癌细胞增殖、迁移及侵袭等生物学过程[8-9]。但仍有部分miRNA在宫颈癌发生发展过程中的作用机制尚未阐明。因而本研究积极探寻新型miRNA,通过生物学信息分析miRNA的靶基因并进行验证,探讨miRNA与靶基因在宫颈癌发生及转移过程中的作用机制。
miR-4465在卵巢癌中表达下调,长链非编码RNA SNHG6(LncRNA SNHG6)可通过竞争性结合miR-4465从而促进卵巢癌细胞增殖及迁移[10]。研究表明miR-4465可通过调控靶基因表达从而参与非小细胞肺癌等多种肿瘤发生及发展过程[11-12]。与上述研究结果相似,本研究结果显示miR-4465在宫颈癌组织中表达下调,提示miR-4465表达量降低可能促进宫颈癌的发生。本研究通过生物学信息分析与双荧光素酶报告实验证实KPNA2是miR-4465的靶基因,研究表明KPNA2表达量升高可促进食管鳞状细胞癌、肝癌细胞生长[13-14]。相关报道指出KPNA2还可参与口腔鳞癌发生及发展过程[15]。与上述研究结果相似,本研究结果显示KPNA2在宫颈癌组织中表达上调,提示KPNA2在宫颈癌发生过程中可能发挥癌基因作用。
本研究进一步探讨miR-4465、KPNA2在宫颈癌发生及发展过程中的作用机制,采用体外细胞实验进行验证,miR-4465过表达后宫颈癌细胞增殖活力显著降低,迁移与侵袭能力明显减弱,提示miR-4465过表达可抑制宫颈癌细胞增殖、迁移及侵袭。研究表明CyclinD1可与细胞周期依赖蛋白激酶4(CDK4)结合形成复合体从而正向调控细胞周期,促进细胞增殖,p21可抑制CyclinD1与CDK4结合从而诱导细胞周期阻滞于G1期,抑制细胞增殖[16]。基质金属蛋白酶可降解细胞外基质、基底膜等,增强肿瘤细胞转移能力,MMP-2、MMP-9属于基质金属蛋白酶,研究表明MMP-2、MMP-9在宫颈癌细胞中呈高表达并可促进细胞迁移及侵袭[17]。本研究结果显示miR-4465过表达后CyclinD1、MMP-2、MMP-9表达量显著降低,p21表达量显著升高,干扰KPNA2表达对宫颈癌细胞增殖、迁移及侵袭的作用与miR-4465过表达后的作用相同,提示miR-4465过表达或干扰KPNA2表达可能通过调控细胞增殖、迁移及侵袭相关蛋白表达从而促进宫颈癌细胞增殖、迁移及侵袭。同时本研究结果显示KPNA2过表达可明显减弱miR-4465过表达对宫颈癌细胞增殖、迁移及侵袭的抑制作用,提示miR-4465过表达可能通过下调KPNA2的表达从而降低宫颈癌细胞增殖、迁移及侵袭能力。
综上所述,miR-4465可抑制宫颈癌细胞增殖、迁移及侵袭,其作用机制与miR-4465靶向调控KPNA2的表达有关,可为揭示宫颈癌发生发展的分子机制提供新方向,miR-4465可能作为宫颈癌靶向治疗的潜在靶点。
