血清唾液酸和EB病毒壳抗原IgA抗体检测在喉部肿瘤诊断中的临床价值
2021-05-25罗通勇杨华清贾全凡岳胜清文小姣任贤灵
罗通勇,杨华清,罗 丹,袁 龙,贾全凡,岳胜清,文小姣,任贤灵
(1.广元市中心医院 耳鼻喉科 头颈外科;2.广元市中心医院 肿瘤科,四川 广元 628000)
喉部肿瘤是临床常见的头颈部肿瘤之一,若能及早发现、及早治疗,可防止其恶性转移,及时控制疾病进展,患者预后生存情况较好;若发现较晚,肿瘤可能已发生恶性转移,不仅影响患者的生存质量,还可能危及生命,因此寻求更有效鉴别诊断喉部肿瘤良恶性的方法对临床防治喉部肿瘤具有重要意义[1-2]。研究表明,血清唾液酸(Serum sialic acid,SA)、EB病毒壳抗原IgA(EB virus capsid antigen IgA,VCA-IgA)抗体均与喉部恶性肿瘤的发生发展密切相关,是临床用于诊断、监测喉部肿瘤的新型生物学指标[3-4],多数EB病毒感染人体后首先于咽部上皮细胞内增生,通过检测VCA-IgA抗体可判定喉部细胞组织的癌变风险;SA主要存在于细胞膜表面,肿瘤细胞生长过程中细胞膜表面糖脂出现恶性转化,使SA释放入血,因此可通过测定SA水平辅助诊断喉部恶性肿瘤。本研究探讨了SA和VCA-IgA抗体检测在喉部肿瘤诊断中的临床价值,现报道如下。
1 材料与方法
1.1 一般资料将2014年2月-2019年1月广元市中心医院的经临床病理检查确诊为喉部恶性肿瘤患者85例设为恶性组,将同期经临床病理检查确诊为喉部良性病变患者85例设为良性组。恶性组纳入标准:均符合喉部恶性肿瘤的相关诊断[5]。排除标准:合并除喉部恶性肿瘤外其他恶性肿瘤者;合并免疫功能缺陷者;合并严重营养不良者;临床病例资料不全者。良性组纳入标准:均符合喉部良性肿瘤的相关诊断。排除标准:合并恶性肿瘤者;合并免疫功能缺陷者;合并严重营养不良者;临床病例资料不全者。本研究经医院医学伦理委员会批准。
1.2 方法收集所有患者的临床病例资料,进行回顾性分析。对所有患者均行SA和VCA-IgA抗体检测。采集良性组与恶性组外周静脉血5 ml,置于抗凝管内静置1.5 h,用离心机(德国Hettich,ROTOFIX32A)离心10 min,转速3 000 r/min,用移液枪抽取上清液置入微型离心管中,-80℃保存备用。用快速比色法检测两组外周血SA水平,用酶联免疫吸附实验试剂法检测两组外周血VCA-IgA抗体含量,以血清样本吸光度与标准品的相对吸光度比值表示结果,试剂盒均购自武汉华联科生物科技有限公司,操作流程均严格参照相关试剂和仪器说明书。
1.3 观察指标①观察比较良性组与恶性组的一般资料。②记录良性组与恶性组外周血SA、VCA-IgA抗体水平,用ROC曲线分析SA、VCA-IgA抗体对喉部肿瘤良恶性的诊断价值。③依据TNM病理分期标准[6],比较恶性组不同分期患者体内SA、VCA-IgA抗体水平差异。④所有患者均于确诊病情后持续接受个体化治疗,收集恶性组患者治疗1年后的预后结局,参照《实体瘤治疗疗效评价标准-RECIST》[7]将患者分为进展组和无进展组,比较进展组和无进展组治疗前SA、VCA-IgA抗体水平差异。

2 结果
2.1 两组一般资料比较两组一般资料均无明显差异(P>0.05),见表1。

表1 两组一般资料比较
2.2 良性组与恶性组SA、VCA-IgA抗体水平比较恶性组SA、VCA-IgA抗体水平均明显高于良性组(P<0.05),见表2。

表2 良性组与恶性组SA、IgA抗体水平比较
2.3 SA、VCA-IgA抗体检测及其两者联合诊断喉部肿瘤良恶性的ROC曲线分析ROC曲线分析结果显示,SA、VCA-IgA抗体检测及其两者联合对喉部肿瘤良恶性均具有一定诊断价值(P<0.05),且SA联合VCA-IgA抗体检测的AUC大于单独SA、VCA-IgA抗体检测,差异均具有统计学意义(P<0.05),见表3,图1。
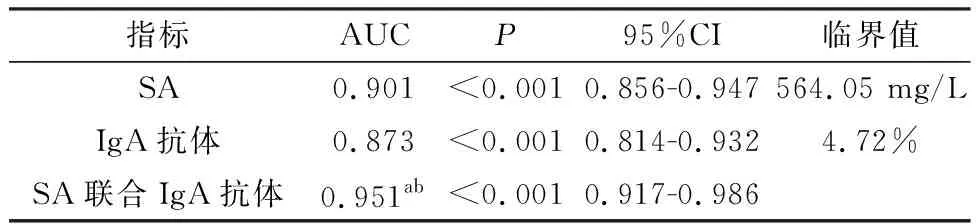
表3 SA、VCA-IgA抗体检测及其两者联合诊断喉部肿瘤良恶性的ROC曲线分析
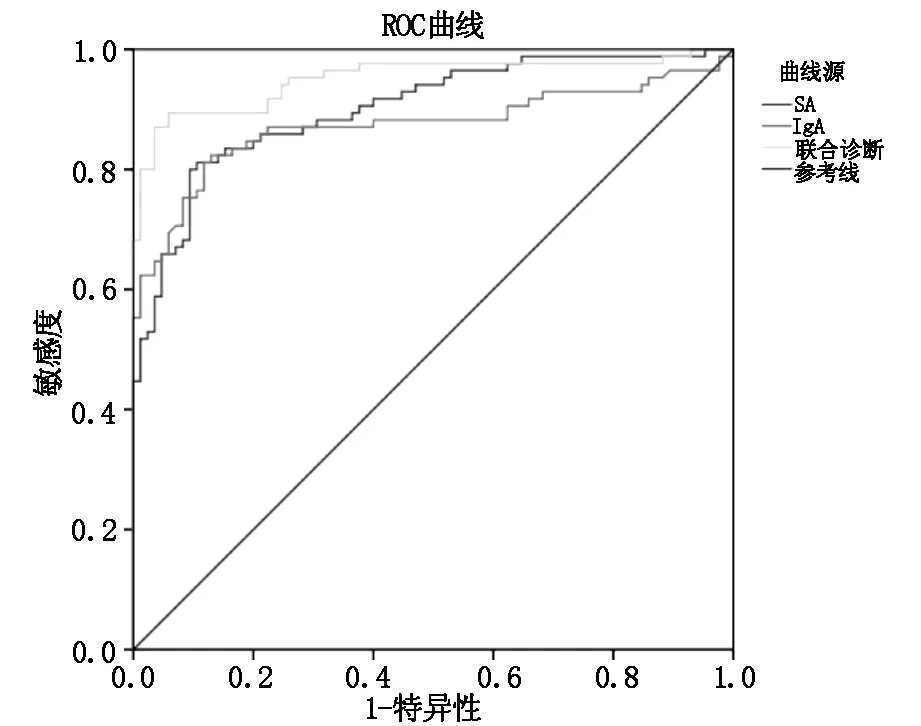
图1 SA、VCA-IgA抗体检测及其两者联合诊断喉部肿瘤良恶性的ROC曲线
2.4 分析不同病理分期SA、VCA-IgA抗体水平恶性组85例患者中,Ⅰ期25例,Ⅱ期34例,Ⅲ期19例,Ⅳ期7例,Ⅰ期SA、VCA-IgA水平低于Ⅱ期,Ⅱ期SA、VCA-IgA水平低于Ⅲ期(P<0.05),Ⅲ期、Ⅳ期SA、VCA-IgA水平比较,差异无统计学意义(P>0.05),见表4。

表4 不同病理分期SA、VCA-IgA抗体水平比较
2.5 分析不同预后结局SA、VCA-IgA抗体水平恶性组85例患者中,有53例患者于治疗后1年出现肿瘤复发或转移,32例患者病情无进展。进展组SA、VCA-IgA水平均高于无进展组(P<0.05),见表5。
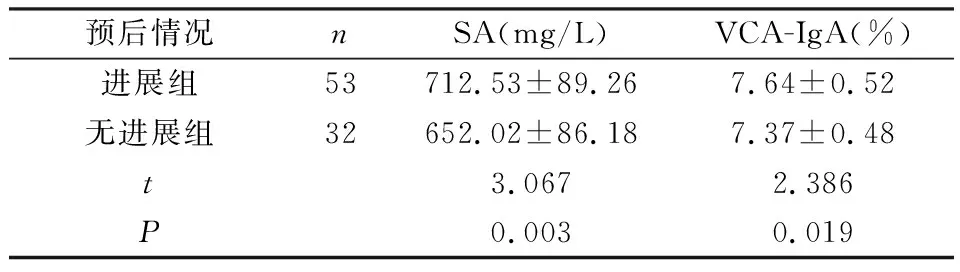
表5 不同预后结局SA、VCA-IgA抗体水平比较
3 讨论
近年来,喉部肿瘤的发病率日益增长,已成为最常见的恶性肿瘤之一,然而喉部恶性肿瘤早期仅表现为咳嗽、咽喉不适等,症状不明显,易错过最佳治疗时机[8-9]。研究发现,SA有助于临床诊断多种恶性肿瘤,而VCA-IgA抗体可特异性反映EB病毒感染与否及其严重程度[10-11]。本研究结果显示,恶性组SA、VCA-IgA抗体水平明显高于良性组,提示SA、VCA-IgA抗体水平在喉部恶性肿瘤患者体内明显升高。究其原因,可能是SA作为神经氨酸的乙酰化衍生物,是细胞膜糖蛋白和糖脂的重要组成部分,位于神经节苷酯的糖链末端,具有参与细胞识别、粘着、接触抑制等多种生理功能,是一种广谱的肿瘤标志物。正常代谢时,SA含量较低且稳定,当患恶性肿瘤时,瘤细胞表面糖蛋白与糖脂的结构和含量显著变化,大量唾液酸可从癌细胞表面脱落进入血液,使得SA水平升高[12]。SA广泛存在于人体各组织器官的细胞膜内,是细胞膜上糖蛋白、糖脂的重要组成成分,可参与细胞恶性转化,其含量与恶性肿瘤细胞的增殖、转移、浸润、细胞粘附性降低、肿瘤抗原特异性识别、逃避宿主细胞免疫监视等密切相关,可辅助诊断肝癌、肺癌、肠癌、血癌、鼻咽癌、喉癌等多种恶性肿瘤,是一种广谱的肿瘤标志物[13]。此外,研究表明,EB病毒属于疱疹病毒科嗜淋巴细胞病毒属的成员,喉部恶性肿瘤患者多合并有EB病毒感染,EB病毒感染机体B淋巴细胞后可产生大量与其壳抗原相对应的VCA-IgA抗体,从而表现为VCA-IgA抗体水平上升[14]。喉部恶性肿瘤发生时,EB病毒通过在机体喉部上皮细胞内大量增殖,引起B淋巴细胞的增生性或非增生性感染,其抗体具有特异性,有助于鉴别喉部恶性肿瘤[15]。
本研究ROC曲线分析结果显示,SA、VCA-IgA抗体及其两者联合对喉部肿瘤良恶性均具有一定的诊断价值,且SA联合VCA-IgA抗体检测的AUC大于单一的SA、VCA-IgA抗体检测。SA联合VCA-IgA抗体检测将广泛有效的肿瘤标志物SA与特异性生物学指标VCA-IgA抗体相结合,进一步提高了诊断效能。Campbell等[16]的研究表明,SA水平可监测喉部肿瘤病情,联合VCA-IgA抗体可提高喉部恶性肿瘤检出率,该结论与本研究结果相符合。
临床TNM病理分期是根据病理检测结果对肿瘤的恶化程度及转移范围进行判定,有助于临床医师根据疾病进展阶段针对性制定治疗方案,然而部分患者接受化疗、放疗治疗后,病情仍难以控制,其原因可能在于肿瘤已发展至晚期,或出现全身多处转移,病变组织清除难度较大,导致治疗效果并不理想。通过检测不同TNM分期及不同预后结局患者体内SA、VCA-IgA抗体水平,本研究发现,恶性组SA、VCA-IgA抗体水平随临床TNM病理分期Ⅰ-Ⅳ期逐渐升高,进展组接受治疗前SA、VCA-IgA抗体水平较无进展组更高。由此可知,SA、VCA-IgA抗体水平越高,表明喉部肿瘤恶化程度越严重,发生全身性转移的风险也越高,因此可根据患者体内SA、VCA-IgA抗体水平表达初步判断患者预后生存情况,同时为临床综合评估病情提供有效参考。
综上所述,SA和VCA-IgA抗体检测对鉴别喉部肿瘤良恶性均具有一定的诊断价值,且SA联合VCA-IgA抗体检测的诊断效能大于单一指标检测。通过测定SA、VCA-IgA抗体水平有助于分析喉部肿瘤恶化及转移进程,对患者预后结局具有一定预测价值。
