某规模化猪场废水中抗生素污染特征及生态风险评估
2021-05-25李盟军申健姚建武宁建凤王荣辉周凯军艾绍英
李盟军,申健,姚建武,宁建凤,王荣辉,周凯军,艾绍英
(广东省农业科学院农业资源与环境研究所/农业农村部南方植物营养与肥料重点实验室/广东省养分资源循环利用与耕地保育重点实验室/广东省农业面源污染监测评估与防控工程技术研究中心,广州510640)
抗生素是一类治疗和预防各种细菌、致病微生物感染疾病的化学物质,畜禽养殖中通过注射、口服、饮水等方式进入动物体内的抗生素,只有极少部分会被动物吸收利用,绝大多数(60%~90%)会以原药或代谢产物的形式通过粪便和尿液排出体外[1-3],残留的药物仍然具有活性,因此对环境和人体健康构成巨大的潜在危害。残留在养殖场废水和废物中的抗生素进入周边土壤,可杀死部分土壤及根际微生物、改变土壤生物群落结构和功能[4],从而破坏土壤的微生态环境[5];进入水体,对水生生物造成不可逆的毒害[6]。同时,残留在土壤和水体中的抗生素可通过食物链或饮用水途径进入人体,诱导体内细菌产生抗性,使细菌耐药性增强,降低抗菌药物疗效,从而降低抗生素治疗疾病的能力[7],严重的会造成免疫系统功能紊乱,甚至致畸、致癌[8],威胁人类健康。抗生素污染已成为不可忽视的环境问题之一[9]。因此,最大限度地削减残留在养猪场废水中的抗生素成为当前研究者关注的焦点[10-11]。
越来越多的规模化养猪场建立了较完善的废水处理设施,以减少废水中的有机物等,但关于抗生素在不同污水处理阶段废水中的分布、去除率和废水综合利用的生态环境风险报道较少。本文选定广东一规模化养猪场,连续2 a 于夏、冬两季采集饲料、不同处理阶段废水和鱼塘水,用超高效液相色谱-质谱联用(UPLC-MS/MS)测定抗生素含量,通过分析规模化猪场废水中抗生素污染特征及去除效率,探明养猪产生的废水中兽用抗生素污染现状,测算经处理后废水抗生素日排放量,评估处理后废水和鱼塘水的抗生素生态风险,以期为规模养猪场中兽用抗生素的污染削减、废水综合利用及环境治理提供数据支撑。
1 材料与方法
1.1 养猪场概况
监测猪场位于广东省某市,养殖类型为自繁自养型,生猪存栏量2 100 头,占地约16.5 hm2,其中猪舍7 000 m2,猪舍清污方式主要采用水冲式,日产污水约45 m3。猪场建设有废水处理系统,包括池容40 m3的粪水收集池,池容200 m3的酸化调节池,容积1 200 m3的圆形钢板焊接一体化结构的上流式厌氧消化池(沼气池),池容500 m3的好氧-膜生物反应器(曝气池)。该猪场配套废水综合利用设施,包括种植饲草的10.0 hm2农田和约6 600 m2的鱼塘。
1.2 采样点设置
设置4 个水质样品和1 个饲料样品采样点(图1)。根据废水处理不同阶段分别采原水、沼液、曝气池排水和鱼塘水样,采样点分别布设在粪水收集池、沼气池排水口、曝气池排水口和接纳处理废水的鱼塘。采集饲料混合样1 个。同时监测曝气池排水流量。
1.3 采样方法
在养猪场冲栏污水产生的高峰时段采样,采样前先润洗2~3次采样器具。原水在粪水收集池中采集,搅拌泵充分搅拌均匀后用水质采集器多点采混合样;沼气池排水和曝气池排水,分别在沼气池排水口和曝气池排水口采集,排水5 min 后在单次出水时间段内多次采集混合样。鱼塘水在接纳处理废水的鱼塘中用水质采样器采集水面以下0.5 m 处多点混合水样。种猪料、小猪料、中猪料和大猪料在2017年7月、2018年6月和2018年11月的用量比分别为19∶18∶29∶34、19∶18∶29∶34 和20∶18∶27∶34,按各饲料用量比组成500 g 混合饲料样。采样完成后,立即冷藏(0~4 ℃)、避光保存,尽快带回实验室分析。在2017—2018 年,每年夏、冬各进行1 次监测,结合广东的气候特点,选择温度高、湿度大的6—8 月进行夏季监测,温度低、湿度小的11—12 月进行冬季监测,具体时间分别为2017 年7 月15 日、11 月27 日和2018 月6 月27 日、12月25日。
1.4 分析方法
1.4.1 试剂与仪器
本研究参照《全国规模化养殖污染监测国控点工作方案》中要求,选取养殖业常用的4 类19 种抗生素作为目标监测物,包括2 种大环内酯类(MAs)抗生素:红霉素(Erythromycin,ETM)、泰乐菌素(Tylosin,TYL);4 种喹诺酮类(QLs)抗生素:环丙沙星(Cipro⁃floxacin,CIP)、恩诺沙星(Enrofloxacin,ENR)、诺氟沙星(Norfloxacin,NFX)、氧氟沙星(Ofloxacin,OFX);9种磺胺类(SAs)抗生素:磺胺氯哒嗪(Sulfachloropyrid⁃azine,SCP)、磺胺间二甲氧嘧啶(Sulfadimethoxypyrim⁃idine,SDM)、磺胺嘧啶(Wulfadiazine,SDZ)、磺胺脒(Sulfaguanidine,SGN)、磺胺二甲嘧啶(Sulfadimidine,SM2)、磺胺对甲氧嘧啶(Sulfameter,SMD)、磺胺间甲氧嘧啶(Sulfamonomethoxine,SMM)、磺胺甲噁唑(Sul⁃famethoxazole,SMZ)、磺胺噻唑(Sulfathiazole,ST);4种四环素类(TCs)抗生素:金霉素(Chlortetracycline,CTC)、强力霉素(Doxycycline,DOX)、土霉素(Oxytet⁃racycline,OTC)、四环素(Tetracycline,TC)。以上抗生素标准品均购于德国Dr.Ehrenstorfer GmbH 公司。
内标:环丙沙星-d8(Ciprofloxacin-d8,98.0%)、磺胺二甲嘧啶-d6(Sulfamethazine-d6,98.0%)、四环素-d6(Tetracycline-d6,95.0%)、红霉素-d4(Erythromy⁃cin-d4,99.0%),均购自美国多伦多研究化学品公司。色谱纯试剂:乙腈、甲醇和甲酸均购自德国Merck 公司;分析纯试剂:柠檬酸、丙酮、NaH2PO4和Na2EDTA均购自国药集团化学试剂有限公司。
Agilent 1290-6470 超高效液相色谱串联三重四极杆质谱仪,Dionex AutoTrace 280 全自动固相萃取仪,Agilent Bond ElutPlexa 200 mg 6 mL 固相萃取柱,Thermo Scientific Soravll Legend plus 高速冷冻离心机,德祥Organomation 全自动氮吹浓缩仪,实验用水用Milli-Q超纯水机(过0.22 μm孔径滤膜)制备。
1.4.2 色谱条件和质谱条件
基本质谱条件:ESI源(+),脱溶剂气温度500 ℃,气体流速500 L·h-1,毛细管电压(Capillary voltage)3.5 kV,锥孔电压25 V,锥孔气体流速150 L·h-1。色谱和质谱参数采用已优化的方法[12-13]。
1.4.3 样品处理及测定
准确称取已粉碎、匀质后的饲料样品5.00 g(精确至0.01 g),置于50 mL 聚丙烯离心管中,加入5.00 mL 0.1 mol·L-1Na2EDTA 溶液,在快速混匀器上充分涡旋混匀1 min,加入20.00 mL甲醇-乙腈(50∶50)溶液,涡旋混匀,超声提取15 min,4 000 r·min-1离心10 min,移取上清液10 mL 于聚丙烯离心管中,加入300 mg Bondesil-PSA 吸附剂,涡旋1 min,4 000 r·min-1离心5 min,过0.22 μm滤膜,待上机测定[14]。
准确量取混合均匀的水质样品200 mL 于5 000 r·min-1离心10 min,取上清液过0.45 μm 滤膜,用1 mol·L-1的盐酸调节滤液pH 值至3.8,加入100 μL 饱和Na2EDTA 溶液。SPE 固相萃取柱,预先采用5 mL乙酸乙酯、5 mL 甲醇、5 mL 纯水(用1 mol·L-1的盐酸调节pH 至3.85)依次淋洗活化。开启真空泵,控制流速为3~5 mL·min-1,将过膜上清液上柱,进样量为5 mL。过柱完成后,分别用5 mL 5%甲醇水、5 mL 超纯水冲洗小柱,对HLB 柱抽真空干燥30 min,最后用4.5 mL 甲醇和4.5 mL 50%甲醇+50%乙酸乙酯洗脱,收集洗脱液并在室温下用N2吹扫至近干,用10%甲醇定容至1 mL,采用UPLC-MS/MS 定量分析[13],平行双样测定。
1.4.4 检出限和加标回收率
ETM、TYL、CIP、ENR、NFX、OFX、SCP、SDM、SDZ、SGN、SM2、SMD、SMM、SMZ、ST、CTC、DOX、OTC和TC 在水质中的检出限分别为0.011、0.008、0.022、0.023、0.016、0.008、0.026、0.009、0.011、0.010、0.005、0.014、0.033、0.021、0.005、0.026、0.031、0.021 μg·L-1和0.023 μg·L-1,在饲料中的检出限分别为0.20、0.14、0.15、0.15、0.28、0.23、0.038、0.016、0.020、0.10、0.025、0.035、0.016、0.22、0.050、1.95、2.07、1.26 μg·kg-1和1.80 μg·kg-1。
为保证实验数据的可靠性,每批样品均设置加标实验,测定加标回收率。水质中ETM、TYL、CIP、ENR、NFX、OFX、SCP、SDM、SDZ、SGN、SM2、SMD、SMM、SMZ、ST、CTC、DOX、OTC 和TC 的加标回收率分别为78.1%~92.9%、80.3%~96.6%、90.6%~111.0%、91.9%~110.0%、88.1%~109.1%、78.1%~93.3%、75.2%~98.3%、77.4%~85.1%、83.1%~110.5%、79.3%~96.2%、82.9%~110.1%、80.1%~90.0%、78.6%~90.1%、77.6%~87.3%、75.6%~93.2%、69.8%~83.1%、70.1%~80.0%、73.3%~85.6%和68.8%~83.9%。饲料中CTC、DOX、OTC 和TC 的加标回收率分别为71.2%~90.3%、68.3%~83.2%、75.3%~95.2%和69.6%~82.6%。检测结果的相对标准偏差(RSD)均小于15.0%。
1.5 猪场抗生素使用现状
调查监测前1 个月内猪场抗生素使用情况,2017年7 月采用肌注使用ENR、SDZ 和SM2,通过饲料使用CTC、OTC 和TC;2017 年12 月采用肌注使用CIP、ENR、SM2 和SMM,通过饮水使用DOX,通过饲料使用CTC、OTC 和TC;2018 年6 月采用肌注使用CIP、ENR、SDZ、SM2、SMM 和SMZ,通过饮水使用ETM,通过饲料使用CTC、DOX、OTC 和TC;2018 年11 月采用肌注使用SM2,通过饮水使用ETM 和OTC,通过饲料使用TC、DOX 和TC。该猪场采用自繁自养型养殖模式,有各生育期、不同猪龄的猪,同时段既有猪处于用药期,也有猪处于休药期。
1.6 去除率及日排放量
抗生素去除率(R)计算公式如下:
式中:R为某处理设备(工艺)抗生素去除率,%;Ci(Front)为进入某处理设备(工艺)前水中第i种(类)抗生素浓度,μg·L-1;Ci(After)为该设备(工艺)排水中第i 种(类)抗生素浓度,μg·L-1。
抗生素日排放量(Wi)和单头猪抗生素日排放量(Wsi)计算公式如下:
式中:Wi为第i 种(类)抗生素日排放量,mg·d-1;Wsi为单头猪第i种(类)抗生素日排放量μg·d-1·pig-1;Ci(Aera⁃tion)为曝气池排水中第i 种(类)抗生素浓度,μg·L-1;Q为曝气池日排水量,m3·d-1;Amount 为生猪存栏量,头。
1.7 风险评估方法
养猪场原水依次经沼气池和曝气池处理后部分进入农田,部分进入鱼塘。按欧盟的技术指导文件中关于环境风险评价的方法[15],本文对曝气池排水和鱼塘水采用生态风险商值(Risk quotient)评价抗生素的生态风险。计算公式如下:
式中:RQ 为风险商值;MEC 为抗生素的测定浓度;PNEC 为预测的无效浓度;LC50为最低效应浓度,EC50为半效应浓度,毒性数据可通过EPA ECTOX 数据库查询获得;AF为评估因子,其数值根据欧盟的技术指导文件(TGD)中生物毒性数据情况选取,急性毒性数据AF 取值1 000,慢性毒性数据满足一个营养级时AF 取100,慢性毒性数据满足两个营养级时AF 取50,慢性毒性数据满足3个营养级时AF 取10,综合考虑后AF取值1 000。
按照Hernando 等[16]提出的RQ 分类方法表征生态风险等级,共分为3 个环境风险等级:0.01≤RQ<0.1时,为低环境风险;0.1≤RQ<1 时,为中等环境风险;RQ≥1时,为高环境风险。
2 结果与讨论
2.1 饲料中抗生素的种类及含量
猪饲料中仅检出CTC、DOX、OTC和TC 4种抗生素,均为TCs抗生素,浓度为1 867~181 050 μg·kg-1(表1)。DOX 在2017 年夏样品中未检出,OTC 在2018 年冬样品中未检出。监测期间猪饲料中添加抗生素种类有所差异,其中2017 年夏和2018 年夏饲料样品中均以OTC 为主,占总抗生素的91.6%,2018 年冬饲料中CTC 占比较高,为69.6%。OTC 和CTC 是猪饲料中主要添加抗生素,与这两种抗生素的使用成本较低有关。
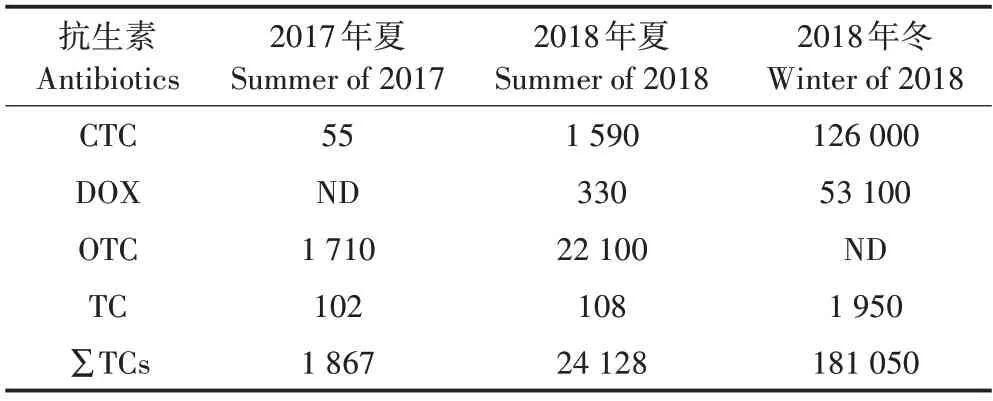
表1 饲料中抗生素含量(μg·kg-1)Table 1 Antibiotics content in pig feed(μg·kg-1)
2.2 废水中抗生素浓度特征
19 种抗生素中,在猪场原水、沼液、曝气池排水和鱼塘水中均未检出TYL、NFX、SCP、SDM、SGN、SMD 和ST 等7 种,检出的12 种抗生素情况见表2。MAs浓度相对较低,在原水中未检出,沼液、曝气池排水中平均浓度在0.01~0.02 μg·L-1之间。QLs、SAs 和TCs 浓度大小依次均为原水>沼液>曝气池排水>鱼塘水,在原水、沼液和曝气池排水中QLs 浓度分别为1 791.41、144.23 μg·L-1和0.10 μg·L-1,SAs 的浓度分别为4 144.28、146.16 μg·L-1和21.24 μg·L-1,TCs的浓度分别为42 393.81、34 431.30 μg·L-1和388.02 μg·L-1。TCs 在原水、沼液和曝气池排水中分别占检出抗生素的87.7%、99.2%和94.8%,表明该养猪场废水中兽用抗生素污染以TCs 为主。这与陈永山等[17]的研究结果一致,主要是因为饲料抗生素添加是养猪场兽药利用的主要形式[18],该养猪场在饲料中大量添加OTC 和CTC,且添加的抗生素60%~90%通过原药形式代谢[1-3]。鱼塘水中SAs 浓度为2.79 μg·L-1,与国彬等[19]对鱼塘水中SAs(2.82 μg·L-1)的研究结果基本相当。鱼塘水中TCs浓度为0.59 μg·L-1,QLs未检出。

表2 猪场水环境中12种抗生素的浓度及检出率Table 2 Concentrations of 12 selected antibiotics in the large-scale piggery wastewater and slurry
ETM 在原水中未检出,在沼液、曝气池排水和鱼塘水中检出率均为50%,平均浓度分别为0.02、0.01 μg·L-1和0.01 μg·L-1,这可能是原水中含有ETM 代谢产物,在生物处理过程中该代谢产物被转化为其母体化合物[20]。该猪场养殖废水中的ETM 通过饮水途径进入。
原水中CIP和OFX 检出率为50%,ENR 检出率为75%,ENR 和CIP 通过肌注经猪代谢后进入原水。经过处理设施(沼气池+曝气池)后的废水中CIP 检出率为25%,ENR 检出率为50%,OFX 未检出;鱼塘水中CIP、OFX 和ENR 均未检出。ENR 在原水、沼液和曝气池排水中浓度最高,分别占QLs 的83.2%、99.8%和80.0%。CIP 在原水、沼液和曝气池排水中浓度分别为300.46、0.13 μg·L-1和0.02 μg·L-1。
原水中SDZ 和SMM 检出率为50%,SM2 检出率为100%,其均通过肌注经猪代谢后进入原水。经过处理设施(沼气池+曝气池)后废水中SDZ 和SMM 检出率为25%,SM2 检出率为75%;鱼塘水中SDZ、SM2和SMM检出率均为100%。原水中SMM浓度为3 975.15 μg·L-1,占SAs比例高达95.9%,与韩跃飞[21]、杨钊等[22]和周婧等[23]的研究结果相似;鱼塘水中SMM 浓度为1.86 μg·L-1,占SAs 的66.6%。沼液和曝气池排水中以SM2 浓度最高,分别占SAs 的49.7% 和78.1%。SMZ 仅在沼液中有检出,检出率为25%,浓度为0.03 μg·L-1,可能因为原水中该抗生素浓度较低,且含有目标抗生素代谢物,通过厌氧处理后该代谢物部分转化为其母体[22],从而被检出有关。
原水中DOX 检出率为75%,CTC、OTC 和TC 检出率均为100%。2017 年冬,DOX 通过饮水途径进入原水,原水中DOX 占TCs 的0.3%;2018 年冬,OTC 通过饮水途径进入原水,原水中OTC 占TCs 的4.5%;其他监测时段原水中CTC、DOX、OTC 和TC 通过饲料添加的途径进入原水,饲料是猪场废水中CTC、DOX、OTC和TC 的主要来源。经过处理设施(沼气池+曝气池)后废水中CTC 未检出,DOX、OTC 和TC检出率分别为50%、100%和75%;鱼塘水中CTC 未检出,DOX、OTC和TC 检出率均为50%。OTC 和DOX 浓度均为沼液>原水>曝气池排水>鱼塘水,沼液中OTC 和DOX 浓度高于原水可能是因为原水中含有目标抗生素的代谢产物,在生物处理过程中代谢产物转化为其母体化合物被检出,这与杨钊等[22]和Göbel 等[20]的研究结果相似。CTC 和TC 检出浓度均为原水>沼液>曝气池排水≥鱼塘水,CTC 在曝气池排水和鱼塘水中未检出。TCs中OTC在原水、沼液、曝气池排水和鱼塘水占比分别为46.1%、71.5%、98.3%和99.8%,在养猪场废水和鱼塘水TCs 中均以OTC 的占比最高,这与陈永山等[17]对浙江规模猪场,魏瑞城等[24]对江苏规模猪场及陈乾等[25]对天津规模化奶牛场的废水中抗生素污染特征的研究结果一致。这可能与OTC 和CTC 是该猪场饲料中主要的添加抗生素有关。
2.3 厌氧和好氧处理对抗生素的去除效果
沼气池是猪场废水处理过程中典型的厌氧处理设施,主要利用厌氧和兼性厌氧微生物在厌氧条件下对废水中的有机物进行生化降解;曝气池是猪场废水处理过程中最常使用的好氧处理设施,主要利用好氧和兼性厌氧微生物在有氧条件下氧化、降解废水中的有机污染物。该猪场沼气池和曝气池对养殖废水中抗生素去除率见图2。
曝气池对沼液ETM 去除率为33.33%。沼气池对原水中CIP、ENR 和OFX 的去除率分别为99.96%、90.34%和21.43%,对QLs 的平均去除率为91.95%。曝气池对沼液中CIP、ENR 和OFX 的去除率分别为84.62%、99.94% 和100%,对QLs 的平均去除率为99.93%。曝气池对沼液中QLs 的去除率高于沼气池对原水的处理效率,这与周婧等[23]的好氧处理阶段对QLs 去除率高于厌氧处理阶段的结果一致。沼气池对原水中SDZ、SM2 和SMM 的去除率分别为-359.44%、56.95%和98.19%,对SAs 的平均去除率为96.47%。沼气池对SDZ 的去除率为负值,与杨钊等[22]厌氧发酵池对SDZ 去除出现负迁移现象的研究结果一致,这可能是SDZ的乙酰化代谢物在生物处理过程中发生生物转化的结果[20]。曝气池对沼液中SDZ、SM2、SMM 和SMZ 的 去 除 率 分 别 为96.96%、77.17%、93.6%和100%,对沼液中SAs 的平均去除率为85.47%。沼气池对SAs的去除率高于曝气池,这可能与废水中SAs 以SMM 占比高,且SMM 分子结构中存在氮原子和硫原子,在厌氧条件下易于生物降解有关[26-27]。沼气池对原水中CTC、DOX、OTC 和TC 的去除率分别为94.91%、-33.29%、-25.97%和50.00%,对原水中TCs 的平均去除率为18.78%。曝气池对经过沼气池处理的废水中CTC、DOX、OTC 和TC 的去除率分别为100%、99.90%、98.45%和99.93%,对沼液中TCs 的平均去除率为98.87%。沼气池对TCs 的去除率低于曝气池,好氧处理阶段对TCs的去除率高于厌氧处理阶段,这与周婧等[23]和靳红梅等[28]的研究结果一致。一般抗生素的生物降解依赖于氧分子的存在,曝气池处理废水过程中,由于氧分子增加,抗生素可能发生水解、光解和微生物降解等一种或者多种降解反应[29]。
猪场废水处理系统(沼气池+曝气池)对原水中CIP、ENR 和OFX 的去除率分别为99.99%、99.99%和100%,对原水中QLs 的平均去除率为99.99%。沼气池+曝气池对原水中SDZ、SM2 和SMM 去除率分别为86.01%、90.17%和99.88%,对原水中SAs 的平均去除率为99.49%。沼气池+曝气池对原水中CTC、DOX、OTC 和TC 的去除率分别为100%、99.86%、98.05%和99.97%,对原水中TCs的平均去除率为99.08%。
综上所述,沼气池对QLs、SAs 和TCs 的平均去除率分别为91.95%、96.47%和18.78%,曝气池的平均去除率则分别为99.93%、85.47%和98.87%。而沼气池+曝气池组合对原水中QLs、SAs 和TCs 的平均去除率分别达到99.99%、99.49%和99.08%,去除效果均优于单项处理设施。由此可见,厌氧与好氧处理可对不同类型抗生素提供适于其降解的条件和环境,组合使用能够提升废水中抗生素的综合去除效果[23]。
2.4 抗生素排放量
经曝气池处理后的废水通过水产养殖和农田灌溉进入水体和土壤环境,对周边环境造成影响。该猪场通过曝气池排水排放抗生素的量见表3。
猪场通过经处理的废水向水体和土壤排放的单体抗生素平均在0.53~17 712.30 mg·d-1之间,抗生素总排放量为19 116.15 mg·d-1,单头猪抗生素总排放量为910.29 μg·d-1·pig-1。单头猪的4 类抗生素日均排 放 量 大 小 依 次TCs、SAs、QLs 和MAs,分 别 为857.82、52.20、0.25 μg·d-1·pig-1和0.03 μg·d-1·pig-1。猪场废水向环境排放的抗生素以TCs最大,单体抗生素以OTC 最大,占单头猪抗生素总排放量的92.7%,这与魏瑞成等[24]的研究结果相一致。抗生素的排放主要与养猪规模、饲养方式、抗生素使用[10]和处理工艺效果有关。饲料又是该规模养猪场养殖废水中抗生素的主要来源。

表3 猪场通过废水向环境排放抗生素的量Table 3 Amount of antibiotics discharged into the environment by piggery wastewater
2.5 曝气池排水及鱼塘水抗生素的风险评估
该猪场原水虽经处理,但处理后废水中仍然含有相当浓度的抗生素,残留的抗生素通过农田灌溉和水产养殖等进入环境中,从而对排放环境中的生物造成潜在的危害。风险商值法常用于药物的生态风险评价,本文用此法评估猪场曝气池排水和鱼塘水中抗生素对环境的生态风险。曝气池排水和鱼塘水中残留抗生素的PENC和EC50见表4,风险商值见图3和图4。
猪场曝气池排水中CIP 的RQ 处于低风险,ETM、SDZ、SMM 和DOX 处于中等风险,ENR、SM2、OTC 和TC 处于高风险,其中OTC 和TC 的RQ 分别高达366.9和68.8,说明猪场原水经厌氧和好气设施处理后的废水中抗生素对环境仍有较高的生态风险。这与陈乾等[25]研究规模奶牛场的处理废水有较高生态风险的结论基本一致。鱼塘水中ETM、SM2、SMM、DOX、OTC 和TC 处于中等风险,SDZ 处于高风险。曝气池排水用于农田灌溉会导致抗生素大量进入农田,造成土壤抗生素污染,进而被农作物吸收积累[30],而在抗生素高风险的水中从事水产养殖,会对环境及水生动、植物造成一定伤害[31],且最终通过食物链影响人类健康。本研究结果表明养猪场经处理的废水用于灌溉和养殖时均存在抗生素生态风险,但对于食物链的具体风险性评价还有待于进一步的研究。
3 结论
(1)MAs 在原水中未检出,在不同处理阶段平均浓度在0.01~0.02 μg·L-1之间。QLs、SAs 和TCs 浓度均为原水>沼液>曝气池排水>鱼塘水。原水、沼液和曝气池排水中抗生素均以TCs为主,占检出抗生素的87.7%~99.2%,鱼塘水中SAs占比最高为70.4%。
(2)沼气池对原水中QLs 和SAs 的去除率高于曝气池对沼液的去除率,对TCs的去除率低于曝气池。

表4 曝气池排水和鱼塘水中残留抗生素的半效应浓度和无效应浓度Table 4 Half effect concentration and ineffective concentration of 12 antibiotics
(3)该规模化养猪场通过废水排放的抗生素量为910.29 μg·d-1·pig-1,4 类抗生素日均排放量大小依次为TCs、SAs、QLs 和MAs,单体抗生素排放量在0.03~843.44 μg·d-1·pig-1之 间,排 放 量 由 大 到 小 依 次 为OTC、SM2、TC、SMM、DOX、ENR、SDZ、CIP 和ETM,其中OTC占抗生素总排放量的92.7%。
(4)ENR、SM2、OTC 和TC 为曝气池排水中的高风险污染物,ETM、SDZ、SMM 和DOX 为中等风险,CIP 为低风险污染物。接纳经处理的部分废水的鱼塘水中SDZ 为高风险污染物,ETM、SM2、SMM、DOX、OTC 和TC 为中等风险污染物。规模化养猪场经处理后废水和接纳部分废水的鱼塘水中抗生素对环境仍有较高的生态风险。
