生物炭基硫酸盐还原菌(SRB)对Cr(Ⅵ)的吸附效应及作用机制
2021-05-25朱晓丽李雪寇志健王军强尚小清陈超
朱晓丽,李雪,寇志健,王军强,,尚小清,,陈超
(1.西北大学城市与环境学院,西安710127;2.西安金博瑞生态科技有限公司,西安710065)
随着人口增长和城市化、工业化进程的加速,重金属废水导致的污染日趋严重。铬及其化合物广泛应用于冶金、电镀、制革、印染等行业,含铬废水的不合理排放和铬渣的随意堆放,导致水体和土壤中的铬严重超标[1]。铬在水体中主要以Cr(Ⅲ)和Cr(Ⅵ)两种形态存在。其中,Cr(Ⅵ)是一种急性致癌物质,迁移性和毒性远高于Cr(Ⅲ)。对人体而言,Cr(Ⅵ)的毒性比Cr(Ⅲ)高100倍,其危害主要包括皮肤及呼吸系统溃疡、引起脑膜炎和肺癌等[2-3]。
美国环保署、世界卫生组织《饮用水水质标准》和我国《饮用净水水质标准》都规定饮用水中Cr(Ⅵ)含量标准为≤0.05 mg·L-1,我国水质标准中规定地表水中Cr(Ⅵ)浓度≤0.15 mg·L-1,排放废水中Cr(Ⅵ)和总铬最大允许排放浓度分别为0.05 mg·L-1和0.15 mg·L-1[4]。2009 年湖南娄底双峰县的铬污染饮用井水事件和2011年云南曲靖癌症村铬污染水体等事件,严重影响了当地的饮用水安全。因此,去除水中的铬,尤其是Cr(Ⅵ),对保护公众健康和生态环境具有重要意义。
目前,国内外对于含铬废水的处理方法主要包括物理法、化学法、物理化学法及生物法。生物固定化方法以其稳定性好、易于实现连续化、反应性好和处理效率高等优点,得到国内外学者的广泛关注[5]。微生物能够使水中高毒、易溶于水的Cr(Ⅵ)还原成低毒、易于沉淀的Cr(OH)3。朱文杰[6]在2008年,分离筛选出一株Cr(Ⅵ)还原白色杆菌(Leucobacter sp.CRB1),其生长细胞对Cr(Ⅵ)在38 h内的最大还原量为1 820 mg·L-1。韩怀芬等[7]将土壤杆菌、假单胞菌和芽孢杆菌等5 种能够还原Cr(Ⅵ)的细菌混合后对Cr(Ⅵ)的还原率最高达100%。
硫酸盐还原菌(Sulfate reducing bacteria,SRB)是一类能够将硫酸盐或者其他氧化态硫化物还原为H2S 的微生物,属于兼性厌氧细菌,广泛存在但不局限于缺氧环境中,可通过代谢产物S2-与重金属反应,并将重金属转化为稳定的金属硫化物[8]。近年来,利用不同载体固定化微生物处理重金属污染已经成为研究热点之一。生物炭能够通过离子交换、静电吸附、表面沉淀和络合作用钝化重金属,而且其丰富的多孔结构能够对微生物生长起到保护作用,为接种菌株提供良好的生存环境,有利于接种的微生物更好地生长,使其在复杂环境中依然能稳定发挥高效的性能[9]。因此,采用生物炭作为微生物生长的载体受到广泛关注。张杰等[10]研究了生物炭固定化解磷菌对铅的吸附特性,发现生物炭固定化解磷菌对铅的最高吸附量可达89.39 mg·g-1。李猛等[1]采用海藻酸钠包埋SRB 处理低浓度含铬废水,当水中铬含量为1 mg·L-1时,其去除率为92%。生物炭固定化SRB 作为一种绿色经济材料,有一定的应用前景。
本研究以小麦、玉米、水稻秸秆生物炭为载体,采用具有耐受铬生长能力的SRB 作为接种菌株制备固定化菌剂,研究不同生物炭制备的固定化菌剂对Cr(Ⅵ)的吸附效应,筛选出最优组合,并通过对其理化性质、吸附效应影响因素、吸附动力学及等温吸附模型的分析,探讨生物炭基SRB 对Cr(Ⅵ)的吸附过程和机理,以期为铬污染废水及土壤修复提供一定的实验依据。
1 材料与方法
1.1 实验材料
1.1.1 供试菌株
以实验室从陕西某铬渣污染植物根际土中筛选的1株高效硫酸盐还原菌SRB6-2-1为固定化供试菌种,该菌株能够耐受600 mg·L-1的Cr(Ⅵ)生长[11],基于16S rDNA 序列测定,SRB6-2-1 经鉴定属于Entero⁃bacter sp.。菌株在-80 ℃超低温冰箱冻存。
1.1.2 生物炭原料
选择小麦、玉米、水稻秸秆作为生物炭原料。3种秸秆均采自陕西省西安市长安区周边农村。将采集的秸秆用蒸馏水冲洗干净,80 ℃烘干至恒质量,采用粉碎机粉碎并过200目筛,用自封袋干燥保存。
1.1.3 培养基
(1)LB培养基:胰蛋白胨10 g,酵母浸粉5 g,NaCl 10 g,蒸馏水1 000 mL,pH 6.8~7.0,121 ℃灭菌20 min。
(2)生物炭基SRB 培养基:蔗糖10 g,牛肉膏6 g,酵母浸膏1.5 g,蒸馏水1 000 mL,pH 7.0~7.4,121 ℃灭菌20 min。
(3)SRB 培养基:K2HPO40.5 g,(NH4)2SO42.5 g,NaHCO30.5 g,CaCl20.2 g,MgSO41.0 g,乳酸钠2.0 mL,酵母膏1.5 g,半胱氨酸盐0.5 g,蒸馏水1 000 mL,pH 7.0~7.2,121 ℃灭菌20 min;半胱氨酸盐应过滤灭菌。
1.2 实验方法
1.2.1 生物炭的制备及表征
分别称取200 g 小麦、玉米、水稻秸秆粉,放置在马弗炉内,通入氮气,采用限氧控温炭化法[11],分别设置终温为300、500 ℃和700 ℃,每分钟增温10 ℃,达到终温后继续炭化2 h,待温度降至室温后取出,称质量,计算炭化产率,并转入自封袋,分别标记为XM300、XM500、XM700、YM300、YM500、YM700、DC300、DC500、DC700(其中XM、YM、DC 分别代表小麦、玉米、水稻,300、500、700 代表终温),干燥保存,备用。
采用溴化钾压片法对生物炭进行傅里叶红外光谱(FTIR,EQUINOX-55)表征;使用扫描电镜(SEM,Zeiss-EVO18r)进行表面形貌分析;采用比表面积测试仪(BET,NOVA4200E)进行比表面积测定。
1.2.2 生物炭基菌剂的制备与筛选
分别取0.6 g 不同类型的生物炭加入到50 mL 固定化培养基中,121 ℃灭菌30 min,接入2%(体积比)SRB6-2-1,在28 ℃、150 r·min-1条件下的摇床里培养18 h 后取出,以8 000 r·min-1离心10 min 后,收集沉淀,用1%(m/V)的无菌生理盐水洗涤,离心,重复洗涤3 次后离心所得固体即为固定化菌剂,分别标记为IBXM300、IBXM500、IBXM700、IBYM300、IBYM500、IBYM700、IBDC300、IBDC500、IBDC700( 例 如,IBXM300表示使用XM300制备的固体化菌剂)。
将制备好的9 种固定化菌剂,分别加入到50 mL浓度为400 mg·L-1的Cr(Ⅵ)溶液中,放置在28 ℃、120 r·min-1的摇床中恒温振荡,每隔20 h 取一次样,样品在8 000 r·min-1下离心10 min,收集上清液,并用0.45 μm 微孔滤膜过滤,采用火焰原子吸收光谱仪(AAS,Thermo iCE3000 SERIES)测定滤液中Cr(Ⅵ)浓度。每个实验均设3组平行。
1.2.3 Cr(Ⅵ)的吸附实验
(1)生物炭添加量对Cr(Ⅵ)吸附的影响
分别将含0、0.2、0.4、0.6、0.8 g 和1.0 g 小麦秸秆生物炭的IBXM700 加入到50 mL 400 mg·L-1Cr(Ⅵ)溶液中,在28 ℃、120 r·min-1的摇床里振荡培养24 h,随后取混合液,在8 000 r·min-1下离心10 min,收集上清液,并用0.45 μm 微孔滤膜过滤,采用火焰原子吸收光谱仪测定滤液中Cr(Ⅵ)浓度。每个实验均设3组平行。
(2)pH对Cr(Ⅵ)吸附的影响
取0.6 g IBXM700 到锥形瓶中,加入50 mL 浓度为400 mg·L-1的Cr(Ⅵ)溶液,分别调节pH 到4、5、6、7、8、9,然后振荡、离心、过滤并测定Cr(Ⅵ)浓度(步骤同上)。
(3)IBXM700对Cr(Ⅵ)的吸附动力学
取0.6 g IBXM700 加入到含400 mg·L-1Cr(Ⅵ)溶液的锥形瓶中,28 ℃,120 r·min-1恒温振荡,分别在0、2、4、8、18、24、30、42、54、66 h 和90 h 取样。于8 000 r·min-1离心10 min,上清液过0.45 μm微孔滤膜,采用火焰原子吸收光谱仪测定滤液中Cr(Ⅵ)浓度,研究其动力学特征。
(4)IBXM700对Cr(Ⅵ)的等温吸附
取0.6 g IBXM700 加入到含50 mL 不同浓度(100、200、300、400、500 mg·L-1和600 mg·L-1)Cr(Ⅵ)溶液的锥形瓶中,28 ℃、120 r·min-1恒温振荡24 h,取样,并在8 000 r·min-1离心10 min,上清液过0.45 μm微孔滤膜,采用火焰原子吸收光谱仪测定滤液中Cr(Ⅵ)浓度,计算其等温吸附量。
1.2.4 IBXM700对Cr(Ⅵ)的去除机理
(1)SRB6-2-1对Cr(Ⅵ)的去除量
将2% SRB6-2-1 接入到含400 mg·L-1Cr(Ⅵ)的50 mL SRB 培养基中,28 ℃培养24 h,每隔4 h 取样,8 000 r·min-1离心10 min,收集上清液,采用火焰原子吸收光谱仪测定Cr(Ⅵ)浓度,计算Cr(Ⅵ)去除量。
(2)SRB6-2-1产生H2S还原Cr(Ⅵ)
将2%SRB6-2-1接入到50 mL的SRB培养基中,28 ℃培养24 h,8 000 r·min-1离心10 min,收集上清液,将Cr(Ⅵ)溶液加入到上清液中,使其最终浓度为400 mg·L-1,28 ℃、120 r·min-1恒温振荡28 h,每隔4 h取样,其余步骤同(1)。
(3)SRB6-2-1细胞还原酶还原Cr(Ⅵ)[11]
将2% SRB6-2-1 接入到50 mL 灭菌后的SRB 培养基中,28 ℃培养24 h,8 000 r·min-1离心10 min,收集菌体,用50 mL 浓度为2.5 g·L-1的NaHCO3缓冲溶液冲洗一次,并重悬于该缓冲液中,加入Cr(Ⅵ)溶液,使其最终浓度为400 mg·L-1,28 ℃、120 r·min-1恒温振荡28 h,每隔4 h取样,其余步骤同(1)。
(4)SRB6-2-1胞外聚合物对Cr(Ⅵ)的吸附[11]
与步骤(3)相同,收集到菌体后,加入50 mL 的NaCl(0.9%),洗涤3 次后,重新悬浮于该溶液中,用NaOH 溶液调节pH 为11,慢速(100 r·min-1)搅拌10 min 后,滤膜过滤,得到胞外聚合物,随后向聚合物中加入50 mL 400 mg·L-1Cr(Ⅵ)溶液,28 ℃、120 r·min-1恒温振荡28 h,每隔4 h取样,其余步骤同(1)。
(5)IBXM700处理Cr(Ⅵ)前后的结构表征
取0.6 g IBXM700 加入到灭菌后含400 mg·L-1Cr(Ⅵ)的50 mL SRB 培养基中,恒温培养24 h,8 000 r·min-1下离心10 min,收集菌体,进行SEM分析[12]。
1.3 数据处理
采用Excel 2010进行数据处理,利用SPSS 19.0软件的单因素方差分析(One-way ANOVA)及多重比较分析(LSD)对不同处理间差异显著性进行比较,并通过Origin 2017软件绘图。
2 结果与讨论
2.1 固定化SRB生物炭基载体的筛选
2.1.1 生物炭的理化性质
生物炭的理化性质如表1 所示,随热解温度的上升,3 种生物炭产率均呈下降趋势,这是因为在热裂解过程中,随着温度升高,有机质逐渐降解,灰分逐渐增加[13]。秸秆炭化过程中,其表面含氧官能团如—OH、羧酸的C=O 等会随着裂解温度的升高而消失,脂肪性官能团会随热解温度提升逐渐分解[14],导致生物炭整体呈碱性,且随着裂解温度升高,pH 逐渐上升。3种生物炭比表面积随温度升高逐渐增大。700 ℃下的小麦秸秆生物炭比表面积最大,为101.441 m2·g-1,这有利于富集污染物,促使污染物向生物炭聚集,提高微生物与污染物的接触几率,增加微生物对Cr(Ⅵ)的去除能力[13-16]。
2.1.2 生物炭的FTIR分析
FTIR 显示(图1),3 种生物炭特征吸收峰基本相同,说明其表面官能团的种类基本相同,但是高温生物炭(700 ℃)较低温生物炭官能团种类减少。官能团区:位于3 184~3 219 cm-1的宽吸收峰来自羟基的—OH 伸缩振动,随着温度升高,此处的吸收峰减弱,其原因可能是随着热解温度上升,与氢键缔合的—OH 逐渐断裂[17]。双键伸缩振动区:图2a 中1 868 cm-1处的吸收峰为芳环C=C 键的面内变形振动产生;1 540~1 646 cm-1之间的吸收峰由羧基、羰基、酯基的C=O 和芳环的C—C 骨架伸缩振动产生[18-19],在波数1 640 cm-1和1 646 cm-1处的吸收峰为C=O 键伸缩振动产生,由图1可知,高热解温度下(≥500 ℃),C=O 键吸收峰逐渐减弱直至消失,其原因在于C=O键较易被热解为CO 和CO2,芳香性增强[20]。指纹区:由图1a 可知,波数1 374 cm-1处的吸收峰为烷烃—CH3伸缩振动引起,随着热解温度升高,吸收峰逐渐消失,表明高热解温度下,烷烃基团被分解。1 030、1 037、1 080、1 081 cm-1和1 107 cm-1处的吸收峰为C—O键伸缩振动特征峰,热解温度增高后,这些吸收峰逐渐减弱消失,其原因在于纤维素和半纤维素在高温下被分解,提高了生物炭的芳香度[21]。950、976 cm-1和977 cm-1处为C=C 键的变形振动吸收波峰,668~780 cm-1之间的吸收峰是芳烃的C—H 面外弯曲振动造成的,结合之前1 500~1 600 cm-1处芳环的C—C 骨架伸缩振动吸收峰,表明秸秆生物炭产生芳香环结构,并且随着温度升高,其芳香程度增加。由图1 可知,小麦秸秆生物炭的官能团种类更丰富,芳香程度较其他两种生物炭更高。
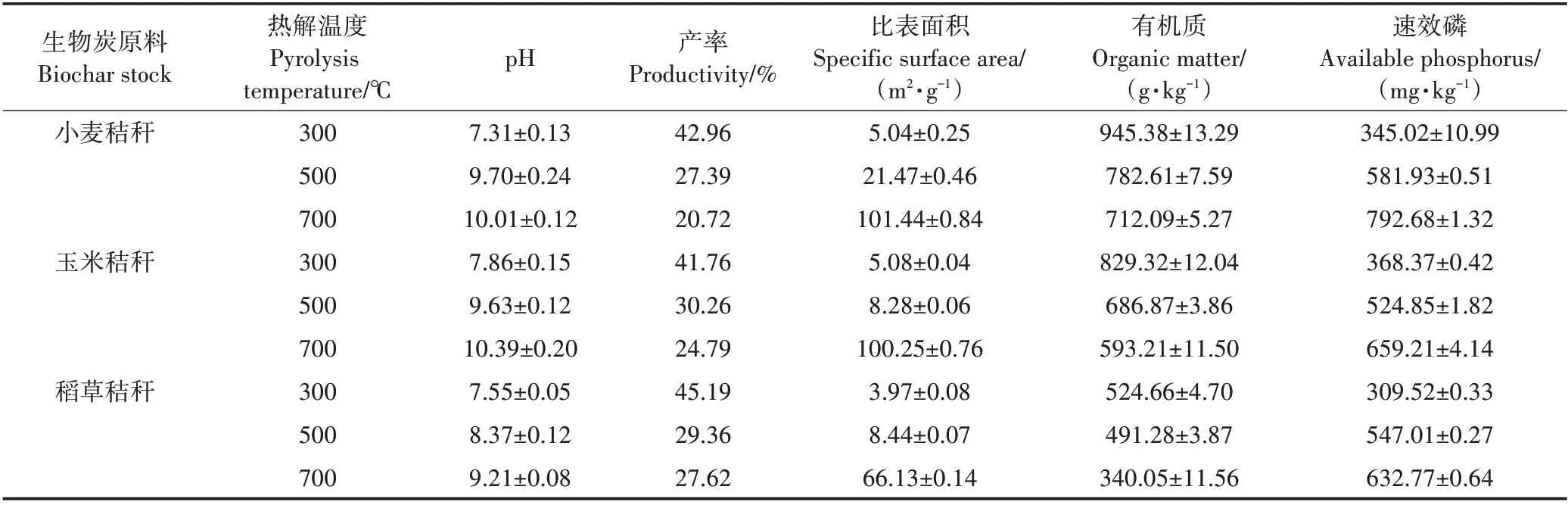
表1 生物炭的理化性质Table 1 Physical and chemical properties of biochars
2.1.3 SEM分析
小麦秸秆生物炭的扫描电镜图见图2。从图可以看出,XM300 的孔状结构不明显,XM500 已经有排列规则清晰的孔状结构,XM700 的孔壁变薄、孔隙变大、孔状结构变多,表明700 ℃制备的小麦秸秆生物炭孔隙结构更加发达,比表面积更大,这也与表1 中的比表面积数据相一致。随着热解温度升高,比表面积逐渐变大,发达的孔隙结构也有助于微生物附着和污染物吸附[21]。
从图3 可以看出,在生物炭的孔隙和表面都分布了大量菌体,说明SRB 在生物炭载体上生长良好,生物炭有利于微生物的生长繁殖[22]。
2.1.4 生物炭基菌体载体的筛选
不同生物炭基SRB 对Cr(Ⅵ)的吸附效果如图4所示,结果表明:随着时间增加,生物炭基固定化菌剂对Cr(Ⅵ)的吸附量显著高于游离SRB;其中IBXM700对Cr(Ⅵ)的去除量最大,达到286.54 mg·g-1,分别比游 离SRB、IBYM700 和IBDC700 提 高 了138.47%,21.12%和36.35%,其原因可能是小麦秸秆生物炭(XM700)的比表面积更大,芳香化程度高,营养元素丰富,使其静电吸附、表面络合、阳离子-π、离子交换、还原等作用更强。综合考虑,XM700 为最佳载体,且IBXM700 对Cr(Ⅵ)的去除量最佳,因此选择IBXM700进行后续实验。
2.2 生物炭基菌剂吸附影响因素
2.2.1 生物炭添加量对IBXM700吸附Cr(Ⅵ)的影响
以秸秆为材料,热解温度700 ℃时,添加不同质量的生物炭制备固定化菌剂,以考察其对污染物吸附性能的影响。结果如图5所示。
由图可知,污染物去除率随生物炭添加量的增加,呈现先增大后下降的趋势。当添加量从0 增加到0.6 g 时,Cr(Ⅵ)去除率从19.64%增加至74.47%,而随着添加量的进一步增加,Cr(Ⅵ)去除率呈下降趋势,因此,生物炭的最佳添加量为0.6 g。分析原因可能是:生物炭添加量过少,微生物生长密度较小,从而降低了菌剂对重金属的吸附性能;而生物炭添加量过大,由于生物炭表面官能团会使溶液pH 逐渐增大至碱性,从而会影响微生物的正常生长,导致Cr(Ⅵ)去除率下降。
2.2.2 pH对IBXM700吸附Cr(Ⅵ)的影响
如图6 所示,随着pH 的增加,IBXM700 对Cr(Ⅵ)的吸附量呈现缓慢升高再下降的趋势,pH 为4~6 时,吸附量先缓慢增加再减小,但是变化幅度较小;pH 为6~8 时,吸附量逐渐减小,特别是当溶液呈碱性时,吸附量显著降低,pH 为8~9 时,吸附量缓慢增加,但明显低于pH 为4~6 时的吸附量。溶液pH 为5 时,达到最大吸附量231.58 mg·g-1。
对于Cr(Ⅵ)阴离子基团,pH<7 时,OH-与重金属阴离子Cr(Ⅵ)竞争吸附位点能力较弱,当pH>7 时,溶液中OH-浓度增加,OH-与Cr(Ⅵ)竞争吸附位点的能力增强,导致吸附能力下降,另一个原因可能是溶液碱性环境对IBXM700的生长繁殖具有抑制作用[22]。
2.3 吸附动力学
采用拟一级动力学方程(PF-order)、拟二级动力学方程(PS-order)、颗粒内扩散模型(IPD)对实验结果进行吸附动力拟合,方程如下[23]:
式中:Qe为平衡吸附量,mg·g-1;k1(h-1)、k2(g·mg-1·h-1)分别是拟一级、拟二级动力学方程的速率常数;kp为颗粒内扩散模型速率常数,mg·g-1·h-0.5;C 是与边界层厚度相关的常数,mg·g-1。
IBXM700 对Cr(Ⅵ)的吸附量随时间变化情况及动力学拟合曲线如图7 所示。IBXM700 对Cr(Ⅵ)的吸附量在初期迅速增加,然后增速变缓,直至达到平衡。因此,可以将此过程分为快吸附和慢吸附两个阶段。由图可知,0~8 h为快吸附阶段,吸附量为饱和吸附量的69.6%,8~24 h 为慢吸附阶段,在24 h 时的吸附基本达到平衡状态。因此,本实验IBXM700 对Cr(Ⅵ)的吸附平衡时间为24 h。由表2 可知,IBXM700 吸附Cr(Ⅵ)的拟一级动力学方程模型和拟二级动力学方程模型的R2分别为0.964和0.986,均大于0.9。此外,拟一级动力学方程所得到的理论平衡吸附量Qe(277.35 mg·g-1)相比于拟二级动力学方程(303.74 mg·g-1)更加接近实验吸附量(279.02 mg·g-1)。因此,拟一级动力学方程能更好地描述IBXM700 吸附Cr(Ⅵ)的动力学过程。
由表2可知,Cr(Ⅵ)的颗粒内扩散模型R2<0.9,因此,吸附过程不符合颗粒内扩散模型。其原因可能是在实验吸附过程中,液相膜扩散吸附和表面吸附起主导作用。由于生物炭基SRB 表面含氧官能团和SRB所产生的S2-与重金属离子发生还原反应,使得重金属离子不容易进入生物炭基SRB 内部[24]。其吸附可分为3 个阶段:(1)Cr(Ⅵ)通过液膜扩散附着在生物炭基SRB 表面;(2)Cr(Ⅵ)吸附在菌剂表面的吸附位点;(3)Cr(Ⅵ)与生物炭基SRB 表面的产物发生吸附反应,有足够多的吸附位点结合,不容易扩散到菌剂内部。
2.4 吸附等温线
图8 为IBXM700 在不同初始Cr(Ⅵ)浓度下的吸附率曲线,随着初始Cr(Ⅵ)浓度上升,IBXM700 的吸附量显著增加。在Cr(Ⅵ)浓度为100 mg·L-1时,吸附率最大为84.34%。
用Freundlich(公式4)和Langmuir(公式5)等温模型对实验结果进行拟合,公式如下:

表2 拟一级动力学方程、拟二级动力学方程、颗粒内扩散模型的拟合参数Table 2 Fitting parameters of quasi first-order dynamic equation,quasi second-order dynamic equation and intra particle diffusion model
式中:Qe和Qm为菌剂达到吸附平衡和最大时的Cr(Ⅵ)吸附量,mg·g-1;C0和Ce为初始及平衡浓度,mg·L-1;KL为Langmuir 常数,L·mg-1;RL为平衡常数,判断反应是否可行;KF[(mg·g-1)(L·mg-1)1/n]和n均为Freundlich 常数。
吸附等温线如图9 所示,拟合参数见表3。可以看出,Langmuir 模型的R2(0.978)大于Freundlich 模型(0.940),表明IBXM700 对Cr(Ⅵ)的吸附过程近似单分子层吸附,由Langmuir 模型计算得出Qm值为485.89 mg·g-1。RL是表示吸附剂亲和力的一个常数[4],当0
2.5 IBXM700对Cr(Ⅵ)的去除机理
图10为SRB6-2-1产生H2S及还原酶还原Cr(Ⅵ),细胞外聚合物吸附Cr(Ⅵ)。由图可知,H2S 和还原酶的还原作用为Cr(Ⅵ)的主要去除机理,SRB6-2-1 能将SO2-4还原为S2-而生成H2S,S2-和H2S 能还原Cr(Ⅵ)为Cr(Ⅲ),降低其毒性,从而达到去除目的。除此之外,SRB6-2-1 也能分泌一些还原酶来还原Cr(Ⅵ),其作用机理为,细胞膜上的还原酶将氧化还原辅酶NADH 中的电子供给Cr(Ⅵ),将其还原[11]。在4 h 以内,H2S 与Cr(Ⅵ)的作用很快达到平衡,随着时间增加,还原量变化较小,表明S2-与Cr(Ⅵ)之间作用为化学反应。细胞外聚合物对Cr(Ⅵ)的吸附去除量特别小,其原因在于Cr(Ⅵ)以阴离子基团存在[25],而胞外聚合物通常均带负电荷,因此吸附量极低[11]。
图11 为XM700 和IBXM700 对Cr(Ⅵ)的去除量,由图可知,XM700 对溶液中Cr(Ⅵ)的最高去除量为255.68 mg·g-1,约在4 h 内达到平衡,而IBXM700 约在24 h 内达到平衡,其原因在于SRB6-2-1 在生物炭上的生长需要一定的时间[25-27]。此外,IBXM700 在未达到平衡之前,对Cr(Ⅵ)的去除量略低XM700,其原因可能是SRB6-2-1 覆盖了部分生物炭吸附点位,随着时间增加,IBXM700 的最高去除量达到286.54 mg·g-1,分别比游离SRB6-2-1 和XM700 高166.3 mg·g-1和30.86 mg·g-1,其原因可能为:(1)IBXM700具备了生物炭和SRB6-2-1去除Cr(Ⅵ)的双重功能;(2)生物炭增强了SRB6-2-1 耐受高浓度Cr(Ⅵ)的生长能力,另外,生物炭能够为微生物提供营养物质和良好的生长环境,与游离菌相比,IBXM700具有更高的繁殖率[8-11]。因此,IBXM700具有较高的Cr(Ⅵ)去除能力[28]。
3 结论
(1)不同生物炭基SRB 中,IBXM700 对Cr(Ⅵ)的吸附性能最好。

表3 Langmuir和Freundlich吸附等温线拟合参数Table 3 Fitting parameters of Langmuir and Freundlich adsorption isotherms
(2)IBXM700对Cr(Ⅵ)的最佳吸附条件为:pH 5,生物炭添加量0.6 g·100 mL-1,吸附时间24 h,Cr(Ⅵ)初始浓度100 mg·L-1。
(3)IBXM700 吸附Cr(Ⅵ)符合拟二级动力学方程,但更符合拟一级动力学方程,而对内扩散模型拟合效果不好,表明该过程是以表面吸附为主,化学作用为辅。吸附过程可以很好地被Langmuir模型拟合,是单分子层吸附。
(4)SRB6-2-1 通过还原SO2-4为S2-或分泌一些还原酶将Cr(Ⅵ)还原为Cr(Ⅲ),从而达到去除目的,因此IBXM700 去除Cr(Ⅵ)的机制主要为吸附作用与还原作用。
