阿司匹林对结直肠癌化学预防作用的新进展
2021-05-25郎吉萍戴秋月吕萍潘杭雨郭志刚
郎吉萍,戴秋月,吕萍,潘杭雨,郭志刚
南方医科大学南方医院心血管内科,广东广州510515
结直肠癌(CRC)是常见的消化道恶性肿瘤,发病率在全球恶性肿瘤中位居第3位,死亡率位居第2位。据估计,2018年全世界有超过180万新发的CRC病例[1-2]。近年来我国CRC的发病率呈逐年上升趋势[3]。虽然靶向药物、免疫检查点抑制剂的研发使癌症治疗取得了很大进展,但其不良反应及治疗费用仍然是一个主要问题。化学预防作为降低癌症死亡率更经济有效的策略,正受到越来越多的关注。“化学预防”是指用合成或天然物质来降低患癌风险,推迟癌症的发病时间,或逆转致癌过程。阿司匹林是目前最具前景的CRC化学预防药物。
1 阿司匹林化学预防作用的循证医学证据
阿司匹林(乙酰水杨酸)不仅被广泛用于急性冠脉综合征、冠状动脉支架植入术和冠状动脉旁路移植术的术后二级预防等领域,其在CRC防治领域中的地位也越来越重要。2016年,美国预防服务工作组发表了阿司匹林用于心血管疾病和CRC一级预防的推荐声明,其采用美国心脏病协会/美国心脏协会提出的风险计算方法来预测10年动脉粥样硬化性心血管病事件风险,推荐10年心血管风险≥10%且无出血风险增加的50~69岁人群可服用低剂量阿司匹林来预防CRC[4]。2017年美国国立综合癌症网络发布的CRC临床实践指南也推荐阿司匹林用于CRC根治术后的“辅助治疗”,以达到肿瘤二级预防的目的。
1.1 阿司匹林对结肠腺瘤的化学预防作用
降低息肉或腺瘤负担一直被认为是预防CRC的一个重要终点。研究发现约有85%的CRC是由进展期腺瘤发展而来的,由腺瘤到恶性肿瘤的转变需要10~20年,而腺瘤切除降低了CRC的风险[5-6]。因此,大量研究将阿司匹林对结直肠腺瘤的预防作用作为预防CRC的替代疗效指标[7-8]。其中AFPPS[9]、APACC[10]、CALGB[11]和ukCAP[12]的研究成果具有重要意义,其结果发现阿司匹林能够使结直肠腺瘤复发风险降低4%~39%。
AFPPS[9]研究共纳入1121例有结直肠腺瘤病史的患者,分别给予安慰剂、低剂量阿司匹林(81 mg/d)和高剂量阿司匹林(325 mg/d),发现低剂量阿司匹林组的腺瘤复发风险明显低于安慰剂组(HR=0.81,95%CI:0.69~0.96),进展期腺瘤或肿瘤发生风险下降更为显著(HR=0.59,95%CI:0.38~0.92)。但高剂量阿司匹林组与安慰剂组在结直肠腺瘤复发率上无显著差异,研究也未对这一结果提出合理的解释。APACC[10]研究发现服用阿司匹林1年后的患者发生3个及以上腺瘤和至少1个>5 mm的腺瘤的风险降低。CALGB[11]研究纳入635例CRC根治术后患者,试验组给予阿司匹林325 mg/d,结果显示试验组的平均复发结直肠腺瘤数量相比于安慰剂组明显减少(0.30±0.87vs0.49±0.99,P=0.003),腺瘤复发率明显低于安慰剂组(17%vs27%,P=0.004)。ukCAP[12]研究表明,阿司匹林降低了腺瘤的风险(HR=0.79,95%CI:0.63~0.99)和进展期腺瘤的风险(HR=0.63,95%CI:0.43~0.91)。
其他研究也观察到了类似的结果,并得到荟萃分析的支持[13-14]。对4个随机、双盲、安慰剂对照试验进行的荟萃分析评估了阿司匹林(75~325 mg/d)预防大肠腺瘤复发的有效性和安全性,其中包括2967名既往有大肠腺瘤或大肠癌病史的患者,综合分析发现,与服用安慰剂的患者相比,服用任何剂量阿司匹林的患者腺瘤复发的相对风险降低了17%(RR=0.83,95%CI:0.72~0.96),晚期病变的相对风险降低了28%(RR=0.72,95%CI:0.57~0.90)。此外,近期一项随机对照临床试验发现虽然口服300 mg/d的阿司匹林1年后结直肠腺瘤复发率并未降低,但平均复发腺瘤数量却显著减少,表明阿司匹林对复发性结直肠腺瘤具有预防作用[15-16]。
1.2 阿司匹林对CRC的化学预防作用
最早报道阿司匹林与CRC风险之间的负相关是在1988年的一项病例对照研究中。这项研究发现服用阿司匹林或含阿司匹林药物的患者CRC风险降低47%(RR=0.53,95%CI:0.40~0.71,P<0.001)[17]。随后许多前瞻性队列或病例对照研究证实了阿司匹林长期治疗对降低CRC发病率的作用。一项关于癌症发病率和死亡率的大型前瞻性研究(n=146 113)发现,长期每日使用阿司匹林(≥5年)与CRC发病率显著降低有关(RR=0.68,95%CI:0.52~0.90)[18];一项基于丹麦人群的大型病例对照研究(10 280例CRC病例和102 800例对照)报道,连续服用小剂量阿司匹林超过5 年的患者患CRC 的风险显著降低(OR=0.73,95%CI:0.54~0.99)[19]。Cao等[20]基于2项大型前瞻性美国队列研究,评估了阿司匹林预防癌症的潜在益处。在他们的联合队列分析中,定期服用阿司匹林可使总体癌症风险降低约3%(n=135 965,RR=0.97,95%CI:0.94~0.99)。重要的是,这一下降主要是由于胃肠道癌症风险显著降低了15%(RR=0.85,95%CI:0.80~0.91),特别是大肠癌(RR=0.81,95%CI:0.75~0.88)。研究发现每周服用50~150 mg阿司匹林超过5年,才能观察到阿司匹林对胃肠道癌症明显的保护作用[20]。研究还表明,无论患者是否接受了内窥镜筛查,阿司匹林都可能有绝对的益处。在没有接受内镜检查的受试者中,定期使用阿司匹林可预防33例大肠癌/10万人年(PAR=17.0%);在接受内镜检查的受试者中可预防18例大肠癌/10万人年(PAR=8.5%)[20]。
评估阿司匹林预防心血管疾病疗效和安全性的随机对照试验的后期分析也为阿司匹林在降低CRC发病率方面的作用提供了令人信服的证据。女性健康研究是一项关于隔日服用阿司匹林(100 mg)与安慰剂的随机、安慰剂对照试验[21]。其在10年的随访期内未发现CRC 发病率有任何降低(RR=1.03,95%CI:0.83-1.28)。然而,在随访分析延长至18年时,观察到阿司匹林组CRC 发生率显著降低42%(RR=0.58,95%CI:0.42~0.80)。一项荟萃分析对长期服用阿司匹林(75~300 mg/d)的4个合并试验进行了调查,发现随访20年后CRC的风险降低了24%(n=14 033,HR=0.76,95%CI:0.63~0.94)[22]。阿司匹林治疗超过5年获益明显(HR=0.68,95%CI:0.54~0.87)。同样,对支持阿司匹林用于CRC一级预防的循证建议的文献分析发现开始使用阿司匹林治疗10~19 年后,CRC 风险降低了40%(RR=0.60,95%CI:0.47~0.76)[23]。
一项对726 例CRC患者(90%为中国人)的观察性研究表明术后使用阿司匹林的患者CRC复发及病死率比未使用阿司匹林的患者低60%,生存分析则显示使用阿司匹林的患者5年内的死亡率显著下降[24]。我国的一项前瞻性研究同样证实了服用阿司匹林是CRC的保护性因素。研究对204 170名阿司匹林服用者和408 339名非使用者进行了10年的随访,发现与非使用者相比,阿司匹林服用者的CRC发病风险降低(RR=0.71,95%CI:0.67~0.75)[25]。
阿司匹林对CRC的化学预防也在家族性腺瘤息肉病患者、林奇综合征(遗传性非息肉病性CRC)患者等CRC高危人群中进行了研究。结直肠腺瘤/癌症预防计划1研究发现,阿司匹林不能降低家族性腺瘤性息肉病的结肠息肉负担,但使用1年或更长时间的阿司匹林可以减少最大的息肉大小[26]。CAPP2研究是以CRC为主要终点的阿司匹林随机安慰剂对照试验,调查了林奇综合征患者服用600 mg/d阿司匹林的情况。虽然最初的分析没有显示出显著差异,但之后的分析显示,对于服用阿司匹林至少2年的参与者CRC风险显著降低(HR=0.41,95%CI:0.19~0.86)[27-28]。英国国家健康与护理卓越研究所也因此更新了他们预防CRC的建议,特别提倡在至少2年内每天服用阿司匹林。最新研究表明,连续服用阿司匹林2 年以上的林奇综合征患者,CRC的发病率降低50%,并且阿司匹林的这种保护作用可持续20年[29]。
目前已有大量研究证实阿司匹林对CRC具有较好的预防作用,然而也有一些研究没有得出积极的结论。医生健康研究共纳入22 071名男性医师,比较了隔日服用325 mg阿司匹林与安慰剂对CRC的预防效果。经过12年的随访发现,阿司匹林的使用与CRC的发病率无明显相关[30]。seAFOod研究共纳入709例CRC高危患者,随机分为安慰剂组、二十碳五烯酸组、阿司匹林组和联合治疗组,持续干预12月。结果显示,各组间患者结直肠腺瘤检出率无显著差异[31]。这些临床结果差异有可能来自于阿司匹林剂量、使用频率及使用时长不同。随访中的脱落、数据缺如也可能是影响试验结果的因素。
关于使用阿司匹林预防老年人CRC的数据有限且结论不一。老年患者是需要特别关注的一部分人群。他们是癌症高风险人群,通常有许多合并症,服用多种药物,生理年龄和实际年龄之间经常存在差异,且存在出血和血栓发生的高风险。一项针对老年患者(≥65岁)的前列腺癌、肺癌、CRC和卵巢癌的筛查试验显示阿司匹林具有保护作用。每周使用阿司匹林≥3次可以降低CRC的风险(HR=0.71,95%CI:0.61~0.84,P<0.001)[32]。然而最近发表的一项随机双盲安慰剂对照研究(ASPREE)显示,在年龄≥70岁(美国黑人或西班牙裔≥65岁)的老年人中使用81~100 mg的阿司匹林,平均随访4.7年后CRC相关的死亡风险增加(HR=1.77,95%CI:1.02~3.06,P<0.05)[33]。服用阿司匹林对老年人CRC没有益处有几种可能的原因:首先,治疗和/或随访的持续时间可能不足,这一点可能会通过长期随访进一步明确;其次,阿司匹林可能会有潜在的生物效应,这种效应可能会因接触时间的不同而不同,绝大多数ASPREE参与者(89%)在登记前从未定期使用阿司匹林,阿司匹林在晚年服用可能并不能有效降低癌症风险;第三,老年人发生CRC的途径可能不同,CpG岛甲基化表型、BRAF突变发生率更高,而阿司匹林可能对这些途径较不敏感[34]。阿司匹林对老年患者CRC的化学预防作用有待更多的临床试验提供证据。
2 阿司匹林化学预防的副作用、适宜剂量及使用时间
消化道出血是长期服用阿司匹林最常见及最严重的不良反应,且出血事件的发生呈剂量依赖性。另外,阿司匹林与幽门螺杆菌具有协同作用,研究发现,既往存在幽门螺杆菌感染的患者,服用阿司匹林后可使消化性溃疡的发病率增高[35]。一项针对ASPREE研究的亚组分析发现,老年人服用低剂量阿司匹林进行一级预防,其发生严重消化道出血的风险增高60%[36]。预防及治疗阿司匹林所致消化道损伤的临床研究也在进行中。质子泵抑制剂(PPIs)是预防阿司匹林所致消化道损伤的首选药物。富马酸沃诺拉赞是一种新型的可逆性PPI,其起效迅速,不受胃酸破坏并且可改善夜间酸突破现象。与15 mg兰索拉唑相比,10 mg富马酸沃诺拉赞可显著降低低剂量阿司匹林所致消化性溃疡复发率(P=0.039)[37]。临床研究表明,米索前列醇(200 μg,4次/d)可有效治疗低剂量阿司匹林所致的小肠溃疡、糜烂及出血[38-39]。
关于阿司匹林化学预防的适宜剂量,需要综合考虑各种因素以获得更高的效益-风险比。既往研究认为75~100 mg/d的阿司匹林是合理的选择。但新近的证据表明,身高、体质量或BMI可能会影响阿司匹林的生物利用度。包括吸烟在内的其他个体因素可能会抵消阿司匹林的化学预防作用。一项根据患者的体质量进行分层的研究发现,75~100 mg/d 的阿司匹林仅能够降低体质量小于70 kg人群的CRC患病风险,体质量大于80 kg的人群则需要325 mg/d以上的阿司匹林剂量才能发挥预防作用[40]。所以是否需要根据患者的体质量调整阿司匹林剂量也是要考虑的问题。有学者对截至2019年3月发表的所有关于阿司匹林和消化道部位癌症的观察性研究进行了系统回顾和荟萃分析,结果显示,对于CRC而言,75~100 mg/d的阿司匹林剂量可以降低10%的风险,325 mg/d的阿司匹林剂量可以降低35%的风险[41]。但考虑到出血风险,目前低剂量阿司匹林进行化学预防可能更为适宜。
关于阿司匹林化学预防的使用时间,目前暂无定论。研究发现使用5年的CRC风险降低了20%,使用10年的CRC风险降低了30%。长期使用阿司匹林的风险趋于平稳[41]。一项对队列研究的荟萃分析表明,需要至少5年使用阿司匹林,才能显示出对CRC风险的保护作用[42]。在阿司匹林用于预防心血管疾病的随机对照试验的汇集分析中,超过5年的治疗明显降低了CRC的发病率和死亡率。
3 阿司匹林对CRC化学预防作用的分子机制及进展
阿司匹林降低CRC风险的确切机制尚不明确。目前阿司匹林对CRC化学预防的作用机制主要包括环氧合酶(COX)依赖性途径和非COX依赖性途径(表1)。COX是负责合成前列腺素的酶,COX-1亚型主要参与血管舒缩、血小板聚集等功能调节;COX-2亚型在许多肿瘤细胞系中异常表达,并参与肿瘤的发生、生长、凋亡和血管生成过程。
3.1 COX依赖性途径
阿司匹林抑制COX活性,导致前列腺素合成减少和血小板活性受抑制。前列腺素已被证明在炎症、黏膜损伤修复和肿瘤发展中具有主要的调节性作用。血小板已被证明可促进肿瘤生长、诱导肿瘤血管生成。其可以通过TGF-β/sMAD信号通路诱导上皮-间充质转化来激活肿瘤侵袭,并通过促进肿瘤细胞附着于内皮、外渗和播种来进行转移。阿司匹林不可逆转地抑制血小板COX-1,影响血小板的释放和聚集,从而对肿瘤细胞起到抑制作用[43]。此外,阿司匹林还通过抑制肿瘤细胞中COX-2的合成来减少前列腺素的合成,从而抑制Wnt对β-catenin的信号转导,β-catenin是细胞增殖、生长和存活的一个途径[44-46]。
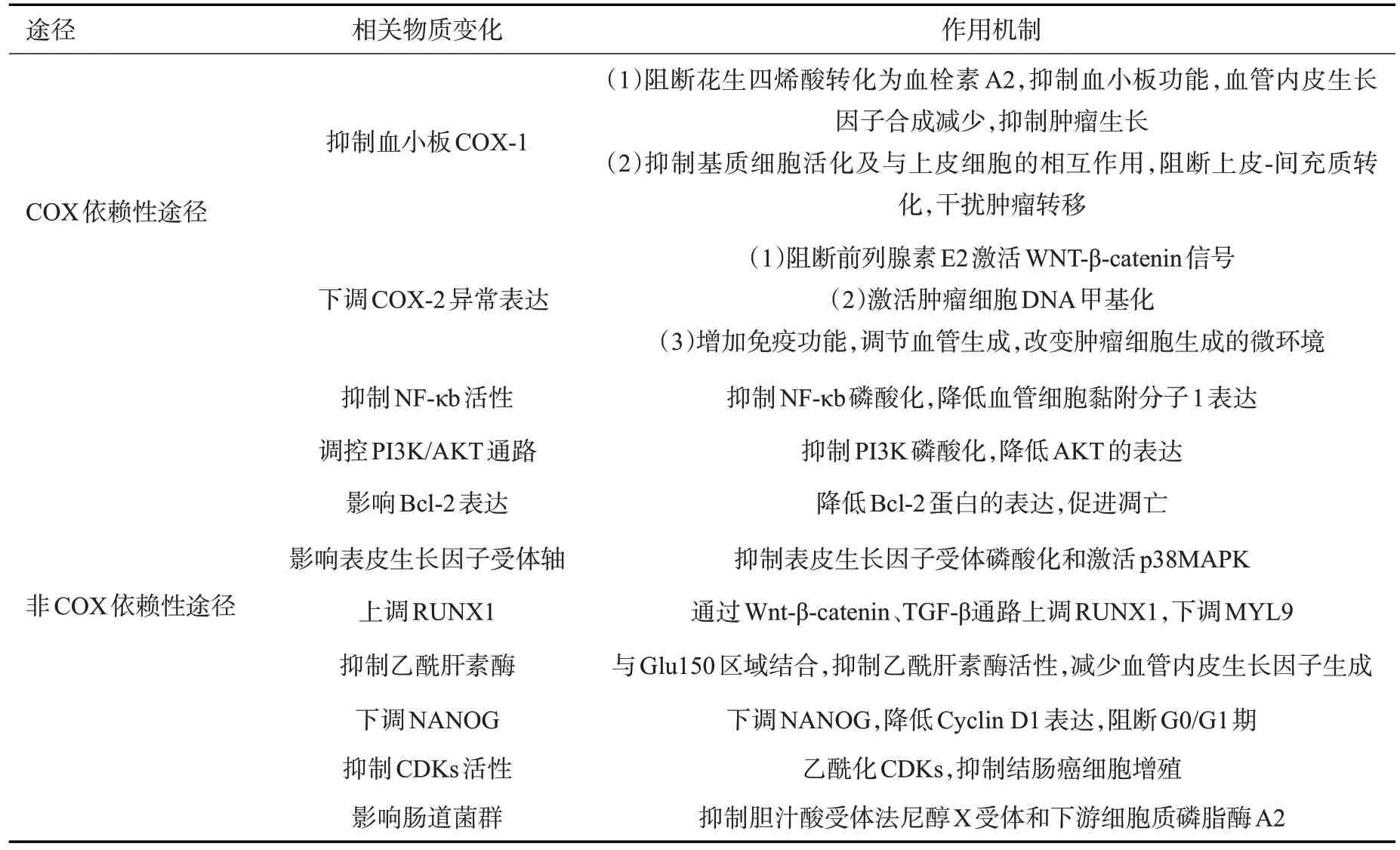
表1 阿司匹林预防CRC的作用机制Tab.1 Mechanism of aspirin in preventing CRC
3.2 非COX依赖性途径
非COX依赖性途径与调控肿瘤细胞内多个信号传导通路有关,包括NF-κB 活性、调控PI3K/AKT 信号通路、调节Bcl-2 表达、影响表皮生长因子受体(EGFR)轴等途径[47-54]。研究表明,RUNX1、乙酰肝素酶、NANOG、CDKs、肠道菌群也可介导阿司匹林的抗癌作用[55-60]。
NF-κB是一种控制DNA转录的蛋白复合体,它可以改变细胞的正常信号传导,启动癌基因的转录,参与调控细胞的增殖或凋亡[47-48]。研究表明阿司匹林可抑制NF-κB的磷酸化,降低血管细胞黏附分子1的表达,从而抑制肿瘤血管,降低细胞的粘附和迁移能力[49]。Stark等[50]发现阿司匹林可以通过NF-κB信号通路来促进结肠癌细胞的凋亡。
PI3K/AKT信号通路参与调节细胞生存、增殖以及细胞活动等对肿瘤发生和发展至关重要的过程[51]。有学者对PIK3CA突变型结肠癌细胞进行了体外实验,发现阿司匹林可通PI3K/AKT 通路使PI3K 的磷酸化降低,进而使AKT的表达降低,从而抑制癌细胞的增殖,诱导凋亡和自噬的发生。研究也表明阿司匹林可延长PIK3CA突变型结肠癌患者的生存率[52]。
Bcl-2家族蛋白按功能可分为两大类,一类具有抑制凋亡的作用,如Bcl-2、Bcl-XL、Bcl-W等;而另一类则具有促进凋亡的作用,如Bax、Bcl-Xs、Bad等。当Bcl-2表达增高时,细胞免于凋亡;当Bax表达增高时,细胞则更容易在各种诱导因素作用下发生凋亡。研究发现阿司匹林可降低Bcl-2蛋白的表达水平,从而表现出抗肿瘤作用[53]。
约80%的结肠癌患者会出现EGFR过度表达现象,这表明EGFR 可能在结肠癌发病过程中发挥重要作用。研究显示,阿司匹林作用的前列腺素可以上调家族多发性腺瘤患者的EGFR表达。对正常人结肠黏膜、服用和未服用阿司匹林的家族多发性腺瘤患者的腺瘤性息肉进行免疫组化染色,发现EGFR在结肠癌发生早期即出现过表达,而常规服用阿司匹林可以显著降低EGFR表达[54]。
RUNX1是肠道肿瘤中的抑癌基因。研究发现阿司匹林可通过Wnt-β-catenin 和TGF-β信号通路上调RUNX1,进而下调结直肠肿瘤的促癌基因MYL9,发挥抗癌作用,其中RUNX1 P1亚型的高表达与结肠肿瘤患者预后的改善显著相关[55]。
乙酰肝素酶是内源性β-D-葡糖醛酸糖苷酶,可促进释放血管内皮生长因子,重塑肿瘤微环境,促进肿瘤血管生成及转移。研究表明阿司匹林可直接与乙酰肝素酶的Glu150区域结合,抑制其酶活性,减少血管内皮生长因子等促血管生成因子的释放,抑制肿瘤血管新生及转移[56]。
NANOG是胚胎干细胞和肿瘤干细胞的关键调控因子,NANOG的过度表达与多种恶性肿瘤的预后不良相关。NANOG下调可降低Cyclin D1的表达,阻断G0/G1 期的细胞周期。研究表明阿司匹林可通过下调NANOG来减弱肿瘤干细胞的活性,从而抑制癌细胞的增殖[57]。
CDKs是细胞周期调控的核心,在细胞增殖过程中起着至关重要的作用,已成为抗肿瘤新的研究靶点。研究表明阿司匹林的代谢产物及其衍生物可通过乙酰化CDKs抑制其活性,从而抑制结肠癌细胞增殖[58]。
最近的研究表明阿司匹林可能通过免疫机制间接或直接通过局部效应影响与CRC和炎症相关的肠道微生物群,从而降低CRC的风险[59]。肠道微生物群是肠道内稳态、宿主免疫活性和肠道干细胞增殖、再生的关键决定因素。其可以通过抑制胆汁酸受体法尼醇X受体和下游细胞质磷脂酶A2的功能影响肠道干细胞更新,从而促进肿瘤的启动和CRC的进展[60]。
4 小结与展望
目前CRC的化学预防研究已经取得了一定的进展,大量研究表明阿司匹林除了降低心血管疾病风险外,对CRC也具有相当可观的化学预防作用,能够降低CRC的发病率。然而目前所获得的临床证据并不一致(表2),其可能由于不同研究选取的研究人群及入选标准不同,并且阿司匹林的使用剂量和随访时间都可能导致无法明确其在CRC中的预防作用。对于是否使用阿司匹林进行CRC预防,应综合考虑病人的年龄、危险因素、治疗意愿以及效益——风险比等多种因素进行全面的评估,期望在最低的风险水平达到最好的预防效果。对于相对年轻(如预期寿命>10年)、无出血风险、有动脉粥样硬化性心血管疾病高危因素或者已患有该类疾病的患者,如果患者同时有服用阿司匹林的意愿及条件,可以使用低剂量阿司匹林用于CRC的预防,并在服药过程中进行规律的胃肠道出血监测。但对于年龄较大,合并有其他严重疾病,出血风险高或正在服用其他抗凝或抗血小板药物的患者,使用阿司匹林进行CRC预防会明显增加出血风险,预防CRC的效果无法保证,此时不建议使用阿司匹林。目前阿司匹林对CRC的化学预防尚未广泛运用于临床。针对治疗的个体化问题、寻找适当的生物标志物、筛选潜在获益人群、制定合理的给药方案都是我们今后需要继续探讨的方向。
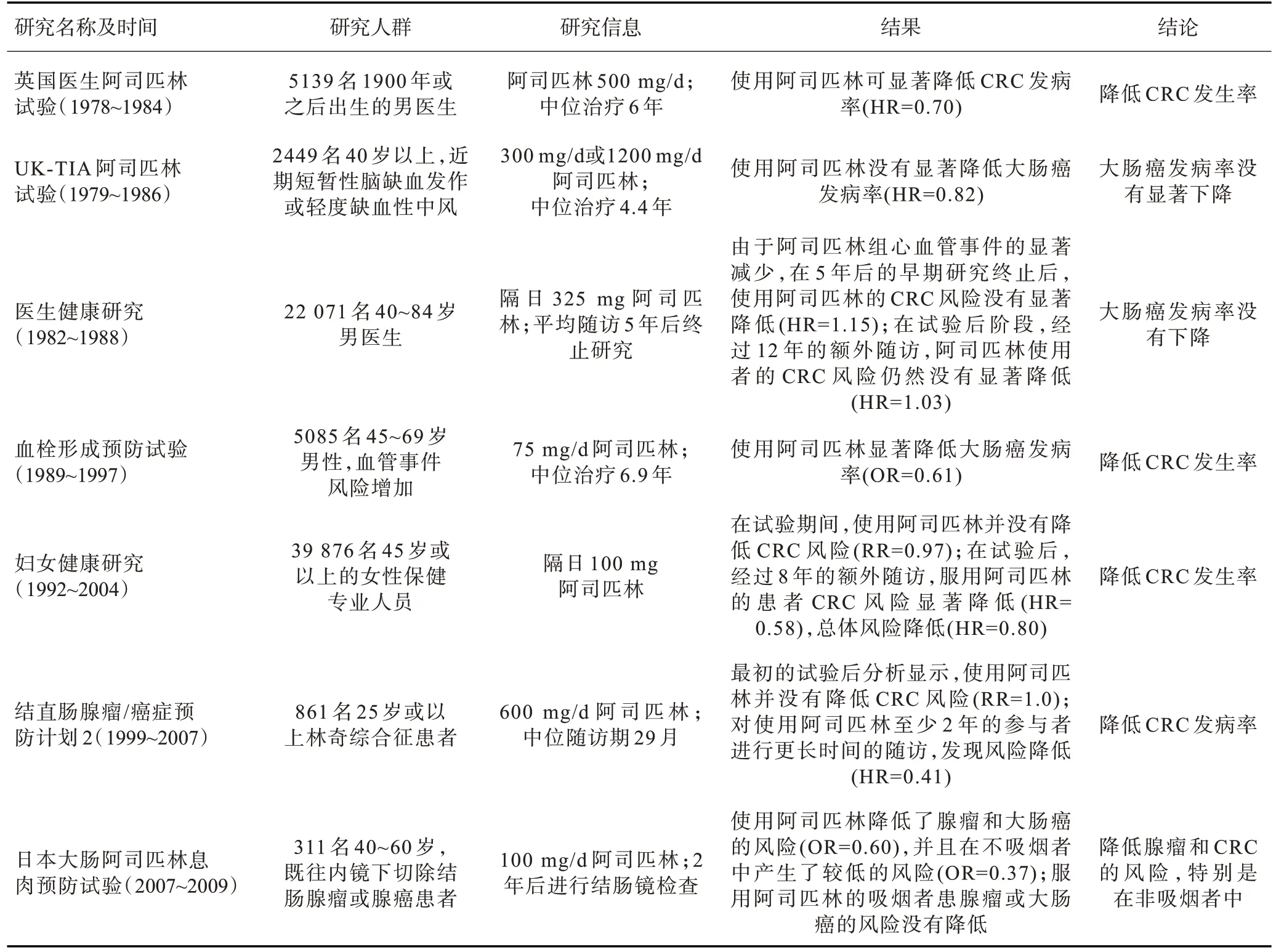
表2 阿司匹林预防CRC的随机安慰剂对照试验Tab.2 Randomized placebo-controlled trials of aspirin