超高效液相色谱-高分辨质谱测定大鼠血清中神经递质及其在电离辐射脑损伤动物模型中的应用
2021-05-24孟宪双邓玉林
孟宪双,白 桦,马 强,马 宏,邓玉林
(1.北京理工大学生命学院,北京 100081;2.中国检验检疫科学研究院,北京 100176)
神经递质(neurotransmitter)在机体信息传导和调控生理机能方面发挥着重要作用。乙酰胆碱是20世纪上半叶第一个被确定为神经递质的化学物质[1]。根据结构不同,现代生物化学一般将神经递质分为单胺类、氨基酸类、肽类及其他类,其中单胺类和氨基酸类是主要的神经递质。单胺类神经递质包括儿茶酚胺和吲哚胺两大类,儿茶酚胺包括多巴胺、去甲肾上腺素和肾上腺素,吲哚胺主要指5-羟色胺;氨基酸类神经递质包括γ-氨基丁酸、甘氨酸、谷氨酸、组胺及乙酰胆碱。有研究证实某些神经递质的失调或紊乱与多种神经性病理过程密切相关,如阿尔茨海默症(Alzheimer's disease, AD)、帕金森氏病(Parkinson's disease, PD)以及成瘾(adduction)、抑郁症(depression)和精神分裂(schizophrenia)等[2-4]。因此,高效测定生物样本中的神经递质浓度及其变化,在神经生理学研究、疾病的预测和诊断、药物质量控制等方面都有着重要意义。
生物样本基质复杂,而神经递质含量较低(纳摩尔级),因此,内源性成分往往对其测定造成较大干扰,是生物医学分析领域的难题。近年来,有研究人员采用多种检测技术,如化学修饰电极直接检测[5-12]、高效液相色谱/毛细管电泳-电化学法[13-17]、荧光成像法[18-19]、液相色谱-质谱法[20-23]测定不同组织样本中的神经递质等物质。其中,电化学法的灵敏度低、稳定性不佳,且修饰电极的使用寿命较短;荧光成像技术中常用的荧光探针大多为有机染料分子,其光稳定性不强、灵敏度低,且存在光漂白等缺点,在一定程度上限制了荧光成像技术的发展;近红外荧光成像技术的灵敏度高,且可实时成像,但受检测深度的限制,仅能做表面或近表面分析;色谱-质谱技术因分离效率高、灵敏度高、特异性强等优点成为生物样本重要的检测手段。近年来,高分辨质谱由于高选择性、可提供精确质量数、灵敏且数据可回溯等优势,已成为分析领域的重要检测技术。
本研究拟采用超高效液相色谱-四极杆-静电场轨道阱高分辨质谱(UPLC-Q-Orbitrap HRMS)技术,建立一种基于精确质量数据库和高分辨二级质谱库匹配的方法,用于快速、灵敏地分析血清中神经递质,以蛋白沉淀法进行大分子沉淀及目标成分的萃取,对方法的提取回收率、线性关系、精密度和准确度、稳定性、稀释效应及残留效应等进行考察,并将本方法初步应用于电离辐射致脑损伤大鼠血清中神经递质含量的测定及变化的研究。
1 实验部分
1.1 仪器、材料与试剂
UltiMate 3000超高效液相色谱仪(配有二元泵、在线真空脱气机、自动进样器和柱温箱)、Q Exactive静电场轨道阱高分辨质谱仪(配有ESI源):美国Thermo Fisher公司产品;XS105分析天平:瑞士Mettler Toledo公司产品;MS2涡旋振荡器:德国IKA公司产品;YM-080S超声仪:深圳市方奥微电子有限公司产品;CR 21G高速冷冻离心机:日本Hitachi公司产品。
多巴胺(CAS:51-61-6)、5-羟色胺(CAS:50-67-9)、肾上腺素(CAS:51-43-4)、5-羟吲哚乙酸(CAS:54-16-0)、乙酰胆碱(CAS:51-84-3)、去甲肾上腺素(CAS:51-41-2)、甘氨酸(CAS:56-40-6)、天冬氨酸(CAS:56-84-8)、谷氨酸(CAS:56-86-0)、γ-氨基丁酸(CAS:56-12-2)标准品:纯度均大于99.0%,分别购自美国Sigma-Aldrich公司、德国Dr. Ehrestorfer公司和美国AccuStandard公司;甲醇、乙腈和甲酸:LC-MS级,美国Thermo Fisher公司产品;超纯水:由美国Millipore公司生产的MILLI-Q50超纯水机制得。
1.2 标准溶液的配制
精密称取适量的每种神经递质标准品,用65%乙腈-水溶解制得100 mmol/L的标准储备液;分别精密量取1 mL各标准储备液至10 mL容量瓶中,用初始流动相定容,配制成10 mmol/L混合标准溶液,置于-20 ℃保存,分析前在4 ℃冰箱中自然解冻。
1.3 动物处理及血清采集
24只雄性远交群(SD)大鼠(体重200~250 g):购自斯贝福(北京)生物技术有限公司,随机分为对照组(8只)和辐照组(16只),辐照组再平均分成2组,分别以10 Gy和30 Gy剂量进行Co60-γ射线脑部照射,剂量率为2.519 4 Gy/min,适应性饲养30天后处死。
将全部大鼠称重,并腹腔注射戊巴比妥钠(60 mg/1 kg体重)进行麻醉;待麻醉后约20 min,将大鼠以仰卧位固定于木板上,用环形钳夹住大鼠颈部及左右腹股沟,环形钳手柄套固定于铁钉,大鼠即固定好;打开胸腔,将心脏暴露,用注射器(实验前用EDTA溶液浸润)以心脏穿刺法进行取血。将血置于灭菌的离心管中,室温下凝固1~2 h(如凝血效果不好,可放置4 ℃冰箱中过夜,使血液充分凝固),4 ℃下以3 500 r/min离心10 min,吸取上清液,分装并标记好,在-80 ℃黑暗条件下保存。
1.4 血清样本预处理
精密吸取100 μL样本至1.5 mL EP离心管中,加入400 μL蛋白沉淀剂工作溶液(0.1%甲酸-乙腈溶液,使用前在-20 ℃预冷1 h),涡旋30 s,冰水浴中超声15 min,-20 ℃黑暗条件下沉淀过夜,4 ℃下以12 000 r/min离心15 min,取上清液,氮气吹干,用100 μL初始流动相复溶,待分析。
1.5 质量控制溶液的制备
精密量取5 mL磷酸盐缓冲溶液(PBS, 10×)于50 mL容量瓶中,加入超纯水,定容至刻度,配制成PBS溶液(1×),然后加入2.5 g牛血清白蛋白(BSA),混匀,作为空白血清模拟液使用。分别稀释空白血清模拟液配制低(LQC)、中(MQC)、高(HQC)3个浓度的质量控制(质控)样本,即分别为不高于定量限浓度3倍的低浓度质控样本,标准曲线范围中部附近的中浓度质控样本,以及标准曲线范围上限75%~95%处的高浓度质控样本。处理方式同1.4节,用于提取回收率及基质效应等考察。
1.6 实验条件
1.6.1色谱条件 Waters ACQUITY UPLC HSS T3色谱柱(2.1 mm×100 mm×1.8 μm);流动相:0.1%甲酸-水(A)和乙腈(B);进样量2 μL;柱温40 ℃;流速0.3 mL/min;梯度洗脱程序:0~1.5 min(5%B),1.5~4.0 min(5%~40%B),4.0~5.0 min(40%~95%B),5.0~6.0 min(95%B),6.0~6.1 min(95%~5%B),6.1~8.0 min(5%B)。
1.6.2质谱条件 电喷雾离子源正离子模式(ESI+);喷雾电压3.5 kV;毛细管温度350 ℃;鞘气压力2.76×105Pa;干燥气流速0.66 L/min;干燥气温度350 ℃;采集模式:数据依赖性全扫描(Full-scan MS/dd-MS2)。一级质谱参数如下:质量扫描范围m/z50~500;分辨率70 000;自动增益控制(AGC target)1×106;离子最大注入时间(maximum IT)100 ms。二级质谱参数如下:分辨率17 500;归一化碰撞能量(normalized collision energy)20、40、60 eV;自动增益控制1×105;离子最大注入时间50 ms;动态排除(dynamic exclusion)时间6 s;响应强度最高的离子数目(Top N)为5。神经递质的保留时间及加合离子等信息列于表1,提取离子流色谱图示于图1。
1.7 精确质量数据库和二级质谱库的建立
按照1.6节条件进行神经递质标准品溶液的采集,记录保留时间并保存二级质谱图。将每种化合物的名称、分子式、分子质量、CAS编号、离子化方式、一级精确质量数(m/z)、1~2个特征二级碎片离子、保留时间导入TraceFinder软件,建立精确质量数据库;将采集的每种化合物的二级质谱图导入mzVault谱图管理软件,建立高分辨二级质谱库。
2 结果与讨论
2.1 空白血清模拟液的选择
由于待测神经递质均属于血清中内源性成分,很难找到空白血清样本。因此,本实验选择与血清pH值接近的磷酸盐缓冲液作为基质,加入牛血清白蛋白模拟血清中存在的蛋白质等大分子,其浓度设置参考文献[24]。
2.2 预处理方法的优化
大鼠血清成分复杂,含丰富的蛋白质、磷脂等内源性物质,通常需要预处理。目前,血清的处理方法主要包括液-液萃取法(liquid-liquid extraction, LLE)、固相萃取法(solid phase extraction, SPE)和蛋白沉淀法(protein precipitation, PPT)。其中,LLE法对血清样本具有一定的纯化能力,但提取效果易受取样位置高低的影响,对极性小分子的萃取效率较低;SPE法需特殊装置,过程繁琐;PPT法相对简单,快速高效,且容易实现高通量。
本实验中,神经递质的辛醇-水分配系数(logKow)均小于1.5,极性较大。因此,精密吸取100 μL 100 nmol/L的质控样本,选择常见的极性溶剂,如乙腈(MeCN)、甲醇(MeOH)、0.1%甲酸-乙腈(0.1%FA-MeCN)、0.1%甲酸-甲醇(0.1%FA-MeOH)、甲醇-乙腈(50∶50,V/V)和甲醇-乙腈(25∶75,V/V)进行PPT法处理比较,示于图2。结果表明,对多巴胺、5-羟色胺、肾上腺素、5-羟吲哚乙酸、去甲肾上腺素及谷氨酸的萃取效果,乙腈优于甲醇;对乙酰胆碱、甘氨酸、天冬氨酸及γ-氨基丁酸的萃取效果,乙腈和甲醇相差无几;不同体积比例混合的甲醇-乙腈体系的萃取效果不同,在乙腈中添加0.1%甲酸的萃取效果优于甲醇-乙腈体系。综合考察,选择0.1%甲酸-乙腈作为蛋白沉淀剂。
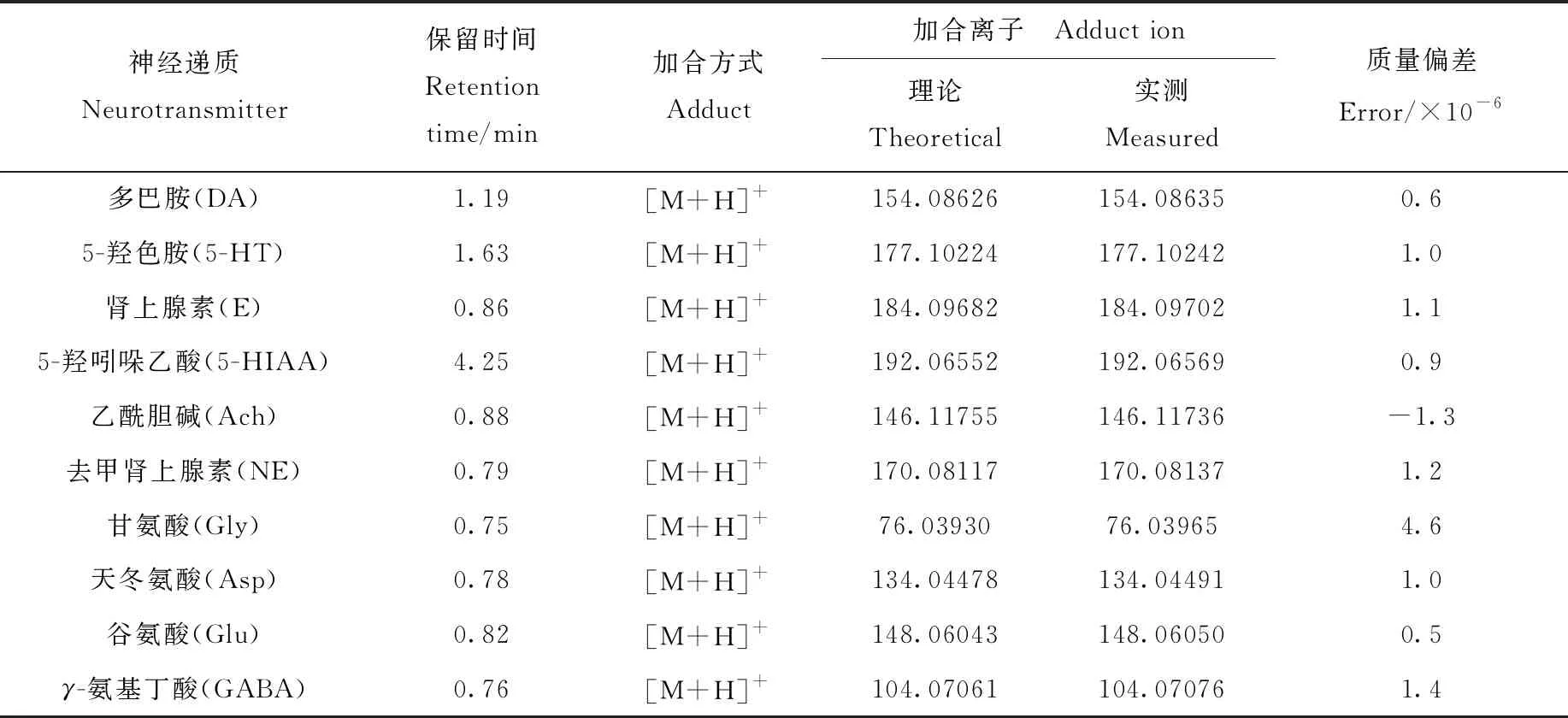
表1 神经递质的实验参数Table 1 Analysis parameters of neurotransmitters
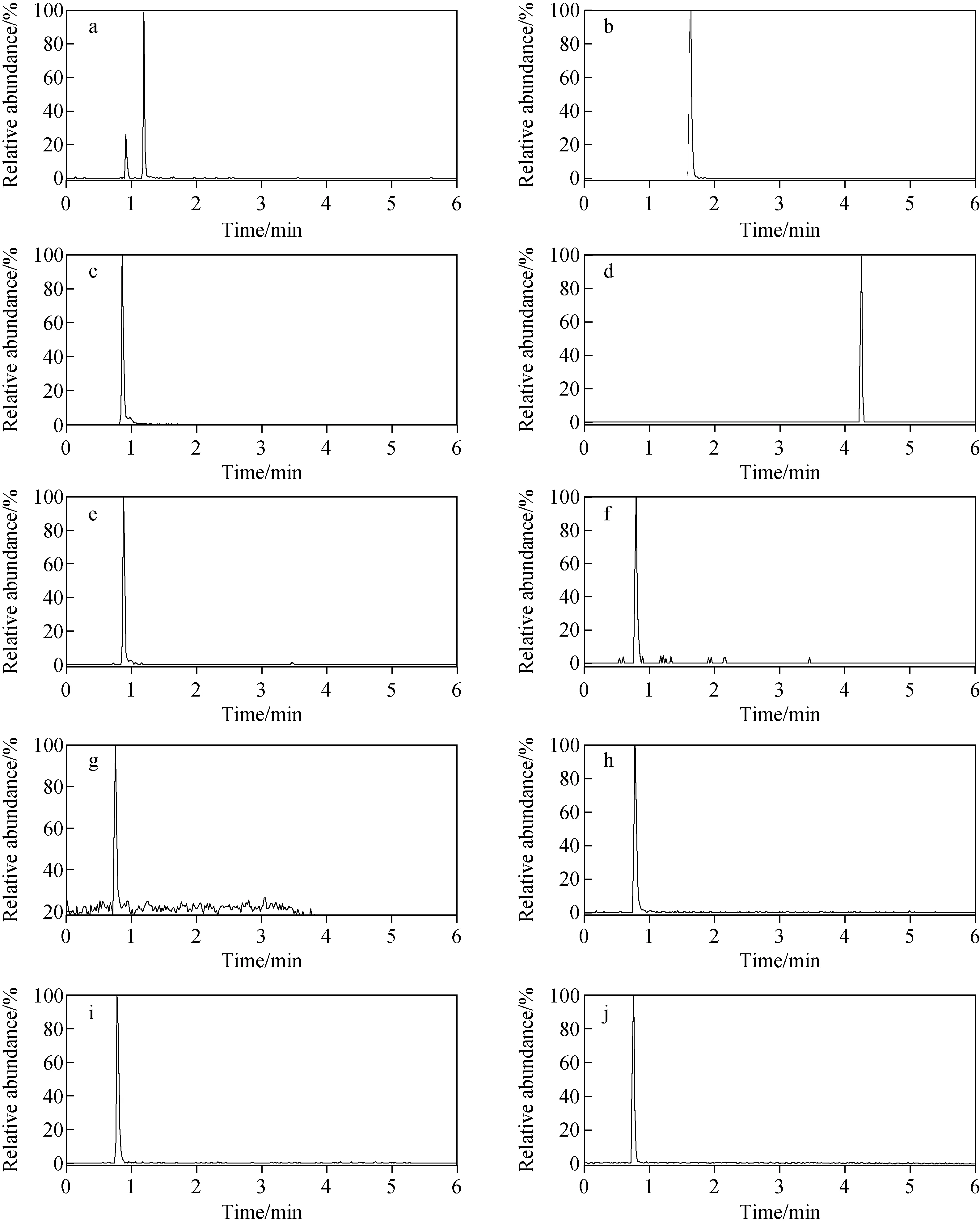
注:a.多巴胺;b.5-羟色胺;c.肾上腺素;d.5-羟吲哚乙酸;e.乙酰胆碱; f.去甲肾上腺素;g.甘氨酸;h.天冬氨酸;i.谷氨酸;j.γ-氨基丁酸图1 10种神经递质的提取离子流色谱图Fig.1 Extracted ion chromatograms of ten neurotransmitters
2.3 数据库和谱库的快速精准鉴定
以血清中乙酰胆碱为例,首先,TraceFinder软件根据设置的参数,进行一级精确质量数(m/z146.117 55)提取,窗口为5×10-6;第二,针对保留时间,如果误差在±3SD范围内,则认为该项匹配成功;第三,比较实验测得的同位素峰分布图与理论图谱(由输入的分子式计算得出),得分超过90则认为匹配较好;第四,将输入数据库中的2个特征碎片离子与实验采集获得的2个碎片离子进行比对,如果实验值与数据库中碎片离子的精确质量数偏差不超过5×10-6,则认为匹配成功;第五,将采集的二级质谱图与谱库进行比对,得分大于50则认为匹配程度较高。当上述5项关键参数全部比对成功,则可认定目标物检出,结果示于图3。

图2 血清中10种神经递质的沉淀剂考察结果(n=6)Fig.2 Optimization results of the precipitants for 10 neurotransmitters in serum (n=6)

注:a.精确质量数和保留时间;b.同位素峰分布; c.二级质谱图和特征碎片离子;虚线框代表特征碎片离子图3 乙酰胆碱的精确质量数据库 和二级质谱库的鉴定Fig.3 Identification of acetylcholine using the home-made accurate mass database and MS/MS spectra library
2.4 方法学考察
2.4.1基质效应及提取回收率 采用空白血清模拟液分别配制6批次低、中、高浓度的神经递质溶液,按1.4节方法处理,记录各神经递质的仪器响应强度A,用来模拟空白血清经标准添加和预处理后的神经递质响应值;将空白血清模拟液按照1.4节方法处理后,标准添加神经递质,配制6批次低、中、高浓度(浓度与前者相同)的溶液,记录每种待测物的质谱响应强度B,用来模拟空白血清经预处理,再经标准添加的神经递质响应值;分别采用65%乙腈-水配制6批次低、中、高浓度(浓度与前者相同)的神经递质溶液,记录每种待测物的响应强度C,代表纯溶剂中待测物的响应值。本实验提取回收率(extraction recovery, ER)和基质效应(matrix effect, ME)的计算方法为:ER=A/B×100%,ME=B/C×100%,实验结果列于表2。可见,提取回收率在73.6%~104.2%之间,相对标准偏差(RSD)为2.6%~10.6%,满足生物样本的分析要求;基质效应为62.4%~112.2%,RSD为1.9%~10.1%,表明该方法存在基质效应,且对多数神经递质存在基质抑制效应。为补偿基质效应,本实验采用空白血清模拟液基质匹配标准曲线进行定量分析。
2.4.2线性关系、检出限及定量限 采用至少7个浓度水平的神经递质溶液进行线性回归,以色谱峰面积为纵坐标(y),样品浓度为横坐标(x)进行加权最小二乘法回归计算,权重系数为1/x2。结果表明,在各自线性范围内,每种神经递质均表现出良好的线性关系,相关系数(R2)均大于0.99;检出限及定量限分别为0.07~12.81 nmol/L和0.12~25.61 nmol/L,列于表3。该方法的线性范围宽、灵敏度高,能够满足生物样本的分析要求。

表2 提取回收率及基质效应考察结果(n=6)Table 2 Experiment results of extraction recovery and matrix effect (n=6)

表3 标准工作曲线、线性范围、检出限及定量限结果Table 3 Results of standard working curve, linear range, limits of detection (LODs) and limits of quantitation (LOQs)
2.4.3稳定性考察 本实验采用低、中、高浓度溶液进行稳定性考察,主要包括以下方面:标准品储备溶液的稳定性(4 ℃黑暗条件下放置1个月,测定3次)、冻融循环稳定性(质控样品经3个冻融循环)、短期稳定性(处理后的血清样本在自动进样器中15 ℃条件下放置24 h)以及长期稳定性(血清样本于-80 ℃放置3个月)。采用准确度(REC)表示实测结果与真实浓度值之间的差异,以RSD表示同一份样本多次分析测定结果间的接近程度,结果列于表4。可见,低、中、高浓度的溶液在4 ℃条件下放置1个月的准确度为-3.8%~9.5%,测定精密度RSD为0.1%~8.1%;3次冻融循环的REC值为0.3%~9.7%,RSD为0.1%~8.5%;处理后的血清样品在自动进样器中15 ℃条件下放置24 h的REC值为-8.2%~9.2%,RSD为0.3%~7.5%;血清样品于-80 ℃条件下放置3个月的REC值为-8.6%~9.8%,RSD为1.1%~9.9%。以上结果表明,标准溶液、质控样品及血清样本的稳定性可满足生物样品的分析要求

表4 血清中神经递质的稳定性考察结果Table 4 Results of stability for neurotransmitters in serum
。
2.4.4稀释效应和残留效应 稀释效应(dilution effect)指将确定高浓度的生物样本进行一定倍数稀释后,测定浓度与理论浓度比较后的准确度和精密度,二者应在±15%范围内才能确保稀释的可靠性,其结果列于表5。经10倍稀释后,准确度为5.1%~10.6%,精密度RSD值为1.1%~5.3%,均在±15%范围内。

表5 稀释效应及残留效应考察结果Table 5 Results of dilution effect and carry-over effect
在生物样品分析方法评价中,当线性范围的最高浓度样品溶液连续进样后,须分析空白溶剂或空白样品以评估残留效应(carry-over effect, COE),其可允许接受的范围应不超过定量限的20%。本实验通过连续3次进样每种物质线性范围最高浓度的质量控制样本,然后进样分析空白溶剂(初始流动相),评估本方法的残留效应。在高浓度样品连续3次进样后分析初始流动相,残留神经递质的峰面积与其在定量限浓度样本中的峰面积比值在0.4%~4.6%之间,符合分析方法评价要求。
2.5 在电离辐射致脑损伤大鼠血清中的应用
将建立的分析方法初步应用于Co60-γ射线电离辐射致脑损伤大鼠血清中神经递质含量变化的研究。根据本课题组前期工作的基础[25],本实验综合考察0~50 Gy剂量对大鼠的影响,结果表明,大鼠在10、30 Gy两个剂量辐照下30天时,胸腺和脾脏的脏器指数均发生了明显变化,故以此作为本实验的大鼠辐照剂量。辐照后,大鼠血清中天冬氨酸、乙酰胆碱、去甲肾上腺素、肾上腺素和甘氨酸的含量变化示于图4。5种神经递质均表现出不同程度的下降,说明经电离辐射致脑损伤后,某些神经递质可能作为潜在的生物标志物。本工作还需深入开展研究,如加大样本数量、考察辐射剂量率及不同饲养时间等。

注:a.天冬氨酸;b.乙酰胆碱;c.去甲肾上腺素; d.肾上腺素;e.甘氨酸图4 大鼠血清中5种神经递质经辐照后的变化情况Fig.4 Changes of five neurotransmitters in rat serum after irradiation
3 结论
本研究采用UPLC-HRMS结合精确质量数据库和二级质谱库,建立了血清中10种神经递质的快速测定方法,采用蛋白沉淀法高效萃取目标化合物。使用空白血清模拟液(PBS+BSA)基质匹配的标准工作曲线进行定量分析,补偿基质效应。方法经提取回收率、线性关系、检出限、定量限、稳定性、稀释效应及残留效应等方面考察,满足生物样本的分析要求。此外,基于本方法的Co60-γ射线辐照动物模型的研究结果为筛选急性电离辐射致脑损伤血清中生物标志物提供了实验依据。
